Какой металл горит синим пламенем
Обновлено: 06.05.2024
Цвет пламени при горении соединений, содержащих металлы - стронций, литий, кальций, натрий, железо, молибден, барий, медь, бор, теллур, таллий, селен, мышьяк, индий, цезий, рубидий, калий, свинец, сурьма, цинк. Цвет пламени спирта.
Про спирт: хотя чистый этиловый спирт горит синим пламенем, а метиловый спирт горит зелёным пламенем - технические присадки поменяют цвет в соответствии с таблицей ниже, что не позволяет достоверно отличить метиловый спирт от этилового по цвету пламени, да и остальные способы малонадежны. Не пейте неизвестно какой спирт - вероятность умереть, если это метанол, выше 80%.
| Металл, входящий в соединение | Цвет пламени |  |
| Стронций Sr | Темно-красный | |
| Литий Li | Малиновый | |
| Кальций Ca | Кирпично-красный | |
| Натрий Na | Желтый | |
| Железо Fe | Светло-желтый | |
| Молибден Mb | Желто-зеленоватый | |
| Барий Ba | Желтовато-зеленый | |
| Медь Cu | Ярко-зеленый или сине-зеленый | |
| Бор B | Бледно-зеленый | |
| Теллур Te | Зеленый | |
| Таллий Tl | Изумрудный | |
| Селен Se | Голубой | |
| Мышьяк As | Бледно-синий | |
| Индий in | Сине-фиолетовый | |
| Цезий Cs | Розово-фиолетовый | |
| Рубидий Rb | Красно-фиолетовый | |
| Калий K | Фиолетовый | |
| Свинец Pb | Голубой | |
| Сурьма Sb | Зелено-синий | |
| Цинк Zn | Бледно сине-зеленый |
Дополнительная информация от Инженерного cправочника DPVA, а именно - другие подразделы данного раздела:
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста.
Вложите в письмо ссылку на страницу с ошибкой, пожалуйста.
Опыты: Цветное пламя
Очень красивый научный эксперимент от профессора Николя "Цветное пламя" позволяет получить пламя четырех разных цветов, используя для этого законы химии.

Набор интереснейший, мы действительно на пламя насмотрелись, удивительное зрелище! Интересно всем: и взрослым, и детям, так что очень рекомендую! Плюс в том, что этот опыт с огнём можно провести и дома, не обязательно выходить на улицу. В наборе есть чашки-плошки, в которых горит таблетка сухого горючего, всё безопасно, и на деревянном полу (или столе) можно поставить. Из серии опытов профессора Николя.
Лучше, конечно, под присмотром взрослых опыт проводить. Даже если дети уже немаленькие. Огонь всё же - штука опасная, но при этом . жутко (тут именно это слово подходит очень точно!) интересная!

Фото упаковки набора смотрите в галерее в конце статьи.
Набор 'Цветное пламя' содержит все необходимое для проведения эксперимента. В набор входят:
- иодид калия,
- хлорид кальция,
- раствор соляной кислоты 10%,
- сульфат меди,
- нихромовая проволока,
- медная проволока,
- хлорид натрия,
- сухое горючее, чашка для выпаривания.

Единственное, есть у меня некоторые претензии к производителю - я ожидала найти в коробочке мини-брошюру с описанием химического процесса, который мы здесь наблюдаем, и объяснение, почему пламя становится цветным. Такого описания здесь не оказалось, так что придётся обратиться к энциклопедии по химии (обзор книг по химии здесь). Если, конечно, будет такое желание. А желание у старших детей, конечно, возникает! Младшим детям, конечно, никакие объяснения не нужны: им просто очень интересно смотреть, как меняется цвет пламени.
На обратной стороне коробки-упаковки написано, что нужно делать, чтобы пламя стало цветным. Сначала делали по инструкции, а потом стали просто пламя разными порошками из баночек посыпать (когда убедились, что всё безопасно) - эффект потрясающий. Всполохи красного пламени в жёлтом, ярко-салатовое пламя, зелёное, фиолетовое. зрелище просто завораживает.

Очень здорово покупать на какой-нибудь праздник, это гораздо интереснее любой петарды. И на новый год будет очень здорово. Мы жгли днём, в темноте было бы ещё эффектнее.
Реактивы у нас после сжигания одной таблетки ещё остались, так что, если взять другую таблетку (купить отдельно), можно повторить опыт. Глиняная чашка отмылась довольно хорошо, так что её на много опытов хватит. А если вы на даче, то порошок можно посыпать и на огонь в костре - он тогда, конечно, быстро кончится, но зрелище будет фантастическое!
Добавляю краткую информацию о реактивах, которые идут в комплекте с опытом. Для любознательных детишек, которым интересно узнать больше.
Окрашивание пламени

Стандартный способ окрашивания слабосветящегося газового пламени - введение в него соединений металлов в форме легколетучих солей (обычно, нитратов или хлоридов):
желтое - натрия,
красное - стронция, кальция,
зеленое - цезия (или бора, в виде борноэтилового или борнометилового эфира),
голубое - меди (в виде хлорида).
В синий окрашивает пламя селен, а в сине-зеленый - бор.
Температура внутри пламени различна и с течение времени она меняется (зависит от притока кислорода и горючего вещества). Синий цвет означает что температура очень высокая до 1400 С, желтый - температура чуть меньше, чем когда синее пламя. Цвет пламени может меняться в зависимости от химических примесей.
Цвет пламени определяется только его температурой, если не учитывать его химический (точнее, элементный) состав. Некоторые химические элементы способны окрашивать пламя в характерный для этого элемента цвет.

В лабораторных условиях можно добиться совершенно бесцветного огня, который можно определить лишь по колебанию воздуха в области горения. Бытовой же огонь всегда "цветной". Цвет огня определяется температурой пламени и тем, какие химические вещества в нём сгорают. Высокая температура пламени дает возможность атомам перескакивать на некоторое время в более высокое энергетическое состояние. Когда атомы возвращаются в исходное состояние, они излучают свет с определённой длиной волны. Она соответствует структуре электронных оболочек данного элемента.
Голубой огонек, например, который можно видеть при горении природного газа, обусловлен угарным газом, который и придаёт пламени этот оттенок. Угарный газ, молекула которого состоит из одного атома кислорода и одного атома углерода, является побочным продуктом горения природного газа.
Калий - фиолетовое пламя

Калий (нем. Kalium, франц. и англ. Potassium) — один из важнейших представителей группы щелочных металлов.
Калий — металл наиболее электроположительный после рубидия и цезия. В чистом сухом воздухе при обыкновенной температуре он не изменяется, в обычном — покрывается слоем едкого калия и углекислой его соли; в свежем разрезе в темноте светится, а в тонких пластинках окисляется столь быстро, что может загореться; расплавленный и нагретый, он также горит; пламя его обладает фиолетовым цветом. Вследствие такой склонности к окислению и является необходимым сохранять его под нефтью.
Открывают присутствие калия по фиолетовой окраске газового беcцветного пламени, которая получается при внесении в пламя его соединений, особенно галоидных, на ушке платиновой проволоки (вот почему в опыте нужно вносить калий в пламя на проволоке - эффект изменения цвета пламени тогда заметнее); в присутствии солей натрия окраску наблюдают через синее кобальтовое стекло или через раствор индиго, помещенный в призматический стеклянный сосуд. Спектр пламени характеризуется двумя линиями - красной и фиолетовой.
Кальций хлористый - красное пламя

При нагревании на воздухе или в кислороде кальций воспламеняется и горит красным пламенем с оранжевым оттенком. С менее активными неметаллами (водородом, бором, углеродом, кремнием, азотом, фосфором и другими) кальций вступает во взаимодействие при нагревании.
При внесении в пламя растворимых солей кальция пламя окрашивается в кирпично-красный цвет.
При нагревании в кислороде и на воздухе кальций воспламеняется, сгорая ярко-красным пламенем, при этом образуется основной оксид СаО, который представляет собой белое, весьма огнестойкое вещество, температура плавления которого примерно 2 600 °C. Оксид кальция также известен в технике как негашеная или жженая известь.
Соляная кислота и медь - зелёное пламя
Медь придает пламени зеленый оттенок. При высоком содержании меди в сгораемом веществе пламя имеет яркий зеленый цвет, практически идентичный белому. В зеленый цвет пламя окрашивает борная кислота или медная (латунная) проволока, смоченная в соляной кислоте.
При смачивании соляной кислотой пламя окрашивается в голубой цвет с зеленоватым оттенком.

1) В зеленый цвет пламя окрашивает борная кислота или медная (латунная) проволока, смоченная в соляной кислоте.
2) В красный цвет пламя окрашивает мел, смоченный в той же соляной кислоте.
При сильном прокаливании в тонких осколках Ва-содержащие (Барий-содержащие) минералы окрашивают пламя в желто-зеленый цвет. Окрашивание пламени можно усилить, если после предварительного прокаливания смачивать минерал в крепкой соляной кислоте.
Окислы меди (в опыте для зелёного пламени используются соляная кислота и кристаллики меди) дают изумрудно-зеленое окрашивание. Прокаленные Cu-содержащие соединения, смоченные НС1, окрашивают пламя в лазурно-голубой цвет CuС12). Реакция очень чувствительна.
Зеленый цвет и его оттенки огню придают также барий, молибден, фосфор, сурьма.
Азотнокислый и солянокислый растворы меди имеют голубой или зеленый цвет; при прибавлении аммиака цвет раствора изменяется в темно-синий.
Жёлтое пламя - соль

Для желтого пламени требуется добавка поваренной соли, нитрата натрия или хромата натрия.
Попробуйте посыпать на конфорку газовой плиты с прозрачно-голубым пламенем чуть-чуть поваренныой соли - в пламени появятся жёлтые язычки. Такое жёлто-оранжевое пламя дают соли натрия (а поваренная соль, напомним, это хлорид натрия).
Жёлтый цвет - это цвет натрия в пламени. Натрий есть в любом природном органическом материале, поэтому пламя мы обычно и видим жёлтым. А желтый цвет способен заглушить другие цвета - такова особенность человеческого зрения.
Желтые язычки пламени появляются при распадении солей натрия. Такими солями очень богата древесина, поэтому обычный лесной костер или бытовые спички горят желтым пламенем.
Секреты сумасшедшего профессора Николя
Цветное пламя
Фото упаковки - сбоку. Набор для экспериментов.

Серия химических опытов с профессором Николя.
Цветное пламя - состав набора.

Обратная сторона упаковки - как добиться цветного пламени.
Весь состав набора - чашки (глиняная и стеклянная, потом и для других опытов пригодятся), проволока, реактивы.
Рядом с куклой ростом 18 см для размера.
Химические реактивы для опыта Цветное пламя - на каждой коробочке подписано, что это такое.
Цветное пламя: проба на окрашивание пламени
Для химика пламя не только источник тепла, но и инструмент химического анализа. Давно известно, что некоторые химические соединения, введенные в пламя, придают ему характерную окраску. В этом можно убедиться, если в любое пламя внести кусочек поваренной соли.
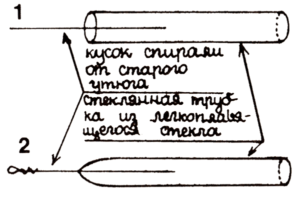
Возьмите кусок нихромовой проволоки (например, из старого утюга) длиной 10 см и выпрямите. Для опыта понадобится еще стеклянная трубка из легкоплавкого стекла. Надо заплавить проволоку в стеклянную трубку при помощи газовой горелки. Потом на конце проволоки сделайте маленькую петельку, как показано на рисунке.
Можно поступить не совсем спортивно и заменить стеклянную трубку корковой пробкой из винной бутылки.
При подведении определенного количества воздуха пламя газовой горелки становиться голубым и не коптит. Отчетливо видны в нем две части. Внутренняя часть называется восстанавливающей. Она голубого цвета и имеет сравнительно низкую температуру. Внешняя часть бесцветная — окисляющая. Температура этой части пламени равно около 1300 °С.
Растворите в нескольких миллилитрах воды, налитых в пробирку щепотку хлористого натрия. Очищенную проволоку погрузите в раствор, а потом введите в окисляющую часть пламени.

Какой великолепный эффект! Пламя в одно мгновение меняет окраску на интенсивно желтую. А теперь проверьте, содержит ли натрии вода, которую вы пьете (этот металл придает пламени желтый цвет). Результат анализа будет положительным. Можете проверить, содержат ли натрий другие вещества. Окажется, что натрий «пронырливый» металл, везде он есть, пламя всегда будет более или менее желтым.
Если вы уже знаете, как меняет окраску пламени натрий, проверьте «поведение» других металлов. Возьмите образцы солей кальция, стронция, бария, калия и меди. Лучше всего взять хлориды или нитраты. Если у вас их нет, возьмите другие соли, но помните, что сначала проволоку нужно очистить в пламени и соляной кислоте. После такой очистки опять опускайте проволоку в раствор анализируемого вещества, а затем вводите в окисляющую часть пламени.
При анализе твердых субстанций раскаленную проволоку опускают в анализируемое вещество, которое прилипает к ней и затем сплавляется в пламени горелки, образуя перл. Перл на мгновение опускают в соляную кислоту. Образующиеся при этом хлористоводородные соединения летучие и быстро испаряются с проволоки в пламени, окрашивая его в характерный цвет.
Вероятно вы удивитесь, когда начнете исследовать калий, так как цвет пламени будет такой же как в ходе анализа натрия, и лишь время от времени через желтое пламя будут проскакивать розовые отблески калия. Это потому, что натрий, содержащийся в воде, употребляемой для растворения образца, не позволяет калию показать себя в полной красоте. В пламени идет „борьба” между натрием и калием, в которой натрий побеждает. Если хотите, можете помочь победить калию. Наблюдайте через так называемое синее кобальтовое стекло. Это стекло представляет собой фильтр, который задерживает цвет натрия, пропуская цвет калия. Вы, наверное, огорчитесь, что в вашей лаборатории нет кобальтового стекла. Но не падайте духом, вместо него можно взять раствор метилового фиолетового. А если его тоже нет, растворите в воде несколько капель синих чернил. Если будете наблюдать пламя через этот раствор, увидите фиолетовую вспышку, свидетельствующую о наличии калия.
А теперь сопоставьте результаты работы:
Металл Цвет пламени
Медный факел
Зная, что некоторые металлы окрашивают пламя, сделайте медный «факел». Это необыкновенно интересный опыт. Соберите аппаратуру, показанную на рисунке.
Всыпьте в пробирку несколько криеталликов какой-либо соли меди, например, CuSO4 (медный купорос), и добавьте до 1/3 высоты пробирки денатурат и несколько капель разбавленной соляной кислоты Закупорьте пробирку пробкой, через которую проходит трубка, изогнутая под прямым углом и суженая на конце. Поместите пробирку в химический стакан с горячей водой, денатурат начнет испаряться, увлекая с собой соль меди. Приставьте к выходу трубки горящую спичку: пары денатурата зажгутся, а пламя приобретет зелено-синий цвет. Эффект опыта необыкновенно красив, если его наблюдать в темной комнате.
А теперь модифицируйте опыт, взяв вместо соли меди ранее употреблявшиеся химические соединения, окрашивающие пламя. А если у вас есть бура или борная кислота, проверьте, как окрашивает пламя бор. Борную кислоту можно купите в аптеке. И еще одно: не заливайте пробирку более чем на 1/3 высоты. И ни в коем случае не нагревайте пробирку горелкой!
Цветные свечи
Чтобы получить свечи с разноцветным пламенем надо добавить в расплавленный парафин соль металла, окрашивающего пламя в той или иной цвет.
Синяя свеча. Покрасить парафин в синий цвет можно стеаратом меди. Эту соль получают смешивая растворы сульфата меди и хозяйственного мыла. Пламя свечи тоже будет синим, благодаря ионам меди.
Зеленая свеча. В качестве пигмента используется зеленый оксид хрома (III). Он получается при термическом разложении бихромата аммония (опыт с вулканом). Цвет пламени тоже будет зеленым.
Желтая свеча. Желтый хромат натрия окрасит парафин и пламя свечи в желтый цвет.
Красная свеча. Парафин подкрашивают любым красным пигментом, например гуашью. Чтобы пламя было красным надо добавитькакую-либо соль стронция или лития.
От чего зависит цвет огня? Описание, фото и видео

Свет и цвет
Пламя бывает разного цвета. Посмотрите в камин. На поленьях пляшут желтые, оранжевые, красные, белые и синие языки пламени. Его цвет зависит от температуры горения и от горючего материала. Чтобы наглядно себе это представить, вообразите спираль электрической плитки. Если плитка выключена — витки спирали холодные и черные. Допустим, вы решили подогреть суп и включили плитку. Сначала спираль становится темно-красной. Чем выше поднимается температура, тем ярче красный цвет спирали. Когда плитка разогревается до максимальной температуры, спираль становится оранжево-красной.
Естественно, спираль не горит. Вы же не видите пламени. Она просто очень горячая. Если нагревать ее дальше, то будет меняться и цвет. Сначала цвет спирали станет желтым, затем белым, а когда она раскалится еще больше, от нее будет исходить голубое сияние.
От чего зависит цвет пламени
Нечто подобное происходит и с пламенем. Возьмем для примера свечу. Различные участки пламени свечи имеют разную температуру. Огню нужен кислород. Если свечу накрыть стеклянной банкой, огонь погаснет. Центральный, прилегающий к фитилю участок пламени свечи, потребляет мало кислорода, и выглядит темным. Верхушке и боковым участкам пламени достается больше кислорода, поэтому эти участки ярче.
По мере того как пламя продвигается по фитилю, воск тает и потрескивает, рассыпаясь на мельчайшие частички углерода. (Каменный уголь тоже состоит из углерода.) Эти частички увлекаются пламенем кверху и сгорают. Они очень горячие и светятся, как спираль вашей плитки. Но частички углерода намного горячее, чем спираль самой жаркой плитки (температура сгорания углерода примерно 1 400 градусов Цельсия). Поэтому свечение их имеет желтый цвет. Около горящего фитиля пламя еще горячее и светится синим цветом.
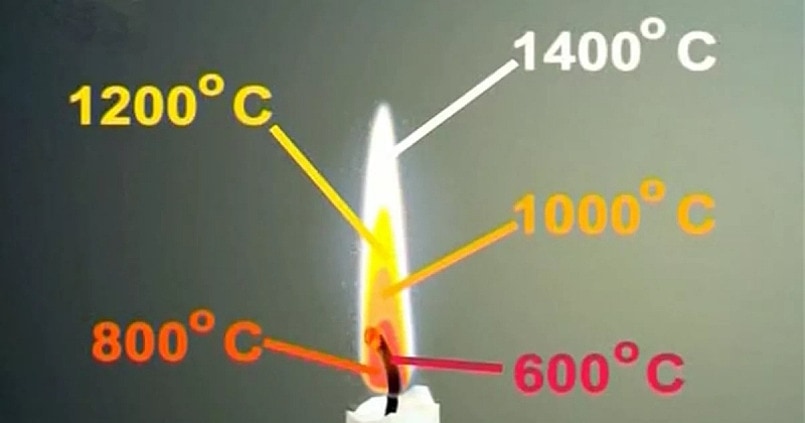
Температура огня на примере свечи
Пламя камина или костра в основном пестрого вида. Дерево горит при более низкой температуре, чем фитиль свечи, поэтому основной цвет костра — оранжевый, а не желтый. Некоторые частички углерода в пламени костра имеют довольно высокую температуру. Их немного, но они добавляют пламени желтоватый оттенок. Остывшие частички раскаленного углерода — это копоть, которая оседает на печных трубах. Температура горения дерева ниже температуры горения свечи. Кальций, натрий и медь, нагретые до высокой температуры, светятся разными цветами. Их добавляют в порох ракет для расцвечивания огней праздничных фейерверков.
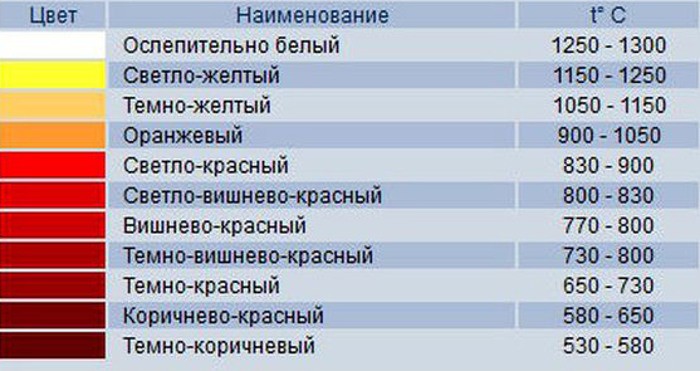
Зависимость цвета пламени от температуры
Цвет пламени и химический состав
Цвет пламени может меняться в зависимости от химических примесей, содержащихся в поленьях или другом горючем веществе. В пламени может находиться, например, примесь натрия. Натрий — это составная часть поваренной соли. Если натрий раскалить, он окрашивается в ярко – желтый цвет. В огонь может попасть кальций.

Цвет пламени и химический состав
Мы все знаем, что кальция много в молоке. Это металл. Раскаленный кальций окрашивается в яркий красный цвет. Если в огне горит фосфор, то пламя окрасится в зеленоватый цвет. Все эти элементы или содержатся в дереве, или попадают в огонь с другими веществами. Смешение цветов пламени, как и смешение цветов радуги, может дать белый цвет, поэтому в пламени костра или камина видны белые участки.
Интересное видео о цвете пламени
Если Вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Читайте также:
