Какой металл р семейства наиболее активен
Обновлено: 05.07.2024
Все металлы, в зависимости от их окислительно-восстановительной активности объединяют в ряд, который называется электрохимическим рядом напряжения металлов (так как металлы в нем расположены в порядке увеличения стандартных электрохимических потенциалов) или рядом активности металлов:
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au
Наиболее химически активные металлы стоят в ряду активности до водорода, причем, чем левее расположен металл, тем он активнее. Металлы, занимающие в ряду активности, место после водорода считаются неактивными.
Алюминий
Алюминий представляет собой серебристо-белого цвета. Основные физические свойства алюминия – легкость, высокая тепло- и электропроводность. В свободном состоянии при пребывании на воздухе алюминий покрывается прочной пленкой оксида Al2O3, которая делает его устойчивым к действию концентрированных кислот.
Алюминий относится к металлам p-семейства. Электронная конфигурация внешнего энергетического уровня – 3s 2 3p 1 . В своих соединениях алюминий проявляет степень окисления равную «+3».
Алюминий получают электролизом расплава оксида этого элемента:
Однако из-за небольшого выхода продукта, чаще используют способ получения алюминия электролизом смеси Na3[AlF6] и Al2O3. Реакция протекает при нагревании до 960 С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
Алюминий способен взаимодействовать с водой после удаления с его поверхности оксидной пленки (1), взаимодействовать с простыми веществами (кислородом, галогенами, азотом, серой, углеродом) (2-6), кислотами (7) и основаниями (8):
Кальций
В свободном виде Ca – серебристо-белый металл. При нахождении на воздухе мгновенно покрывается желтоватой пленкой, которая представляет собой продукты его взаимодействия с составными частями воздуха. Кальций – достаточно твердый металл, имеет кубическую гранецентрированную кристаллическую решетку.
Электронная конфигурация внешнего энергетического уровня – 4s 2 . В своих соединениях кальций проявляет степень окисления равную «+2».
Кальций получают электролизом расплавов солей, чаще всего – хлоридов:
Кальций способен растворяются в воде с образованием гидроксидов, проявляющих сильные основные свойства (1), реагировать с кислородом (2), образуя оксиды, взаимодействовать с неметаллами (3 -8), растворяться в кислотах (9):
Железо и его соединения
Железо – металл серого цвета. В чистом виде оно довольно мягкое, ковкое и тягучее. Электронная конфигурация внешнего энергетического уровня – [Ar]3d 6 4s 2 . В своих соединениях железо проявляет степени окисления «+2» и «+3».
Металлическое железо реагирует с водяным паром, образуя смешанный оксид (II, III) Fe3O4:
На воздухе железо легко окисляется, особенно в присутствии влаги (ржавеет):
Как и другие металлы железо вступает в реакции с простыми веществами, например, галогенами (1), растворяется в кислотах (2):
2Fe + Br2 = 2FeBr3 (при нагревании) (1)
Железо образует целый спектр соединений, поскольку проявляет несколько степеней окисления: гидроксид железа (II), гидроксид железа (III), соли, оксиды и т.д. Так, гидроксид железа (II) можно получить при действии растворов щелочей на соли железа (II) без доступа воздуха:
Гидроксид железа (II) растворим в кислотах и окисляется до гидроксида железа (III) в присутствии кислорода.
Соли железа (II) проявляют свойства восстановителей и превращаются в соединения железа (III).
Оксид железа (III) нельзя получить по реакции горения железа в кислороде, для его получения необходимо сжигать сульфиды железа или прокаливать другие соли железа:
Соединения железа (III) проявляют слабые окислительные свойства и способны вступать в ОВР с сильными восстановителями:
Производство чугуна и стали
Стали и чугуны – сплавы железа с углеродом, причем содержание углерода в стали до 2%, а в чугуне 2-4%. Стали и чугуны содержат легирующие добавки: стали– Cr, V, Ni, а чугун – Si.
Выделяют различные типы сталей, так, по назначению выделяют конструкционные, нержавеющие, инструментальные, жаропрочные и криогенные стали. По химическому составу выделяют углеродистые (низко-, средне- и высокоуглеродистые) и легированные (низко-, средне- и высоколегированные). В зависимости от структуры выделяют аустенитные, ферритные, мартенситные, перлитные и бейнитные стали.
Стали нашли применение во многих отраслях народного хозяйства, таких как строительная, химическая, нефтехимическая, охрана окружающей среды, транспортная энергетическая и другие отрасли промышленности.
В зависимости от формы содержания углерода в чугуне — цементит или графит, а также их количества различают несколько типов чугуна: белый (светлый цвет излома из-за присутствия углерода в форме цементита), серый (серый цвет излома из-за присутствия углерода в форме графита), ковкий и жаропрочный. Чугуны очень хрупкие сплавы.
Области применения чугунов обширны – из чугуна изготавливают художественные украшения (ограды, ворота), корпусные детали, сантехническое оборудование, предметы быта (сковороды), его используют в автомобильной промышленности.
Примеры решения задач
| Задание | Сплав магния и алюминия массой 26,31 г растворили в соляной кислоте. При этом выделилось 31,024 л бесцветного газа. Определите массовые доли металлов в сплаве. |
| Решение | Вступать в реакцию с соляной кислотой способны оба металла, в результате чего выделяется водород: |
Найдем суммарное число моль выделившегося водорода:
v(H2) = 31,024/22,4 = 1,385 моль
Пусть количество вещества Mg – х моль, а Al –y моль. Тогда, исходя из уравнений реакций можно записать выражение для суммарного числа моль водорода:
Тестовая работа по теме "Металлы" (11 класс)
А) Ca Б) М g В) Sr Г) Fe .
13.Тип связи в простом веществе натрия:
Б) ковалентная неполярная
В) металлическая
Г) ковалентная полярная
14. Наиболее ярко выраженные металлические свойства
проявляет:
А) Mg Б) K В) Al Г) Ca
15. Какую электронную конфигурацию имеет атом наиболее
активного металла?
А) 1 s 2 2 s 2 2 p 11 Б) 1 s 2 2 s 2 2 p 6 3 s 1
В) 1 s 2 2 s 2 Г) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1
16. Алюмотермия - это
А) восстановление алюминия водородом из его оксида
Б) восстановление металлов из оксидов алюминием
В) шлифовка алюминиевых изделий
Г) получение алюминиевых сплавов
ТЕСТ №2 по теме «Металлы»
1. Какому металлу соответствует электронная формула
1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 ?
А) Mo Б) Zn
В) Ba Г) Fe
2. При взаимодействии железа с разбавленной H 2 SO 4 образуется
3.Какой металл не вытеснит водород из разбавленной H 2 SO 4 ?
А) Fe Б) Cr В) Cu Г) Zn
4.В порядке уменьшения восстановительных свойств металлы расположены в ряду:
А ) Al, Zn, Fe Б ) Al, Na, K
В ) Fe, Zn, Mg Г ) Fe, Zn, Al
5.Оксиды CrO и CrO 3 -
А) основные
Б) основные и кислотные
В) кислотные
Г) кислотные и основные
6.К какому типу элементов относится железо?
А) р - элементам
Б) s -элементам
В) d -элементам
Г) f -элементам
7. На d - подуровне максимально может находиться:
А) 2е Б) 6е В)10е Г) 18е
8. Металлический хром может взаимодействовать с:
А) H 2 О Б) HCl (разб.)
В) HNO 3 (конц.) Г) NaOH (конц.)
9. Для металлов не характерно следующее физическое свойство:
А) теплопроводность
Б) металлический блеск
В) электропроводность
Г) хрупкость
10.Установите соответствии между металлом и способом его получения
А) Na 1. алюмотермия
Б) Fe 2. восстановление углеродом
В) Cr 3 . электролиз расплавов солей
11. С точки зрения типа кристаллической решетки «лишнее» простое вещество среди данных
А) алмаз В) железо
Б) хром Г) кобальт
12.Электронная формула иона Fe +2
А) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 6
Б) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 0 3 d 10
В) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 0 3 d 6
Г) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10
13. Свойства оксидов металлов побочных подгрупп с уменьшением степени окисления металла изменяются в следующем порядке
А) основные, амфотерные, кислотные
Б) кислотные, амфотерные, основные
В) основные, кислотные, амфотерные
Г) кислотные, основные, амфотерные
14. В схеме превращения
веществами X и Y соответственно являются
В) Fe и HCl
15. В схеме превращения
веществами X 1 , X 2 , X 3 соответственно являются
Урок по химии на тему "Металлы. Положение в ПСХЭ. Физические свойства"
Тема урока «Металлы, положение в Периодической системе химических элементов Д.И. Менделеева. Нахождение в природе. Физические свойства».
Цель урока: обобщить и закрепить теоретические знания учащихся о строение атомов металлов, химической связи, особенностях физических свойств металлов; Рассмотреть положение металлов Периодической системе химических элементов, особенности строения их атомов. Изучить общие физические свойства металлов. Развивать умение анализировать, делать выводы исходя о положении металлов периодической системы химических элементов
Оборудование: коллекция «Металлы и сплавы», модели кристаллических решеток.
Учитель: Ребята, сегодня мы начинаем изучать новую большую тему «Металлы». Работать мы с вами будем по плану
1. Нахождение металлов в природе.
2. Химические элементы – металлы: положение в ПСХЭ Д.И. Менделеева.
3. Строение атомов металлов.
4. Общие физические свойства металлов.
1. Учитель: Что же такое металлы? Учащиеся вспоминают ранее изученное в 8 и 9 классах. Как же металлы распространены в природе?
Учитель обращает внимание учащихся на таблицу в кабинете «Общие свойства металлов» на графу «Нахождение в природе». Учащиеся делают выводы о распространенности металлов в природе. Учитель обобщает и дополняет учащихся. В природе металлы находятся, как правило, в виде различных соединений (солей, оксидов, гидроксидов), но встречаются и в самородном состоянии (золото, платина). Встречаются руды сульфидные, карбонатные, оксидные и др., содержащие соответствующее соединение металла или, чаще, их смесь.
Например, встречаются следующие минералы:
Сульфиды: Fe2S - железный колчедан, ZnS - сфалерит, PbS - галенит.
Сульфаты: CaSO4 · 2H2O - гипс (строительный материал).
Карбонаты: CaCO3 · Mg CO3 - доломит.
2. Положение металлов в ПСХЭ.
Учитель. Какие же свойства металлов вам известны?. Учащиеся вспоминают электро- и теплопроводимость, блеск, твердость, ковкость и т.д.
Учитель. Чтобы это все объяснить, необходимо познакомиться с положением металлов в ПСХЭ. Давайте с вами посмотрим, где находятся металлы в периодической системе. Д.И.Менделеева? Почему?
В основном металлы расположены в левой части таблицы в I - III группе в главной и побочной подгруппе и в IV Б- VII Б группах побочных подгруппах. Атомы металлов главных подгрупп относятся к s - и р- семействам (т.к. у них заполняются эти подуровни) и d - и f - семейства – металлы побочных подгрупп. В группе главной подгруппы с верху вниз с увеличением радиуса атома увеличивается способность отдавать электроны, следовательно, усиливается восстановительная способность, число электронов на последнем уровне остается постоянным, не изменяется. В периоде слева на право радиус атома уменьшается, число электронов на последнем энергетическом уровне увеличивается, следовательно, способность атомов отдавать электроны уменьшается, значит уменьшается и восстановительные свойства. У металлов побочных подгрупп с увеличением заряда ядра радиус атома изменяется незначительно, т.к. заполняется предвнешний энергетический уровень. Поэтому прочность связи валентных электронов с ядром усиливается, восстановительные свойства ослабевают. Таким образом, заряд ядра атома, радиус атома сказываются на восстановительных свойствах всех металлов.
Тест "Металлы" 11 класс
1. Какая из следующих групп элементов содержит только металлы?
1) Li, Be, В; 2) К, Са, Sr; 3)Н, Li. Na; 4) Se. Те, Ро.
2. С увеличением порядкового номера элемента в главной подгруппе II группы
ПСХЭ и образуемых ими простых веществ изменяются следующим образом:
свойство: изменение:
1)восстановительные свойства; а) усиливаются;
2)радиус атома; б) увеличивается;
3)электроотрицательность; в) уменьшается;
4)число электронов на внешнем уровне; г) не изменяется.
название металла: число электронов на внешнем уровне:
4. В ряду химических элементов Mg –Ca –Sr--Ba металлические свойства :
3) изменяются периодически
4) не изменяются.
5. Верны ли следующие суждения о щелочных металлах?
А. Во всех соединениях они имеют степень окисления +1.
Б. С неметаллами они образуют соединения с ионной связью.
1) Верно только А
2) Верно только Б
3) Верны оба суждения
4) Оба суждения неверны
6. Какой из металлов встречается в земной коре в свободном состоянии?
1) цинк; 2) медь; 3) кобальт; 4) алюминий.
7. Какое из природных веществ можно назвать рудой?
1) известняк; 2) песок; 3) железный колчедан; 4) гранит.
8. В промышленности электролизом получают:
1) железо; 2) цинк; 3) свинец; 4) алюминий.
9. Процесс присоединения частицей электронов называется:
1) окислением; 2) восстановлением; 3) электролизом; 4) ассоциацией.
10. Какой из перечисленных металлов наиболее легко подвергается химической коррозии?
1) никель; 2) хром; 3) железо; 4) олово.
11. К амфотерным оксидам относятся
12. С водой не реагирует
1) магний 2) бериллий 3) барий 4) натрий
13.. Для алюминия в обычных условиях возможно взаимодействие с :
14. В реакции магния с концентрированной азотной кислотой окислителем является
15. Какой из процессов не является окислением?
а ) Cu 0 – 2e ------ Cu 2+ б ) Fe 2+ - 1e ------ Fe 3+ ;
в) Ni 2+ +2e ----- Ni 0 ; г) Ag 0 -1e ------ Ag + .
16. Установите соответствие между исходными веществами и продуктами окислительно-восстановительных реакций
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
17. Химическое взаимодействие возможно между:
1) оловом и хлоридом магния;
2) серебром и сульфатом меди (II);
3) магнием и бромидом натрия:
4) медью и нитратом ртути (II).
18. При нагревании 108 г. алюминия с 224 г. серы образуется сульфид алюминия Al2S3 количеством вещества __________________ моль (ответ запишите с точностью до целых)
Самостоятельная работа «МЕТАЛЛЫ»
Вариант II
1) Та , I, А g; 2) W, Nd, Zn; 3)Cd, Ir, В ; 4)Ga, Xe, F г .
2. В ряду элементов Bа ----- Sr ----- Ca ------- Mg наблюдается следующее изменение свойств:
свойство: изменение:
1)восстановительные свойства; а) уменьшается;
2) число энергетических уровней; б) ослабевают;
3) электроотрицательноеть; в) не изменяется;
4) число валентных электронов; г) увеличивается
3. Какое физическое свойство не является общим для всех металлов?
3) твердое агрегатное состояние при нормальных условиях;
4) металлический блеск.
4. В порядке увеличения восстановительной способности металлы расположены в ряду:
5. Число неспаренных электронов в атоме алюминия равно:
1) 1 2) 2 3) 3 4) 4
1) Натрий; 2) марганец; 3) хром; 4) платина.
7. Какой из процессов является химической основой металлургии?
4) верного ответа среди перечисленных нет.
1) кальций; 2) золото: 3) олово: 4) вольфрам.
9. Процесс отдачи частицей электронов называется:
1) окислением; 2) восстановлением; 3) электролизом; 4) ассоциацией.
10. Оксид с наиболее ярко выраженными основными свойствами образует
1) Be 2) Mg 3) Ba 4) Zn
11. Для растворения, как меди, так и железа следует использовать
1) концентрированную фосфорную кислоту
2) разбавленную азотную
3) разбавленную соляную
4) раствор гидроксида калия
12. Какой из перечисленных ионов является наиболее сильным окислителем?
а) Сu 2+ ; б)Mg 2+ ; в)Na +; г)Са 2+ .
13. Хлорид железа II получают реакцией
14. Медь не реагирует с
1) Разбавленной HNO3
2) Концентрированной HNO3
3) Разбавленной HCl
15. Химическое взаимодействие возможно между:
а) серебром и хлороводородной кислотой;
б) кобальтом и хлоридом магния;
в) цинком и нитратом олова (II);
г) свинцом и раствором серной кислоты.
16. В реакции цинка с концентрированной азотной кислотой окислителем является
17. Реакция возможна между
2) Zn и KCl (раствор)
3) Mg и SnCl2 (раствор)
4) Ag и CuSO4 (раствор)
18. При сгорании 140 г. железа в 112 л. хлора образуется хлорид железа III количеством вещества ___________ моль (Запишите число с точностью до десятых)
Активные металлы

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
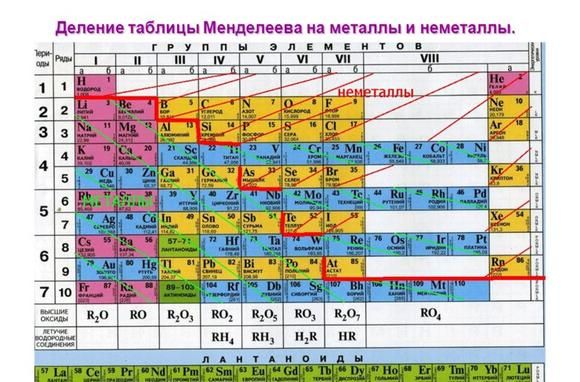
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Читайте также:
