Контрольная работа по химии 9 класс щелочные металлы
Обновлено: 16.05.2024
Тесты по химии 9 класс. Тема: "Щелочные металлы"
Правильный вариант ответа отмечен знаком +
1. К какой группе относятся щелочные металлы:
2. Какой элемент можно отнести к щелочным металлам:
3. Оксиды щелочных металлов при взаимодействии с водой образуют:
4. Какая степень окисления на внешнем энергетическом уровне у щелочных металлов:
5. Щелочные металлы являются:
- как восстановителями, так и окислителями
6. От лития к цезию:
+ увеличивается радиус атомов и уменьшается электроотрицательность
- уменьшается радиус атома и уменьшается электроотрицательность
- увеличивается радиус атома и увеличивается электроотрицательность
7. Какой цвет имеют щелочные металлы:
8. Кто впервые получил калий и натрий:
9. Формулой глауберовой соли является:
- KCl * MgCl2 * 6 H2O
тест 10. Каким путем получают щелочные металлы:
11. С галогенами щелочные металлы образуют:
12. При сгорании на воздухе какой металл образует оксид:
13. Какой металл образуется пероксид:
14. При взаимодействии металла с водородом образуется:
15. При каких условиях хранят натрий и калий:
+ под слоем керосина
- под слоем подсолнечного масла
- под слоем металлической пластинки
16. В какой цвет окрашивает катион лития пламя горелки:
17. Воздействие щелочи проявляется:
18. Поваренную соль используют:
+ для приготовления пищи
- для дезинфекции поверхностей
- в качестве анальгетического средства
19. Какая концентрация хлорида натрия содержится в физиологическом растворе:
тест-20. Главным внеклеточным ионом является:
21. Калийные удобрения используют в:
- в машинном производстве
- в пищевой промышленности
22. Температура плавления увеличивается:
+ от цезия к литию
- от лития к цезию
- от натрия к калию
23. Реакцией образования пероксида натрия является:
+ 2 Na + O2 = Na 2 O2
- 2 K + O2 = K2 O 2
- 4 Li + O2 = 2 Li O
24. Какая степень окисления в пероксидах:
25. Из пероксида натрия можно получить:
26. Реакцией получения пероксида натрия является:
+ Na2O2 + H2O = 2NaOH + H2O2
- 6 Li + N2 = 2Li3N
- 2Cs + 2H20 = 2CsOH + H2 (газ)
27. При взаимодействии лития с азотом образуется:
28. Каустической содой называют:
29. Гидроксид калия используется в:
- для очистки нефти и масел
- в производстве искусственных волокон
тест_30. Химические свойства щелочных металлов определяются:
- природой как катиона, так и аниона
31. На данной фотографии изображено пламя при горении металла. Какой металл горит в данном случае?

32. Электролизом хлорида натрия получают:
33. Из хлорида калия изготавливают:
34. Технической содой называют:
35. Питьевой содой можно назвать:
36. При нагревании гидрокарбонат разлагается на:
+ NaHCO3 = t = Na2CO3 + H20 + CO 2 (газ)
- NaHCO3 =t= H2CO3 + NaOH + O2 (газ)
- NaHCO3 = Na2CO3 + NaOH + CO2 (газ)
37. Гидрокарбонат натрия используют:
+ при изготовлении кондитерского блюда
- при производстве антидепрессантов
38. Карбонат калия обычно называют:
39. В каком году Иоганн Рудольф Глаубер открыл сульфат натрия:
Контрольная работа по теме "Щелочные металлы"
А 1. Сколько электронов содержат на внешнем энергетическом уровне атомы щелочных металлов:
а) два б) один в) три г) четыре
А 2. В химических реакциях металлический натрий проявляет:
а) окислительные свойства б) восстановительные свойства
в) кислотные свойства г) основные свойства
А 3. В ряду химических элементов Na → K → Rb → Cs → Fr металлические свойства:
а) усиливаются б) ослабевают
в) не изменяются г) изменяются периодически
А 4. Какой из щелочных металлов при взаимодействии с кислородом образует оксид:
а) натрий б) рубидий в) калий г) литий
А5. Соединения щелочных металлов с водородом называется:
а) галогениды б) гидроксиды в) гидриды г) нитриды
А 6. Какой из металлов в лаборатории хранят под слоем керосина:
а) железо б) калий в)медь г) цинк
А 7. Карбонат какого щелочного металла имеет техническое название «поташ»:
а) натрия б) калия в) лития г) цезия
А 8. На воздухе легче всего окисляется:
а) натрий б) литий в) рубидий г) калий
А 9. Какая формула соответствует гидроксиду и оксиду лития:
а) Li OH и Li 2 O б) Li ( OH )2 и LiO в) Li 2 O и Li ( OH )2 г) Li ( OH )2 и Li O 2
А 10. Какой металл поддерживает работу сердечной мышцы:
а) литий б) кальций в) калий г) рубидий
Часть Б (на выбор одно задание)
Б 1. Закончите уравнения реакций, характеризующие химические свойства металла. Дайте название продуктам реакции.
1) Na + Cl 2 =
2) Na + O 2 =
3) Na + H 2 =
4) Na + S =
5) Na + N 2 =
Na + H 2 O =
Б 2. Получите металл ( Al ) из его оксида ( Al 2 O 3) (пирометаллургия) всеми способами:
( восстановление углем С, угарным газом СО, водородом Н2, более активным металлом)
Часть С (на выбор одно задание)
С 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
К → К2О2→ К2О → КОН → К2 S О4
С 2. Решите задачу:
Какой объем кислорода потребуется для его взаимодействия с натрием количеством вещества 0,3 моль?
КОНТРОЛЬНАЯ РАБОТА
Тема: «Щелочные металлы». Вариант №2
А 1. В 1 группе главной подгруппе от лития к цезию металлические свойства
А 2. На внешнем энергетическом уровне атомы щелочных металлов содержат электронов:
А 3. Какой из металлов в лаборатории хранят под слоем керосина:
а) цинк б) магний в) медь г) натрий
А 4. В химических реакциях металлический калий проявляет:
а) окислительные свойства б) кислотные свойства
в) восстановительные свойства г) основные свойства
А 5. Калий взаимодействует с кислородом. Продукт этой реакции называется:
а) гидроксиды б) оксид в) гидрид г) пероксид
А 6. Карбонат какого щелочного металла имеет техническое название «глауберова соль»:
а) лития б) калия в) натрия г) цезия
А 7. Какая формула соответствует оксиду и гидроксиду калия:
а) К2 O 2 и К O Н б) Са O и Са( OH )2 в) К2 O и К( OH ) г)Са( OH )2 и Са O 2
А 9. Какой металл поддерживает работу сердечной мышцы:
А 10. При взаимодействии какого металла с водой одним из продуктов будет щелочь:
а) железо б) калий в) серебро г) цинк
Б 1. Закончите уравнения реакций, характеризующие химические свойства металла. Дайте названия продуктам реакций.
1) К + Cl 2 =
2) К + O 2 =
3) К + H 2 =
4) К + S =
5) К + N 2 =
6) К + H 2 O =
Б 2. Получите металл ( Fe ) из его оксида ( Fe 2 O 3) (пирометаллургия) всеми способами:
( восстановление углем С, угарным газом СО, водородом Н2, более активным металлом).
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Na → Na 2О2 → Na 2О→ Na ОН → Na 2 S О4
С2. Решите задачу:
Какой объем кислорода потребуется для его взаимодействия с калием количеством вещества 0,2 моль?
Получите свидетельство о публикации сразу после загрузки работы

Получите бесплатно свидетельство о публикации сразу после добавления разработки
Олимпиады «Осенний фестиваль знаний 2022»

Комплекты учителю

Качественные видеоуроки, тесты и практикумы для вашей удобной работы
Вебинары для учителей

Бесплатное участие и возможность получить свидетельство об участии в вебинаре.
Проверочная работа № 1 « Общая характеристика металлов, сплавы, Щелочные и Щелочноземельные металлы.»
Проверочная работа разработаны в тестовой форме для тематического контроля по школьному курсу химии 9 класса к авторской программе О.С. Габриэляна.
Содержимое разработки
Проверочная работа № 1 « Общая характеристика металлов, сплавы, Щелочные и Щелочноземельные металлы.»
1. Электронное строение внешнего энергетического уровня атомов щелочных металлов:
А) n S 1 В) n S 2 P 1 Б) n S 2 Г) n S 2 P 2
2. Степень окисления щелочных металлов:
А) - 1 В) – 2 Б) +1 Г) +2
3. Выберите ряд элементов, относящихся к щелочным металлам:
А ) Ca, Zn, Cl В ) Li, Na, Rb Б ) Mg, K, Al Г ) Cr, Mn, Co
4. Самый лёгкий щелочной металл: А) Na В) K Б) Li Г) Cs
5 Наиболее ярко выраженные металлические свойства у: А)Mg B)Ra Б)Ва Г)Са
6. С какими из перечисленных веществ реагируют щелочноземельные металлы:
А) S В) H 2 O Б) Cl 2 Г) Fe
7.Гидроксид кальция реагирует с: ( выберите все правильные ответы)
8.Сплав меди и олова 1) Бронза 2) чугун 3) сталь 4) дюралюминий
9/ Природный мел- это: А) CaSO4 Б) MgSO4 В)CaCO3 Г)ВаSO4
10/Способ получения натрия и калия: А) алюмотермия В) электролиз Б) магниетермия Г) пиролиз
11. Щелочные металлы находятся в природе в виде
А) оксидов Б) сульфидов В) в самородном виде Г) солей
В1. Установите соответствие между формулой вещества и названием
Формула вещества название
А) Ca(OH)2 1) едкое кали
Б) NaHCO3 2) известковое молоко
В) KOH 3) жженая магнезия
B 2 Верны ли следующие суждения о свойствах элементов IIA группы и строении их атомов?
А. Активность металлов возрастает от бериллия к радию.
Б. Атомы металлов IIA группы имеют электронную конфигурацию внешнего слоя ns 2 np 2.
1) оба суждения неверны 2) верно только А 3) верно только Б 4) верны оба суждения
C 1 Используя метод электронного баланса, составьте уравнение реакции
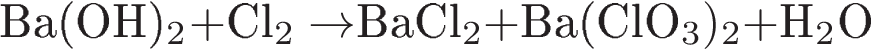
Определите окислитель и восстановитель.
С2 Рассчитайте массу осадка, который выпадет при взаимодействии избытка карбоната калия с 17,4 г раствора нитрата бария
Система оценивания:
0 – 9 баллов – «2» 10 – 16 баллов – «3»
17 – 20 баллов – «4» 21 – 24 баллов – «5»
Проверочная работа № 1 « Общая характеристика металлов, сплавы, Щелочные и Щелочноземельные металлы.» ВАРИАНТ 2
1.Электронное строение внешнего энергетического уровня атомов щелочноземельных металлов.
А ) n S 1 В ) nS 2 P 1 Б ) nS 2 Г ) n S 2 P 2
2/ Степень окисления бериллия, магния и щелочноземельных металлов.
А) +2 В) +4 Б) - 2 Г) - 4
3/ Выберите ряд элементов, относящихся к щелочноземельным металлам:
А) Ba, Sr, Ca В) Mg, K, Al Б) Na, K, Li Г) Ca, Mg, Ве
4/ Является радиоактивным металлом А) магний В) стронций Б) барий Г) радий
5/ Наиболее ярко выраженные металлические свойства у: А) лития В) калия Б) натрия Г) рубидия
6. С какими из перечисленных веществ реагируют щелочные металлы: А) S В) H 2 O Б) Cl 2 Г) Fe
7.С каким из перечисленных ниже классов веществ не взаимодействуют щелочи:
8/Сплав железа с углеродом 1)Бронза 2) чугун 3) латунь 4) дюралюминий
9/Где применяется соединения магния MgSO 4
А)в машиностроении Б)для получения серной кислоты В)для получения стекла
10. Где содержат щелочные металлы?
1) под слоем воде 2) под слоем керосина 3) под слоем спирта
4) под слоем смеси воды и спирта
11 . Какое свойство нехарактерно для вещества NaOH
А) разъедает бумагу Б) дает ожоги на коже В) твердое Г) жидкое
B 1 Установите соответствие между формулой вещества и его техническим названием:
Б) BaSO4 2) кристаллическая сода
В) NaOH 3) глауберова соль
Г) MgSO4 4) горькая соль
Д) CaCO3 5) баритова каша
B 2 Верны ли следующие суждения о магнии и его соединениях?
А. Магний реагирует и с кислотами, и со щелочами.
Б. Оксид магния является основным оксидом.
C1 Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель
C 2 Решите задачу. К раствору силиката калия массой 20,53 г прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
Тест по теме "Щелочные металлы"

Тест содержит задания по теме "Щелочные металлы" на 2 варианта. Можно использовать для контроля знаний учащихся по данной теме.
Просмотр содержимого документа
«Тест по теме "Щелочные металлы"»
Металлы IА группы
Щелочным металлом является
Ca 2) Cs 3) Cd 4) Sr
Только щелочные металлы находятся в ряду элементов
Na, Ca, K 3) Na, Rb, Ba
Li, K, Be 4) Cs, Rb, Li
В ряду щелочных металлов Li → Na → K происходит
Уменьшение их атомного радиуса
Ослабление притяжения внешних электронов к ядру
Увеличение степени окисления в соединениях
Степень окисления калия в пероксиде калия
Формула вещества с техническим названием поташ
Семейство щелочных металлов занимает IА группу периодической системы химических элементов Д.И. Менделеева.
Щелочные металлы используют для производства проводов.
В химических реакциях щелочные металлы проявляют сильные восстановительные свойства.
При горении все щелочные металлы образуют оксиды.
Максимальная степень окисления щелочных металлов в химических соединениях равна +2.
Щелочные металлы получают в промышленности путем электролиза расплавов их солей.
В схеме уравнения реакции Х + Н2О → У + Н2 веществами Х и У являются соответственно:
К и К2О 3) К и КОН
Гидроксид калия взаимодействует с каждым из веществ, формулы которых
Запишите уравнения возможных реакций.
Допишите уравнения возможных реакций:
NaOH + KCl → 4) KOH + CaO →
K + S → 5) LiOH + HNO3 →
Be 2) Mg 3) Rb 4) Ba
Li, Cs, Ca 3) Rb, K, Be
Cs, Na, Li 4) Na, K, Sr
В ряду щелочных металлов Cs → Rb → K происходит
Увеличение числа электронов на внешнем слое
Распределение электронов по электронным слоям в атоме калия
2, 8,1 2) 2, 8, 8,1 3) 2, 1 4) 2,2
Формула вещества с техническим названием едкий натр
С помощью электролиза раствора хлорида натрия можно получить натрий.
Все щелочные металлы легкоплавкие и легко режутся ножом.
На внешнем слое атомов щелочных металлов находится по одному электрону.
Щелочные металлы – это малоактивные простые вещества.
Щелочные металлы взаимодействуют с водой, образуя щелочь и водород.
При горении натрия в избытке кислорода образуется оксид натрия.
В схеме уравнения реакции Na + X→ NaOH + Y веществами Х и Y являются соответственно
Вещества, каждое из которых взаимодействует с гидроксидом лития
Проверочная работа по щелочным металлам
К щелочным металлам не относится:
а) рубидий; б) калий; в) цезий; г) медь.
Электронная формула 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 соответствует элементу:
а) литию; б) калию; в) натрию; г) меди.
Радиус атома у элементов I группы главной подгруппы с увеличением заряда ядра:
а) изменяется периодически; б) не изменяется; в) увеличивается; г) уменьшается.
Щелочные металлы проявляют очень сильные:
а) окислительные свойства; в) восстановительные свойства;
б) амфотерные свойства; г) нейтральные свойства.
Во всех своих соединениях щелочные металлы проявляют степень окисления:
а) +1; б) +2; г) +3; г) +4.
К физическим свойствам щелочных металлов не относится:
а) серебристо-белые; в) хорошие электропроводники;
б) мягкие и легкие; г) тугоплавкие.
При взаимодействии элементов I группы главной подгруппы с водой образуется:
а) кислота; в) оксид и выделяется водород;
б) щелочь и выделяется водород; г) соль .
При взаимодействии кислорода со щелочными металлами оксид образуется только с:
а) литием; б) калием; в) натрием; г) рубидием.
Щелочные металлы не взаимодействуют с:
а) неметаллами; в) водой;
б) растворами кислот; г) концентрированными кислотами.
Натрий и калий хранят в керосине или в минеральном масле, потому что они:
а) имеют резкий запах; в) легко окисляются на воздухе;
б) очень легкие; г) сильные окислители.
Проверочная работа по теме «Щелочные металлы»
Читайте также:
