Коррозионная стойкость металлов в соляной кислоте
Обновлено: 20.09.2024
Коррозия алюминия – разрушение металла под влиянием окружающей среды.
Для реакции Al 3+ +3e → Al стандартный электродный потенциал алюминия составляет -1,66 В.
Температура плавления алюминия - 660 °C.
Плотность алюминия - 2,6989 г/см 3 (при нормальных условиях).
Алюминий, хоть и является активным металлом, отличается достаточно хорошими коррозионными свойствами. Это можно объяснить способностью пассивироваться во многих агрессивных средах.
Коррозионная стойкость алюминия зависит от многих факторов: чистоты металла, коррозионной среды, концентрации агрессивных примесей в среде, температуры и т.д. Сильное влияние оказывает рН растворов. Оксид алюминия на поверхности металла образуется только в интервале рН от 3 до 9!
Очень сильно влияет на коррозионную стойкость Al его чистота. Для изготовления химических агрегатов, оборудования используют только металл высокой чистоты (без примесей), например алюминий марки АВ1 и АВ2.
Коррозия алюминия не наблюдается только в тех средах, где на поверхности металла образуется защитная оксидная пленка.
При нагревании алюминий может реагировать с некоторыми неметаллами:
2Al + N2 → 2AlN – взаимодействие алюминия и азота с образованием нитрида алюминия;
4Al + 3С → Al4С3 – реакция взаимодействия алюминия с углеродом с образованием карбида алюминия;
2Al + 3S → Al2S3 – взаимодействие алюминия и серы с образованием сульфида алюминия.
Коррозия алюминия на воздухе (атмосферная коррозия алюминия)
Алюминий при взаимодействии с воздухом переходит в пассивное состояние. При соприкосновении чистого металла с воздухом на поверхности алюминия мгновенно появляется тонкая защитная пленка оксида алюминия. Далее рост пленки замедляется. Формула оксида алюминия – Al2O3 либо Al2O3•H2O.
Реакция взаимодействия алюминия с кислородом:
Толщина этой оксидной пленки составляет от 5 до 100 нм (в зависимости от условий эксплуатации). Оксид алюминия обладает хорошим сцеплением с поверхностью, удовлетворяет условию сплошности оксидных пленок. При хранении на складе, толщина оксида алюминия на поверхности металла составляет около 0,01 – 0,02 мкм. При взаимодействии с сухим кислородом – 0,02 – 0,04 мкм. При термической обработке алюминия толщина оксидной пленки может достигать 0,1 мкм.
Алюминий достаточно стоек как на чистом сельском воздухе, так и находясь в промышленной атмосфере (содержащей пары серы, сероводород, газообразный аммиак, сухой хлороводород и т.п.). Т.к. на коррозию алюминия в газовых средах не оказывают никакого влияния сернистые соединения – его применяют для изготовления установок переработки сернистой нефти, аппаратов вулканизации каучука.
Коррозия алюминия в воде
Коррозия алюминия почти не наблюдается при взаимодействии с чистой пресной, дистиллированной водой. Повышение температуры до 180 °С особого воздействия не оказывает. Горячий водяной пар на коррозию алюминия влияния также не оказывает. Если в воду, даже при комнатной температуре, добавить немного щелочи – скорость коррозии алюминия в такой среде немного увеличится.
Взаимодействие чистого алюминия (не покрытого оксидной пленкой) с водой можно описать при помощи уравнения реакции:
При взаимодействии с морской водой чистый алюминий начинает корродировать, т.к. чувствителен к растворенным солям. Для эксплуатации алюминия в морской воде в его состав вводят небольшое количество магния и кремния. Коррозионная стойкость алюминия и его сплавов, при воздействии морской воды, значительно снижается, если в состав метала будет входить медь.
Коррозия алюминия в кислотах
С повышением чистоты алюминия его стойкость в кислотах увеличивается.
Коррозия алюминия в серной кислоте
Для алюминия и его сплавов очень опасна серная кислота (обладает окислительными свойствами) средних концентраций. Реакция с разбавленной серной кислотой описывается уравнением:
Концентрированная холодная серная кислота не оказывает никакого влияния. А при нагревании алюминий корродирует:
При этом образуется растворимая соль – сульфат алюминия.
Al стоек в олеуме (дымящая серная кислота) при температурах до 200 °С. Благодаря этому его используют для производства хлорсульфоновой кислоты (HSO3Cl) и олеума.
Коррозия алюминия в соляной кислоте
В соляной кислоте алюминий или его сплавы быстро растворяются (особенно при повышении температуры). Уравнение коррозии:
Аналогично действуют растворы бромистоводородной (HBr), плавиковой (HF) кислот.
Коррозия алюминия в азотной кислоте
Концентрированный раствор азотной кислоты отличается высокими окислительными свойствами. Алюминий в азотной кислоте при нормальной температуре исключительно стоек (стойкость выше, чем у нержавеющей стали 12Х18Н9). Его даже используют для производства концентрированной азотной кислоты методом прямого синтеза
При нагревании коррозия алюминия в азотной кислоте проходит по реакции:
Коррозия алюминия в уксусной кислоте
Алюминий обладает достаточно высокой стойкостью к воздействию уксусной кислоты любых концентраций, но только если температура не превышает 65 °С. Его используют для производства формальдегида и уксусной к-ты. При более высоких температурах алюминий растворяется (исключение составляют концентрации кислоты 98 – 99,8%).
В бромовой, слабых растворах хромовой (до10%), фосфорной (до 1%) кислотах при комнатной температуре алюминий устойчив.
Слабое влияние на алюминий и его сплавы оказывают лимонная, масляная, яблочная, винная, пропионовая кислоты, вино, фруктовые соки.
Щавелевая, муравьиная, хлорорганические кислоты разрушают металл.
На коррозионную стойкость алюминия очень сильно влияет парообразная и капельножидкая ртуть. После недолгого контакта металл и его сплавы интенсивно корродируют, образуя амальгамы.
Коррозия алюминия в щелочах
Щелочи легко растворяют защитную оксидную пленку на поверхности алюминия, он начинает реагировать с водой, в результате чего металл растворяется с выделением водорода (коррозия алюминия с водородной деполяризацией).
Выбор материала проточной части
Поверхностное разрушение металла под действием внешней среды называется коррозией.
Чистое железо и низколегированные стали неустойчивы против коррозии в атмосфере, в воде и многих других средах, так как образующаяся пленка окислов недостаточно плотна и не изолирует металл от химического воздействия среды. Некоторые элементы повышают устойчивость стали против коррозии, и таким образом можно подобрать сталь, практически не подвергающуюся разрушению в данной среде.
При введении таких легирующих элементов происходит скачкообразное повышение коррозионной стойкости. К примеру, введение в сталь более 12% хрома (Cr) делает ее коррозионностойкой в атмосфере и во многих других промышленных средах. Стали содержащие менее 12% Cr, практически в столь же большой степени подвержены коррозии, как и железо. Стали содержащие 12-14% Cr, ведут себя как благородные металлы: обладая положительным электрохимическим потенциалом, они не ржавеют и не окисляются на воздухе, в воде, в ряде кислот, солей и щелочей.
Хромистые нержавеющие стали
Хромистые нержавеющие стали применяют трех типов: 13, 17 и 27% Cr в зависимости от требований имеют различное содержание углерода.
Стали с более 17% Cr имеют иногда небольшие добавки титана и никеля, которые вводят для улучшения механических свойств. Помимо этого стали с таким содержанием хрома обладают высокой коррозионной стойкостью вплоть до температуры 900 ºС.
Стали с содержанием хрома 13% более распространенные и наименее дорогостоящие, их применяют для бытовых назначений и в технике. Эти стали хорошо поддаются сварке. Сплавы с низким содержанием углерода пластичны, с высоким - обладают высокой твердостью и повышенной прочностью, из них изготавливают детали повышенной прочности и износоустойчивости (хирургический инструмент, подшипники, пружины и другие детали, работающие в активной коррозионной среде).
Аустенитные стали
Введение достаточного количества никеля (Ni) в хромистую сталь обеспечивает лучшую механическую прочность, делает сталь более коррозионностойкой и не хладноломкой. Нержавеющие стали с 18% Cr и 10% Ni получили наиболее широкое распространение в машиностроении.
Для того, чтобы повысить сопротивление коррозии в кислотах в сталь вводят молибден и медь, особенно молибден с медью при одновременном увеличении содержания никеля. При необходимости, чтобы иметь еще и высокие механические свойства вводят титан и алюминий.
Более высокую коррозионную стойкость имеют никеливые сплавы типа хастеллой 80% Ni и 20% Mo (сплавы НИМО) с дополнительным легированием.
Титан
Титан (Ti) имеет высокую удельную прочность, благодаря чему сплавы на его основе получили широкое применение в технике, особенно в тех областях, где важное значение имеет масса (авиация, ракетостроение и др.). Титан обладает высокой коррозионной стойкостью в большом количестве агрессивных сред, превосходя зачастую в этом отношении нержавеющую сталь. Поэтому проще перечислить среды, в которых титан растворяется: например, плавиковая, соляная, серная, ортофосфорная, щавелевая и уксусная кислоты.
Высокая коррозионная стойкость титана обусловлена образованием на поверхности плотной защитной оксидной пленки. Если эта пленка не растворяется в окружающей среде, то можно считать, что титан в ней абсолютно стоек. Например, морская вода за 4000 лет растворит слой титана толщиной 30 - 40 микрон (1 микрон равен 10-4 см). Если же оксидная пленка растворима в данной среде, то применение в ней титана недопустимо.
Тугоплавкие металлы
К тугоплавким относят металлы: ванадий, вольфрам, гафний, молибден, ниобий, тантал, технеций, титан, хром, цирконий, - температура плавления которых выше температуры плавления железа (1539 ºС), кроме металлов платиновой и урановой групп и некоторых редкоземельных.
Следует отметить, что при высоких температурах все тугоплавкие металлы являются кислотостойкими. При этом наиболее сильно выделяется тантал. Ниобий и молибден по коррозионной стойкости превосходят сплавы на основе железа или никеля, однако уступают танталу.
Применение таких материалов целесообразно в средах, в которых другие материалы не обладают коррозионной стойкостью. К таким средам относятся неорганические крепкие кислоты при повышенных температурах, а так же некоторые промышленные среды.
Несмотря на высокую стоимость металлов по сравнению с такими коррозионностойкимиматериалами, как высоколегированная нержавеющая сталь или хастеллой, применение сплавов тугоплавких металлов оправдано, так как вследствие высокой стойкости возможно эксплуатировать химические установки практически весь срок без замены приборов.Коррозионная стойкость нержавеющих сталей в некоторых кислотах.Прии комнатной температуре высокой стойкостью в этой кислоте обладают все
Коррозионная стойкость нержавеющих сталей в некоторых кислотах
Серная кислота
При 70ºС хромоникелевые стали нестойки даже в кислотах слабой концентрации, но примерно до 5% H2SO4 могут работать стали с добавлением молибдена и меди.
Однако последние разрушаются в кипящей серной кислоте до концентрации 30%. В этих случаях следует применять сплавы типа хастеллой, а при концентрации выше 30% в кипящей серной кислоте могут работать лишь тугоплавкие металлы.
Фосфорная кислота
При комнатной температуре любой концентрации устойчивы аустенитные стали, хромистые нет. В горячей кислоте устойчивы стали с добавками молибдена и меди до концентрации 25%, в кипящей - хастеллой до 50%, а при более высокой устойчивы лишь тугоплавкие металлы.
В соляной кислоте устойчивы стали с добавлением молибдена или меди при комнатной температуре и до концентрации 5%.
Коррозионная стойкость металлов и сплавов при нормальных условиях
Данная таблица коррозионной стойкости предназначена для составления общего представления о том, как различные металлы и сплавы реагируют с определенными средами.
Рекомендации не являются абсолютными, поскольку концентрация среды, ее температура, давление и другие параметры могут влиять на применимость конкретного металла и сплава.
На выбор металла или сплава также могут оказывать влияние экономические соображения.
Условные обозначения:
А - обычно не корродирует,
В - коррозия от минимальной до незначительной,
С - не подходит
Коррозия металлов в кислотах
Коррозия металла в кислотах – это его разрушение при взаимодействии с концентрированными или разведенными кислотами. Часто такие разрушения встречаются на химических производствах и других сферах деятельности человека. Слабые кислотные растворы могут создавать даже некоторые продукты питания, и непокрытый металл, соприкасающийся с ними, будет коррозировать. То, как себя поведет металлический предмет при контакте с кислотой, зависит от его способности пассивироваться. Процесс коррозии металлов в кислотах проходит с выделением водорода.
Рассмотрим более подробно случаи коррозии металла в кислотах разного происхождения.
Коррозия металлов в соляной кислоте
Соляная кислота является очень агрессивной по отношению к металлам. В большей степени это обуславливается содержанием в ней ионов Cl - . Даже коррозионно-стойкие стали подвергаются разрушению, когда концентрация кислоты выше среднего. Если же раствор достаточно сильно разбавлен, такие стали коррозии не подвергаются.
Коррозия никеля в серной кислоте не протекает даже в случаях, когда достигается температура кипения. В присутствии трехвалентного железа, хлоридов, других окислителей никель и его сплавы начинают разрушаться.
Низколегированная аустенитная сталь при комнатной температуре и концентрации соляной кислоты в 0,2 – 1% подвергается коррозии со скоростью 24 г/(м 2 •сут).
Коррозия металлов в органических кислотах
Самой сильной среди органических кислот является уксусная. В яблочной, бензойной, пикриновой, олеиновой, винной, стеариновой кислотах даже при больших температурах (выше 100°С) коррозионно-стойкие стали отличаются высокой устойчивостью. При контакте металлов с муравьиной кислотой образуются питтинги (особенно при увеличении температуры). Глубина их даже больше, чем в уксусной кислоте.
В органических кислотах высокой устойчивостью обладает алюминий, т.к. на его поверхности присутствует защитная пленка труднорастворимых окислов.
Щавелевая, себациновая, лимонная и молочная кислоты вызывают коррозию сталей только при больших концентрациях. В них устойчивы хромистые стали с добавками молибдена.
Коррозия металлов в азотной кислоте
Азотная кислота обладает агрессивным воздействием по отношению ко многим металлам. Малоуглеродистые стали не обладают достаточной устойчивостью в растворах азотной кислоты. Кроме того, при повышении концентрации HNO3 до 35 – 40% (при данных концентрациях сталь переходит в пассивное состояние) коррозия малоуглеродистых сталей в азотной кислоте увеличивается. При концентрации азотной кислоты близкой к 100% пассивное состояние нарушается. Азотная кислота является окислителем. При коррозии железа катодными деполяризаторами являются молекулы азотной кислоты и нитрат-ионы. Устойчивость в азотной кислоте хромистых сталей повышается, если в их состав вводить никель и молибден. Коррозионное разрушение сталей в азотной кислоте происходит по границам зерен. На алюминий слабое влияние оказывают пары азотной кислоты или растворы с концентрацией более 80%. При нормальной температуре алюминий обладает высокой коррозионной стойкостью в азотной кислоте. Скорость коррозии алюминия в азотной кислоте возрастает при постоянном перемешивании и присутствии в растворе хлорид-ионов.
Коррозия металлов в серной кислоте
При концентрации серной кислоты около 50 – 55% поверхность железа переходит в пассивное состояние. Далее с повышением температуры и концентрации серной кислоты поверхность железа становится активной (наблюдается коррозия железа в серной кислоте).
В растворах серной кислоты, как и в других кислотах, на скорость коррозии железа большое влияние оказывает природа анионов. Это связано с торможением катодного и анодного процессов и их адсорбцией на поверхности металла.
Я.М. Колотыркин развил представления, что на анодное растворение железа оказывают влияние анионы. Это связано с образование комплекса:
Из вышеперечисленных уравнений понятно, что скорость анодного процесса возрастает с увеличением концентрации ионов HSO4 - и SO4 2- . С поверхности железа сульфат ионы вытесняются хлорид ионами, но до определенной концентрации ионов хлора, скорость протекания анодного процесса замедляется.
В 95 – 98% серной кислоте при нормальной температуре хорошей устойчивостью обладают хромистые стали (с содержанием хрома около 17%) с небольшой добавкой молибдена или без него. В таких условиях (при большой концентрации серной кислоты) стоек также алюминий и углеродистые стали. Чистый алюминий (99,5%) более устойчив в серной кислоте, чем его сплавы, в состав которых не входит медь. Скорость коррозии алюминия в серной кислоте (и его сплавов) при повышении температуры с 20°С до 98°С увеличивается с 8 до 24 г/(м 2 •сут). Коррозионно-стойкие стали в 5-ти или 20-% растворе при температуре кипения серной кислоты устойчивы только в присутствии ингибиторов коррозии.
При обычной температуре в серной кислоте коррозия меди практически не наблюдается. А при повышении температуры до 100°С процесс разрушения интенсифицируется. В 25% растворе серной кислоты, повышенном давлении и температуре близкой к 200°С медь быстро разрушается.
Латунь не обладает коррозионной стойкостью в растворах серной кислоты любых концентраций даже при комнатной температуре. Устойчивость латуней к разрушению в серной кислоте можно только повысить введением в раствор 30% соли CuSO4•5H2O.
Коррозия металлов в фосфорной кислоте
Наибольшей стойкостью к коррозии в фосфорной кислоте отличаются молибденовые стали. Алюминий и его сплавы (в состав которых не входит медь, магний) устойчивы в фосфорной кислоте. При обычной температуре не поддаются также разрушениям хромоникелевые аустенитные стали (в растворах фосфорной кислоты любой концентрации). В концентрированной технической фосфорной кислоте при температуре не выше 50°С стойки малоуглеродистые стали. Если сталь с 17% хрома поместить в раствор фосфорной кислоты, концентрацией от 1 до 10%, то она будет обладать высокой устойчивостью даже при температуре кипения.
Медь практически не подвергается коррозии в фосфорной кислоте при температуре от 20 до 95°С. Но если в систему вводить окислитель и повышать температуру – скорость коррозии меди в фосфорной кислоте значительно увеличивается. Бронзы и латуни в фосфорной кислоте ведут себя аналогично.
Коррозия металлов во фтористоводородной кислоте
Чугун, малоуглеродистая сталь и железо во фтористоводородной кислоте быстро разрушаются. В 10-% фтористоводородной кислоте при нормальной температуре обладают хорошей устойчивостью хромистые стали (с содержанием хрома 17%). В 20-% кислоте при температуре до 50°С устойчивы аустенитные высоколегированные стали. Латуни не разрушаются в 40-60-% фтористоводородной кислоте при 20°С. Магниевые сплавы устойчивы при температурах до 65°С в 45-% растворе.
Устойчивость металлов к коррозии
Способность того или иного металла сопротивляться коррозии, называется коррозийной стойкостью. Эта способность определяется скоростью протекания коррозии в определенных условиях. Чтобы оценить скорость коррозии, используют количественные и качественные характеристики.

Качественные характеристики — это:
изменение внешнего вида поверхности металла;
изменение микроструктуры металла.
Количественные характеристики — это:
время до появления первого очага коррозии;
количество очагов коррозии, образовавшихся за некоторый промежуток времени;
утончение металла за единицу времени;
изменение массы металла на единицу площади поверхности за единицу времени;
объем поглощенного или выделившегося газа в процессе коррозии на единице поверхности за единицу времени;
плотность электрического тока для данной скорости коррозии;
изменение того или иного свойства за определенный промежуток времени (механические свойства, отражательная способность, электрическое сопротивление).
Для разных металлов характерна разная стойкость к коррозии. Чтобы устойчивость к коррозии повысить, используют специальные методы: легирование для стали, хромирование, алитирование, никелирование, окраска, цинкование, пассивация и т.д.

В присутствии кислорода и чистой воды, железо быстро корродирует, реакция идет по формуле:
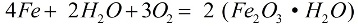
В процессе коррозии, рыхлый слой ржавчины покрывает металл, и этот слой отнюдь не защищает его от дальнейшего разрушения, коррозия идет до полного уничтожения металла. Более активную коррозию железа вызывают растворы солей: если в воздухе присутствует даже немного хлорида аммония (NH4Cl), коррозийный процесс пойдет значительно быстрее. В слабом растворе соляной кислоты (HСl) реакция тоже активно пойдет.
Азотная кислота (HNO3) в концентрации более 50% вызовет пассивацию металла, - он покроется хоть и хрупким, но все же защитным слоем. Дымящая азотная кислота безопасна для железа.
Серная кислота (H2SO4) в концентрации более 70% пассивирует железо, а если сталь марки Ст3 держать в 90% серной кислоте при температуре 40°С, то в данных условиях скорость ее коррозии не превысит 140 мкм в год. Если же температура составит 90°С, то коррозия пойдет с в 10 раз большей скоростью. Серная кислота концентрацией 50% железо растворит.
Ортофосфорная кислота (H3PO4) не вызовет коррозии железа, как и безводные органические растворители, как растворы щелочей, водный аммиак, сухие Вr2 и Сl2.
Если к воде добавить тысячную долю хромовокислого натрия, то он станет отличным ингибитором коррозии железа, как и натрия гексаметафосфат. А вот ионы хлора (Cl-) снимают с железа защитную пленку и усиливают коррозию. Железо технически чистое, в котором содержится примерно 0,16% примесей, отличается высокой устойчивости к коррозии.
Стали среднелегированные и низколегированные
Легирующие добавки хрома, никеля или меди в низколегированных и среднелегированных сталях повышают их устойчивость к водной и атмосферной коррозии. Чем больше хрома — тем выше устойчивость стали к окислению. Но если хрома меньше 12%, то химически активные среды подействуют на такую сталь разрушительно.
В высоколегированных сталях легирующих компонентов больше 10%. Если в стали содержится от 12 до 18% хрома, то такая сталь выдержит контакт почти с любой из органических кислот, с пищевыми продуктами, окажется стойкой к азотной кислоте (HNO3), к щелочам, ко многим растворам солей. В 25% муравьиной кислоте (CH2O2) коррозия высоколегированной стали пойдет со скоростью порядка 2 мм в год. Однако сильные восстановители, соляная кислота, хлориды и галогены разрушат высоколегированную сталь.
Стали нержавеющие, в которых содержится от 8 до 11% никеля и от 17 до 19% хрома более стойки к коррозии чем просто высокохромистые стали. Такие стали выдерживают кислые окислительные среды, как то хромовокислая или азотокислая, а также сильные щелочные.
Никель в качестве добавки усилит стойкость стали к неокислительным средам, к атмосферным факторам. Но среды кислые восстановительные и кислые с ионами галогенов, - разрушат пассивирующий оксидный слой, в результате сталь потеряет устойчивость к кислотам.
Более высокую коррозийную устойчивость, чем хромоникелевые стали, имеют стали нержавеющие с добавлением молибдена в количестве от 1 до 4%. Молибден даст стойкость к сернистой и серной кислотам, к органическим кислотам, к морской воде и галогенидам.
Ферросилиций (железо с добавлением от 13 до 17% кремния), так называемое железокремнистое литье, обладает коррозийной стойкостью благодаря наличию оксидной пленки SiO2, и которую не способны разрушить ни серная, ни азотная, ни хромовая кислоты, они лишь усиливают эту защитную пленку. А вот соляная кислота (HCl) легко приведет к коррозии ферросилиция.
Сплавы никеля и чистый никель

Никель стоек ко многим факторам, как к атмосферным, так и к лабораторным, к чистой и соленой воде, к щелочным и нейтральным солям, таким как карбонаты, ацетаты, хлориды, нитраты и сульфаты. Не насыщенные кислородом и не горячие органические кислоты не причинят вреда никелю, как и кипящая концентрированная щелочь гидроксид калия (KOH) в концентрации до 60%.
Коррозию вызовут восстановительные и окислительные среды, окислительные щелочные или кислые соли, окислительные кислоты, такие как азотная, влажные газообразные галогены, оксиды азота и диоксид серы.
Монель-металл (до 67 % никеля и до 38 % меди) более стоек к действию кислот, чем чистый никель, но действие сильных окисляющих кислот не выдержит. Отличается довольно высокой стойкостью к кислотам органическим, к значительному количеству растворов солей. Атмосферная и водная коррозия не грозят монель-металлу, безопасен для него также фтор. Монель-металл безопасно выдержит действие кипящего фтороводорода (HF) концентрацией 40%, как его выдерживает платина.
Сплавы алюминия и чистый алюминий

Защитная оксидная пленка алюминия делает его устойчивым к обычным окислителям, к уксусной кислоте, к фтору, просто к атмосфере, и к значительному количеству органических жидкостей. Технически чистый алюминий, в котором примесей меньше 0,5%, очень стоек к действию перекиси водорода (H2O2).
Разрушается под действием едких щелочей сильных восстановительных сред. Разбавленная серная кислота и олеум не страшны алюминию, но серная кислота средней концентрации его разрушит, как и горячая азотная кислота.
Защитную оксидную пленку алюминия способна разрушить соляная кислота. Контакт алюминия со ртутью или с солями ртути разрушителен для первого.
Чистый алюминий более устойчив к коррозии, чем например сплав дюралюминий (в котором до 5,5% меди, 0,5% магния и до 1% марганца), который менее стоек к коррозии. Силумин (добавка от 11 до 14% кремния) в этом отношении более устойчив.
Сплавы меди и чистая медь

Чистая медь и ее сплавы не корродируют ни в соленой воде, ни на воздухе. Не страшны меди в плане коррозии: разбавленные щелочи, сухой NH3, нейтральные соли, сухие газы и большинство органических растворителей.
Такие сплавы как бронза, в которых содержится много меди, выдерживают нахождение в кислотах, даже в холодной концентрированной или в горячей разбавленной серной кислоте, либо в концентрированной или разбавленной соляной кислоте при обычной температуре (25°С).
В отсутствие кислорода медь не корродирует при контакте с органическими кислотами. Не оказывают разрушительного действия на медь ни фтор, ни сухой фтороводород.
Но медные сплавы и чистая медь корродируют от различных кислот если есть кислород, а также при контакте с влажным NH3, некоторыми кислыми солями, влажными газами, типа ацетилена, CO2, Cl2, SO2. Медь легко взаимодействует со ртутью. Латунь (цинк и медь) не отличается высокой устойчивостью к коррозии.

Чистая вода, ровно как и чистый воздух, не приводит к коррозии цинка. Но если в воде или в воздухе присутствуют соли, углекислый газ или аммиак, то начнется коррозия цинка. Цинк растворяется в щелочах, особенно быстро — в азотной кислоте (HNO3), медленнее — в соляной и серной кислотах.
Органические растворители и нефтепродукты в принципе не оказывают корродирующего действия на цинк, но если контакт будет длительным, с крекинг-бензином, например, то кислотность бензина повысится при окислении его на воздухе, и начнется коррозия цинка.

Высокая устойчивость свинца к водной и атмосферной коррозии — известный факт. Не корродирует свинец и при нахождении в почве. Но если в воде содержится много углекислого газа, то свинец в ней растворится, поскольку образуется гидрокарбонат свинца, который уже будет растворим.
В целом свинец очень стоек к растворам нейтральным, умеренно стоек к щелочным, а также к некоторым кислотам: серной, фосфорной, хромовой и сернистой. Концентрированной серной кислотой (от 98%) при температуре в 25°С, свинец можно медленно растворить.
Фтороводород при концентрации 48% растворит свинец при нагревании. Сильно взаимодействует свинец с соляной и азотной кислотами, с муравьиной и уксусной кислотой. Серная кислота покроет свинец труднорастворимым слоем хлорида свинца (PbCl2), и дальше растворение уже не пойдет. В концентрированной азотной кислоте свинец также покроется слоем соли, но разбавленная азотная кислота растворит свинец. Хлориды, карбонаты и сульфаты к свинцу не агрессивны, а растворы нитратов — наоборот.

Хорошая коррозийная устойчивость — отличительная черта титана. Он не окисляется сильными окислителями, выдерживает растворы солей, FeCl3 и т.д. Концентрированные минеральные кислоты вызовут коррозию, однако даже кипящая азотная кислота в концентрации менее 65%, серная — до 5%, соляная — до 5% - коррозии титана не вызовут. Нормальная коррозийная устойчивость к щелочам, к щелочным солям и органическим кислотам выделяет титан в ряду других металлов.

Цирконий более устойчив к серной и соляной кислотам чем титан, однако к царской водке и влажному хлору — устойчив менее. Обладает высокой химической стойкостью к большинству щелочей и кислот, устойчив к перекиси водорода (H2O2).
Действие некоторых хлоридов, кипящая концентрированная соляная кислота, царская водка (смесь концентрированных азотной HNO3 (65—68 % масс.) и соляной HCl (32—35 % масс.), горячая концентрированная серная кислота и дымящая азотная — вызывают коррозию. Очень значимым в плане коррозии является такое свойство циркония, как гидрофобность, то есть этот металл не смачивается ни водой, ни водными растворами.

Превосходная химическая стойкость тантала подобна стеклу. Его плотная оксидная пленка защищает металл при температурах до 150°С от действия хлора, брома, йода. Большинство кислот в нормальных условиях не действуют на тантал, даже царская водка и концентрированная азотная кислота не вызывают коррозии. Растворы щелочей практически не действуют на тантал, но на него действуют фтороводород и концентрированные горячие растворы щелочей, чтобы растворить тантал, применяют расплавы щелочей.
Телеграмм канал для тех, кто каждый день хочет узнавать новое и интересное: Школа для электрика
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Химическая и коррозионная стойкость металлов
Стандартный электродный потенциал алюминия равен -1,66В, т.е. он является достаточно активным металлом. Однако, благодаря склонности к пассивированию, алюминий может быть стоек во многих средах.
- В нейтральных растворах солей, содержащих галогениды - фториды, хлориды, бромиды, йодиды;
- В серной кислоте средней концентрации;
- В кипящая уксусная кислота до 98%масс и выше 98,8%масс;
- В капельножидкой и парообразной ртути (коррозия алюминия в уксусной кислоте начинается при присутствии ртути 0,000004% масс;
- В щелочах (с водородной деполяризацией);
- В плавиковой кислоте;
- При контакте с медью, железом и их сплавами.
2. Химическая стойкость меди и ее сплавов.

Стандартный потенциал меди равен +0,52/0,337В для восстановления одновалентной и двухвалентной меди соответственно. Обычно при коррозии медь переходит в раствор именно в двухвалентной форме. Стандартный потенциал меди в растворе 3% хлорида натрия равен +0,05В, а в растворе 1Н соляной кислоты равен +0,15В. Поэтому медь при обычных условиях не вытесняет водород из растворов, т.е. не может корродировать с водородной деполяризацией. Способность к пассивированию у меди выражена слабо. Устойчивость к газовой коррозии меди повышается при легировании бериллием, магнием и алюминием.
Латунь — сплав меди и цинка. Введение в латунь алюминия, марганца, никеля повышает устойчивость сплава к атмосферной коррозии, кремния — к морской воде.
- В солевых растворах;
- В разбавленных неокислительных кислотах;
- В формалине.
- В растворах, где она может образовывать комплексы (цианиды, аммиак);
- В растворах окислителей — азотная кислота, перекись водорода;
- В присутствии растворенного кислорода (особенно при продувке его через раствор);
- В хромовой кислоте;
- В муравьиной кислоте;
- В сульфидах, полисульфидах, сернистом газе.
3. Химическая стойкость никеля и его сплавов.

Стандартный потенциал никеля равен -0,25В. Коррозия никеля в основном протекает с килородной деполяризацией.
- В неокисляющих разбавленных кислотах (соляная до 15%, серная кислота до 70%);
- В ряде органических кислот, спиртах;
- В любых щелочах при любых температурах.
- В присутствии хлорида железа (III), хлорида меди (II), хлорида ртути (II), нитрата серебра, NaClO;
- В окисляющих кислотах (например, азотная);
- В концентрированных неокисляющих кислотах.
4. Химическая стойкость олова и его сплава с висмутом.

Стандартный потенциал олова равен -0,136В. Чистое олово компактно при температуре выше +13о С (в форме белого олова). Ниже этой температуры, особенно при -48о С олово активно переходит в аллотропную модификацию "серое олово", имеющую порошкообразную структуру. Для исключения этого явления олово легируют, например небольшим количеством висмута (0,5-2%). Олово слабо пассивируется.
- В природных водах;
- В растворах нейтральных солей;
- В пищевых средах;
- В разбавленных растворах серной и соляной кислот;
- В органических кислотах.
5. Химическая стойкость свинца.
Стандартный потенциал свинца равен -0,126В. Коррозионная устойчивость свинца во многом определяется устойчивостью продуктов его коррозии.
- В серной кислоте и сульфатах;
- В фосфорной кислоте и фосфатах;
- В соляной кислоте до 10%;
- В жестких водах с сульфатом кальция;
- В кремниевой кислоте;
- В индустриальных атмосферах с сероводородом, сернистым газом и серной кислотой.
- В азотной кислоте;
- В уксусной кислоте;
- В щелочах;
- В серной кислоте выше 96% и олеуме;
- В горячей серной кислоте до 80%;
- В соляной кислоте свыше 10%;
- В подземных водах с органическими кислотами;
- В подземных водах насыщенных углекислотой.
6. Химическая стойкость цинка.

Стандартный потенциал цинка равен -0,76В. Цинк может корродировать как с водородной, так и с кислородной деполяризацией. В чистом виде применяется редко, в основном в хроматированом или хромИтированом виде, а также в пассивированом виде с применением безхромовых пассиваторов.
- В пресной воде до 55°С;
- В чистой и морской сухих атмосферах.
- В кислых средах (при рН ниже 7);
- В щелочных средах (при рН выше 12);
- В индустриальных средах, содержащих SO2, SO3, HCl;
- В морской воде и влажной морской атмосфере.
7. Химическая стойкость кадмия.

Стандартный потенциал кадмия равен -0,4В. Кадмий обладает низкой способностью к пассивации. По коррозионному поведения аналогичен цинку, однако с понижением рН скорость коррозии снижается. Кадмий более устойчив в кислых и нейтральных средах, чем цинк. В щелочных средах кадмий вполне устойчив. Самое главное - кадмий, в отличие от цинка, устойчив в морской воде и это определяет его главное применение. Присутствие SO2 и SO3 кадмий быстро корродирует. Как и цинк, кадмиевые покрытия применяются в хроматированом виде.
8. Химическая стойкость титана.
Стандартный потенциал титана равен -1,63/-1,21В для двухвалентной и трехвалентной формы соответственно. Титан склонен к пассивации.
Читайте также:
