Коррозионно механическое разрушение металлов
Обновлено: 07.07.2024
Коррозионно-механические разрушения возникают при совместном воздействии на элементы оборудования коррозионно-активной среды и механической нагрузки.
Различают следующие виды коррозионно-механического разрушения элементов оборудования: коррозионное растрескивание, коррозионная усталость, коррозия при трении.
Коррозионное растрескивание возникает при действии статических напряжений в весьма агрессивной по отношению к данному металлу агрессивной среде. Причинами подобного разрушения являются пониженная коррозионная стойкость границ зерен в результате выделения из пересыщенного твердого раствора фазы с отрицательным потенциалом, наличие в сплаве структурной составляющей, неустойчивой по отношению к данной коррозионной среде; наводороживание границ зерен, сопровождающееся развитием значительных давлений, снижающих межкристаллитную прочность.
Это хрупкое разрушение происходит под действием лишь нормальных растягивающих напряжений, вызванных внешней нагрузкой, или остаточных напряжений растяжения. Коррозионное растрескивание не связано с общей коррозионной стойкостью металла, Например, углеродистые и малоуглеродистые стали практически не корродируют в щелочных средах но в то же время они подвержены коррозионному растрескиванию, называемому в этом случае щелочной хрупкостью. Коррозионное растрескивание происходит в щелочных и кислых средах и носит, в основном, межкристаллитный характер. Характерной чертой коррозионного растрескивания является то, что разрушение стали происходит без заметных пластических деформаций и может произойти внезапно.
Коррозионная усталость представляет собой процесс разрушения металлов и сплавов при одновременном действии коррозионной среды и циклических напряжений. Механизм усталостного разрушения металлов и сплавов в коррозионно-активных средах достаточно сложен и в значительной степени определяется режимом нагружения, величиной действующих напряжений, видом напряженного состояния, физико-химическими свойствами материала и контактирующей с ним среды.
Процесс коррозионно-усталостного разрушения металлов обычно протекает в три стадии. Первая характеризует период до возникновения трещины, в течение которого образуются специфические гальванические пары и возникают зародыши трещин. Вторая стадия характеризуется значительной потерей прочности из-за развития усталостных трещин. Третья стадия является чисто механическим разрушением оставшегося сечения изделия при напряжениях, превышающих предел прочности металла.
Характерной особенностью коррозионной усталости металлов является отсутствие предела выносливости в отличие от усталости на воздухе.
Механическое изнашивание, усиливаемое явлениями коррозии, называют коррозионно-механическим изнашиванием. Различают следующие виды коррозионно-механического изнашивания: окислительное, фреттинг-коррозия, изнашивание в средах, являющихся электролитами.
Окислительное изнашивание происходит при наличии на поверхностях трения окисных пленок, предотвращающих сближение контактирующих поверхностей до расстояния, на котором происходит их схватывание. По мере износа окисные пленки вновь восстанавливаются вследствие воздействия металла с кислородом воздуха.
Фреттинг-коррозия – процесс изнашивания, представляющий собой сочетание фреттинга с коррозией. Фреттингом называют особый вид изнашивания контактирующих поверхностей, совершающих под нагрузкой очень малые повторные относительные перемещения, например, продольные вибрации.
Изнашивание в средах, являющихся электролитами, представляет собой сочетание механического изнашивания с коррозией.
Коррозионно-механические разрушения элементов оборудования
КОРРОЗИЯ МЕТАЛЛОВ И ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Металлы вследствие своей высокой прочности, пластичности, износоустойчивости, тепло- и электропроводности являются наиболее важными конструкционными материалами.
В процессе эксплуатации в результате воздействия окружающей среды происходит их разрушение, так называемая коррозия.
Потери от коррозии в ведущих индустриальных странах составляют около 3-5% валового национального продукта, а затраты на возмещениекоррозионных потерь во всем мире исчисляются сотнями миллиардов долларов, поэтому раздел «Коррозия металлов и методы защиты их от коррозии» является одним из важнейших в курсе химии для инженерных специальностей.
Обычно корродируют металлы, которые встречаются в природе не в самородном состоянии, как Au, Pt, а в виде различных руд. На извлечение этих металлов из природных соединений расходуется значительное количество энергии (Ме +n + n? → Me 0 ; ΔG>0), которая накапливается в металлах, делая их термодинамически неустойчивыми, химически активными веществами (Ме 0 - n? → Me + n ; ΔG<0). В результате такого самопроизвольно протекающего коррозионного процесса металлы переходят в оксиды, гидроксиды, карбонаты, сульфиды и другие соединения и теряются безвозвратно.
Итак, коррозию можно определить как самопроизвольно протекающий окислительно-восстановительный процесс (ΔG<0) разрушения металла под воздействием окружающей среды, происходящий с выделением энергии (ΔН<0) и рассеиванием вещества (ΔS>0).
Механическое разрушение металлов, происходящее по физическим причинам, не называют коррозией, а называют эрозией, истиранием, износом.
По характеру разрушения поверхности коррозию подразделяют на сплошную и местную. Сплошная коррозия подразделяется на равномерную, если процесс окисления происходит по всей поверхности металла с одинаковой скоростью, и неравномерную – процесс окисления происходит по всей поверхности с различной скоростью на различных участках металла.
Местная коррозия подразделяется на коррозию пятнами, точечную, питтинг (углубленно-точечную), межкристаллитную (наиболее опасна, т.к. ослабляет связи между зернами структуры сплавов), растрескивающуюся, селективную (избирательную).
По механизму протекания различают следующие виды коррозии:
- электрохимическая (концентрационная, контактная, электрокоррозия);
- особые виды (биологическая, радиационная, ультразвуковая).
По характеру дополнительных воздействий различают:
- коррозию под влиянием механических напряжений;
- коррозию при трении;
- кавитационную коррозию (возникает при одновременном коррозионном и ударном воздействии агрессивной среды, когда лопаются пузырьки воздуха при работе лопастей гребного винта, роторов насосов).
Рассмотрим более подробно виды коррозии по механизму протекания.
Под химической коррозией понимают разрушение металлов окислением в окружающей среде без возникновения электрического тока в системе.
Газовая коррозия протекает при обычных условиях, но чаще при высоких температурах. Наблюдается при разливе расплавленных металлов, их термической обработке, ковке, прокатке, сварке и т.д.
Самый распространенный случай газовой коррозии – взаимодействие металла с кислородом:
Образующаяся при такой коррозии оксидная пленка в ряде случаев играет защитную функцию. Для этого она должна быть сплошной, беспористой, иметь хорошее сцепление с металлом, обладать твердостью, износостойкостью и иметь коэффициент термического расширения, близкий к этой величине для металла. Все эти качества оксидной пленки можно оценить по фактору Пиллинга-Бэдвордса (a). Металлы (щелочные, щелочноземельные), у которых a2O3, ZnO, NiO и т.д.).
При значениях a значительно больше единицы пленки получаются неслошные, лекго отделяющиеся от поверхности металла (железная окалина). Коррозионно-активными газами, кроме кислорода, являются: угарный газ, углекислый газ, сернистый ангидрид, азот, его оксиды и галогены. Например, при разливе расплавленного алюминия, происходит его взаимодействие не только с кислородом, но и с азотом воздуха.
Жидкостная коррозия протекает, как правило, в жидких неэлектролитах: спиртах, хлороформе, бензоле, бензине, керосине и других нефтепродуктах. Ускоряет процесс жидкостной коррозии сера,кислород, галогены, влага, атакже повышенная температура (коррозия поршней в двигателях внутреннего сгорания),что можно описать уравнениями : Me(II) + R1 – S – R2 → MeS + R1 – R2
Me(I) + nR – Cl → MeCl + 1/2nR – R ,
где R1 – S – R2и nR – Cl углеводороды, содержащие серу и хлор.
Электрохимическая коррозия наиболее распространенный вид коррозии. Это разрушение деталей, машин, конструкций в грунтовых, речных, морских водах, под влиянием воды (росы), под воздействием смазочно-охлаждающих жидкостей, используемых при механической обработке металлов, атмосферная коррозия и т.д.
Электрохимическая коррозия – это пространственно разделенный окислительно-восстановительный процесс разрушения металла, протекающий в среде электролита, с возникновением внутри системы электрического тока, называемого коррозионным током.
Рассмотрим химизм атмосферной коррозии стального изделия. Сталь – это сплав железа с углеродом, в котором углерода менее 2%, например, цементит (Fe3C4). При электрохимической коррозии во влажном воздухе (О2 + 2Н2О) железо и цементит образуют микрогальванопару, в которой роль анода выполняет железо, а цементит – роль катода.
Схема процесса:
Анодный процесс: Fe 0 - 2? → Fe 2+ 2 поляризация
Катодный процесс: 2H2O + O2 + 4? → 4OH - 1 деполяризация
Суммарное уравнение коррозионного процесса разрушения стального изделия, находящегося во влажном воздухе:
Для железа более характерна степень окисления (3+), поэтому процесс окисления идет дальше:
4Fe(OH)2+2H2O+O2→4Fe(OH)3, образующийся Fe(OH)3 при нагревании может терять воду.
То есть продуктами коррозии железа (ржавчина) является смесь различных соединений. Если учесть, что в воздухе присутствуют углекислый газ, сернистый газ, следовательно, могут образовываться и соли железа.
Часто из-за различной рельефности металлических конструкций, в том числе и стальных, на некоторых участках скапливается вода, при этом происходит так называемая концентрационная коррозия, обусловленная различной концентрацией деполяризатора кислорода (в случае атмосферной коррозии), водорода (в кислой среде) на различных участках металла. Там, где концентрация деполяризатора больше (края капли воды), формируется катодный участок, где концентрация деполяризатора меньше (центр капли воды) – анодный участок (рис.15).
После высыхания капли в её центре обнаруживается углубление, а иногда даже и отверстие (для пластин толщиной 0,1-0,2 мм). Такие процессы часто наблюдаются при атмосферной и почвенной коррозии железных и стальных изделий (троса, стопки листов и т.д.) – точечная коррозия, переходящая в питтинг. Следует отметить, что хотя конечный продукт коррозии (ржавчина) нерастворим, однако он не препятствует процессу растворения металла, поскольку формируется за пределами анодного участка (на границе соприкосновения его с катодами) в виде кольца внутри капли.
На практике часто встречаются случаи, когда металлы различной активности находятся в контакте друг с другом, образуя гальванопары. Кроме того, технические металлы содержат примеси других металлов, сплавы содержат различные металлы. Такой металл или сплав, находясь в среде электролита, дает множество микро - и макрогальванопар, в которых анодом является более активный металл, т.е. металл с меньшим значением электродного потенциала, именно он и подвергается коррозии.
Рассмотрим случай контактной коррозии с водородной деполяризациейцинка и меди, в сернокислой среде. Цинк и медь, имеют различные значения электродных потенциалов. Более активным в этой гальвано паре является цинк (Е 0 Zn2+/Zn = -0,76 В), он имеет меньшее значение электродного потенциала и будет анодом, т. е именно цинк будет подвергаться коррозионным процессам, менее активным металлом является медь (Е 0 Cu2+/Cu = +0,34 В), она будет катодом.
Запишем схему: (А) Zn | H2SO4 | Cu (K)
Анодный процесс: Zn 0 - 2? → Zn 2+
Катодный процесс: 2Н + + 2? → Н2 деполяризатор
Суммарное ионное уравнение: Zn + 2H + → Zn 2+ + H2
Факторы, влияющие на скорость коррозии:
а) напряжение и деформация при механической обработке металлов;
б) перемешивание агрессивной среды;
в) дифференциальная аэрация;
д) кислотность среды (рН).
Рассматривая фактор (д) обратите внимание, что электродные потенциалы металлов существенно зависят от состава электролита и рН среды. Так, в случае контактной (Al-Zn) коррозии в 1М растворе HCl
возникает гальвано пара, в которой роль анода выполняет Al, а катода- Zn, схема такого процесса: (А) Al | HCl | Zn (K)
В 0,1 М растворе HCl в этом случае большую активность имеет цинк, он будет в гальвано паре анодом, алюминий – катодом, а схему запишем так: (А) Zn | HCl | Al (K)
Электрокоррозия – протекает под действием блуждающих токов, возникает от постоянных источников тока (электротранспорт, трансформаторы, линии электропередач). Рассматривая коррозию под действием блуждающих токов, надо помнить, что место выхода тока – будет анодным участком, входа тока – катодным, участок протекания тока – нейтральной зоной. Радиус действия блуждающих токов может достигать нескольких десятков километров. Ток силой 1А за год разрушает до 3 кг алюминия, 9 кг железа, 11 кг цинка или меди, 34 кг свинца.
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Потери от коррозии в мировой экономике огромны. Около 1/3 вводимого в эксплуатацию металла подвергается коррозии, при этом примерно 10% теряется безвозвратно.
Борьба с коррозией осуществляется различными методами. Наиболее рациональный и надежный путь – изготовление аппаратов и машин изкоррозионно-стойких металлических или неметаллических материалов,но из-за дороговизны таких материалов, чаще используют дешевые и доступные металлы с последующей защитой их от коррозии. Полностью избежать коррозии невозможно, но, применив определенные методы защиты, можно снизить ее воздействие.
Можно условно выделить следующие группы методов защиты металлов от коррозии:
1. Создание рациональных конструкций, т.е. таких, которые не имеют застойных зон и других мест скопления влаги, грязи и других коррозионно-агрессивных сред, допускают быструю очистку и аэрацию.
2. Легирование металлов. Это эффективный, хотя обычно дорогой метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты (Cr, Ni, W, Si, V, Mo, Re и другие), вызывающие пассивирование металла. Механизм защиты (например, в нержавеющих сталях) состоит в образовании на поверхности плотных оксидных слоев, типа шпинелей состава NiO . Cr2O, FeO . Cr2O3, которые оказываются более устойчивыми, чем просто оксиды хрома или никеля.
3. Создание аморфных структур металлов. Путь к этому способу защиты открыла сверхбыстрая закалка. Расплавленный металл из тигля подают в тончайший зазор между двумя массивными валками и подвергают формированию и резкому охлаждению. В этих условиях атомы не успевают выстраиваться в присущие металлам кристаллические решетки, фиксируется «хаос атомов», свойственный расплавленному металлу. В результате получается аморфная структура, подобная стеклу, резко возрастает коррозионная устойчивость металлов.
4. Защитные покрытия – самый распространенный метод защиты металлов от коррозии. Смысл их нанесения – изоляция от агрессивной среды. Различают неметаллические и металлические покрытия.
а) неметаллические покрытия получают нанесением на поверхность металла лака, краски, смолы, олифы, эмали или стеклоэмали. Поверхность металла покрывают также резиной, эбонитом, полимерными материалами, цементом, бетоном, оксидными пленками: ZnO, Al2O3 (оксидирование) и нитридными пленками: Fe4N, Fe2N (азотирование). Покрыть поверхность металла можно осаждением нерастворимых фосфатов этого металла: Fe(H2PO4)2 + 2 Fe 2+ ® Fe3(PO4)2¯ + 4H ( фосфатирование) или насыщением поверхности металла углеродом (цементация).
б) защитные покрытия металлами. Для этого используют коррозионно-устойчивые металлы (Sn, Zn, Al, Au, Ag, Ni, Cr и др.) Различают анодные и катодные металлические покрытия. Если защищаемый металл покрывают более активным металлом, то такое покрытие называют анодным. При нарушении покрытия разрушается металл покрытия. Рассмотрим это на примере оцинкованного железа. Составим схему коррозионного разрушения.
A: Zn 0 - 2? → Zn 2+ 2
Если защищаемый металл покрыт менее активным металлом, например, железо покрыто оловом, то такой вид покрытия называется катодным. При нарушении покрытия разрушается основной металл. Рассмотрим этот случай коррозии.
(А) Fe | 2H + | Sn (K)
A: Fe 0 - 2? → Fe 2+ 1
Fe + 2H + → Fe 2+ + H2
5. Электрохимические методы защиты:
а) защита внешним потенциалом);
б) анодная (протекторная).
Защита внешним потенциалом (чаще катодная) осуществляется подключением защищаемой конструкции к отрицательному полюсу (катоду) внешнего источника тока с очень малым напряжением (0,1 В). К положительному полюсу подсоединяется лом, который и разрушается. Этот вид защиты используют для металлических сооружений: трубопроводов, резервуаров и т.д.
Протекторная защита заключается в том, что к изделию, подвергающемуся электрохимической коррозии, подключают деталь – протектор из более активного металла, чем металл изделия. Протектор будет разрушаться, а изделие останется неизменным. Применяют в паровых котлах, для защиты корпусов морских и речных судов, трубопроводов, рельсов и т.д.
Задача. Приведите пример протекторной защиты в электролите, содержащем растворенный кислород. Составьте уравнения анодного и катодного процессов и вычислите ЭДС реакции.
Решение. Протекторная защита осуществляется путем присоединения к железу более активного металла, обычно цинка, магния и их сплавов. Таким образом, создается искусственный микрогальванический элемент. Чаще всего используют протекторную защиту в растворах электролитов (паровые котлы, химические аппараты), в морской воде и в почве (защита трубопроводов). Рассмотрим протекторную защиту от почвенной коррозии:
Среда нейтральная или слабощелочная, так как концентрация солей невелика. В этом, созданном нами, коррозионном элементе анодом служит протектор (цинк), он растворяется.
Анод: Zn 0 – 2 ® Zn 2+ .
Электроны передаются на железо. Деполяризатором в этом случае является кислород.
Катод: O2 + 2H2O + 4® 4OH - ; E 0 = 0,40 B.
ЭДС реакции определяем: DЕ = Екатода – Еанода = 0,40 – (-0,75) = 1,16 В.
Ответ: протектор Zn, он окисляется и защищает железо; DЕ = 1,16 В.
6. Воздействие на агрессивную среду. Для замедления коррозии в агрессивную среду вводят вещества, называемые ингибиторами (замедлителями). Это чаще всего органические вещества, пассивирующие поверхность металла: тиомочевина C(NH2)2S, диэтиламин C2H5 — NH — C2H5, уротропин (CH2)6N4, неорганические вещества SiO3 2- , NO2 - , Cr2O7 2- , а также освобождение воды от растворенного в ней кислорода (воду фильтруют через слой железных опилок). Либо удаляют активаторы коррозии, например, ионы Cl - , Br - , F - , SO4 2- , NO3 - .
Литература:
1. Фролов В.В. Химия. Гл.V, §51-56.
3. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.
4. Абраменко В.Л. Методические указания к самостоятельному изучению темы “Коррозия и защита металлов от нее”. Луганск, 1991 г.
Виды коррозии и методы их оценки
Коррозионно-механическое изнашивание — сложный комплекс физико-химических процессов, поэтому рассмотрим коррозию металлов как самостоятельную группу процессов.
Коррозия металлов — самопроизвольное разрушение металлических материалов вследствие химического или электрохимического взаимодействия их с окружающей средой.
Первопричиной коррозии является термодинамическая неустойчивость металлов в различных средах при данных внешних воздействиях. Разнообразие условий, сред, свойств и структуры материалов является причиной разнообразия видов коррозии.
По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозии. Химическая коррозия подчиняется основным законам чисто химической кинетики гетерогенных реакций, не сопровождающихся возникновением электрического тока, в отличие от электрохимической коррозии, подчиняющейся законам электрохимической кинетики с протеканием электрического тока.
По типу агрессивных сред, в которых протекает процесс разрушения материалов, коррозия может быть следующих видов:
§ газовая (в газах при высоких температурах);
§ атмосферная (в атмосфере воздуха или влажных газах);
§ коррозия в электролитах (электрохимическая коррозия в электропроводных жидких средах, расплавах, растворах щелочей, солей, кислотах);
§ коррозия в неэлектролитах (химическая коррозия металлов в неэлектропроводящих жидких средах);
§ подземная коррозия (в почвах, грунтах);
§ биокоррозия (под воздействием продуктов жизнедеятельности микроорганизмов);
§ коррозия блуждающим током (под воздействием блуждающих токов, например, электрокоррозия металла трубопровода, кабеля).
По условиям протекания коррозионного процесса различают следующие виды коррозии:
§ контактная коррозия (при контакте металлов, имеющих различные потенциалы в данном электролите);
§ щелевая коррозия (коррозия в щелях, зазорах металла с другими материалами);
§ коррозия при неполном погружении металла в жидкую коррозионную среду;
§ коррозия при полном погружении металла в жидкую коррозионную среду;
§ коррозия при переменном погружении металла целиком или частично в жидкую коррозионную среду;
§ коррозия при трении;
§ фреттинг-корозия;
§ коррозионная кавитация;
§ коррозия под напряжением (при воздействии коррозионной среды и постоянной или переменной нагрузке).
По характеру разрушения коррозию разделяют на:
§ сплошную, охватывающую всю поверхность;
§ местную (локальную), охватывающую отдельные участки поверхности.
Сплошная коррозия может быть:
§ равномерной (металл разрушается на примерно одинаковую глубину по всей поверхности);
§ неравномерной (металл разрушается на отдельных участках на различную глубину);
§ избирательной (разрушается преимущественно структурная составляющая металла или один компонент сплава).
Местная коррозия может быть следующих видов:
§ пятнами (в виде отдельных пятен);
§ язвенная (в виде отдельных глубоких раковин);
§ точечная или питтинг (в виде отдельных точечных поражений, имеющих значительную глубину);
§ сквозная (разрушение металла насквозь);
§ межкристаллитная (преимущественно по границам зерен);
§ ножевая (локализованная в зоне сплавления сварных соединений).
Для компрессоров характерны следующие виды коррозии [7, 24]:
коррозионное растрескивание — коррозия металла при одновременном воздействии коррозионной среды и внешних или внутренних механических напряжений растяжения с образованием транскристаллитных или межкристаллитных трещин (см. рис. 1.1, а);
точечная коррозия (питтинг) (англ. pit [pit]…делать ямки, оставлять следы) — местная коррозия металла в виде отдельных точечных поражений (см. рис. 1.1, б); при точечной коррозии происходит прогрессирующее проникновение коррозионной среды вглубь металла с образованием изъязвлений; возникает при разрушении защитной пленки или слоев продуктов коррозии;
межкристаллитная коррозия — коррозия, распространяющаяся по границам кристаллов (зерен) металла или сплава (см. рис. 1.1, в);
фреттинг-коррозия (англ. fret [fret]…разъедать, подтачивать) — коррозия, протекающая при колебательном перемещении двух поверхностей одна относительно другой в условиях взаимодействия с коррозионной средой;
газовая коррозия — химическая коррозия металла в газах при высоких температурах;
ножевая коррозия — локализованный вид коррозии металла в зоне сплавления сварных соединений в агрессивных средах;
контактная коррозия — электрохимическая коррозия, вызванная контактом металлов с разными стационарными потенциалами.
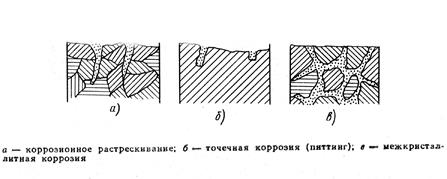
Рисунок 1.1 – Виды коррозионных разрушений
При одновременном воздействии циклических растягивающих напряжений и коррозионной среды понижается предел выносливости металла (коррозионная усталость).
По усредненным статистическим данным [24], доминирующими причинами коррозионных повреждений являются:
· коррозионное растрескивание — 20%;
· точечная коррозия — 16%;
· межкристаллитная коррозия — 10%;
· другие виды коррозии - 54%.
Требования к защите промышленного оборудования от коррозии установлены Единой системой стандартов защиты от коррозии и старения материалов (ЕСЗКС), а также отраслевыми стандартами и многочисленными методическими рекомендациями по отдельным видам оборудования.
Коррозионная стойкость характеризуется скоростью коррозии, т. е. количеством металла, растворяющегося с единицы поверхности в единицу времени, или скоростью проникновения коррозии, т. е. глубиной коррозионного разрушения металла в единицу времени.
Массовый показатель коррозии определяется по потере массы образца металла ∆m, отнесенной к площади образца S и времени τ:
Стандарт устанавливает десятибалльную шкалу коррозионной стойкости металлов при условии равномерной коррозии – табл.1.0
| Группа стойкости | Скорость коррозии | Балл |
| 1.Совершенно стойкие | Менее 0,001 | 1 |
| 2.Весьма стойкие | Свыше 0,001 до 0,005 Свыше 0,005 до 0,01 | 2 3 |
| 3.Стойкие | Свыше 0,01 до 0,05 Свыше 0,05 до 0,1 | 4 5 |
| 4.Пониженностойкие | Свыше 0,1 до 0,5 Свыше 0,5 до 1,0 | 6 7 |
| 5.Малостойкие | Свыше 1,0 до 5,0 Свыше 5,0 до 10,0 | 8 9 |
| 5.Малостойкие | Свыше 10,0 | 10 |
Расчет скорости проникновения коррозии производится по формуле:
где Km – потеря массы, г/м 2 год; ρ – плотность материала, г/см 3 .
По характеру исследований методы испытаний на коррозионную стойкость подразделяются на лабораторные, внелабораторные, эксплуатационные. Ввиду разнообразия коррозии методы испытаний не стандартизированы, однако частично регламентированы ведомственными техническими условиями. Общие требования к проведению коррозионных испытаний, требований к образцам материалов (типу, форме, качеству, изготовлению, подготовке), требования к аппаратуре и реактивам, к методам проведения испытаний, обработке результатов испытаний устанавливает ГОСТ 9.905-90.
Для оценки влияния климатических факторов стендовые испытания проводят в специальных камерах (климатических камерах, барокамерах), имитирующих внешнее давление, солнечную радиацию, температурные условия, влажность, воздействие специальных штаммов бактерий и другие факторы.
Исследования на атмосферную коррозию проводят на полигонах, расположенных в соответственных климатических зонах. Исследования коррозии в морской воде проводят на специальных морских станциях или судах. При исследовании коррозионных процессов широко используют метод образцов-свидетелей, устанавливаемых в работающем аппарате, трубопроводе, машине.
Скорость процессов разрушения материалов существенно (иногда на несколько порядков!) увеличивается под совместным воздействием механических и коррозионных факторов. В связи с этим ГОСТ 9.903-81 устанавливает методы ускоренных испытаний на коррозионное растрескивание высокопрочных сталей и титановых сплавов. Стандарт устанавливает различные методы испытаний: при постоянной нагрузке, при ступенчато меняющейся нагрузке, при постоянном деформировании. Критерием оценки стойкости материала к коррозионному растрескиванию является пороговый коэффициент интенсивности накопления напряжений, характеризующий сопротивление материала росту трещины при коррозионном растрескивании (в заданных условиях), ниже которого трещены отсутствуют или скорость роста не превышает 0, 0001 мм/час.
· условной прочности при растяжении и относительному удлинению при разрыве;
· прочности связи герметика с металлом при отслаивании;
· скорости отслаивания герметика от металла при постоянной отслаивающей нагрузке.
Испытание резин на стойкость к воздействию агрессивных сред при постоянном растягивающем напряжении проводят по ГОСТ 9.065-84 и оценивают по времени до разрыва образца и скорости ползучести.
Резины также испытывают:
ü на стойкость к старению при статической деформации сжатия (ГОСТ 9.029-81, 9.070-76);
ü на стойкость к термическому старению (ГОСТ 9.024-89);
ü на стойкость в ненапряженном состоянии к воздействию жидких агрессивных сред (ГОСТ 9.030-92);
ü на стойкость при вращательном движении в режиме трения (ГОСТ 9.061-89);
ü на стойкость к воздействию агрессивных сред при статической деформации сжатия (ГОСТ 9.070-89);
ü на стойкость к воздействию жидких агрессивных сред при многократных деформациях растяжения (ГОСТ 9.062-75).
В случае воздействия биологических факторов на элементы конструкции коррозию называют биологической (ГОСТ 9.102-91). Под биологическими факторами понимают организмы сообщества организмов, вызывающихнарушение исправного или работоспособного состояния объекта.
Способность объекта сохранять значение показателей в пределах, установленных нормативно-технической документацией в течение заданного времени в процессе или после воздействия биофактора, называется биостойкостью. Испытания на биостойкость подразделяют на лабораторные и в природных условиях.
Учитывая широкий спектр условий, в которых работают различные элементы холодильной установки, необходимо в каждом конкретном случае выявить наиболее вероятные доминирующие виды коррозии для определения наиболее эффективных мер защиты. Так, например, коррозия, на активность которой влияет наличие кислорода в воздухе (или растворенного в воде), высокая влажность и температура, является наиболее частой причиной утечки аммиака в холодильных системах. В условиях относительно сухого воздуха и низкой температуры (морозной зимы, например) трубопроводы и сосуды коррозируют незначительно. Однако в холодильных системах всегда имеются постоянные или периодически возникающие зоны, в которых оборудование и трубопроводы увлажняются. В выходные дни или в несезонный период при снижении нагрузки могут временно не работать отдельные блоки или элементы холодильной установки, в результате чего образуются влажные зоны на технологических трубопроводах, что способствует развитию их коррозии. В этих условиях могут развиваться точечная коррозия (питтинг), контактная коррозия и т. п. Наиболее часто проникновение влаги и взаимодействие ее с химическими компонентами теплоизоляционного или строительного материала вызывают коррозию труб в виде точечных отверстий в местах проходов трубопроводов через стены. Недопустимо вводить в эксплуатацию холодильную установку с незаконченной изоляцией трубопроводов, так как в процессе эксплуатации они покрываются инеем, и изоляция становится неэффективной. Принципиальное значение имеет антикоррозионное покрытие трубопроводов, правильное выполнение теплоизоляционных работ и использование для них качественных материалов. Несоблюдение этих условий может привести уже через год к появлению утечки хладагента. Разработаны эффективные меры защиты от коррозии любого вида [24].
Предельный износ, наступивший вследствие коррозионно-механического изнашивания, является одной из основных причин выхода из строя компрессорных машин (как правило, турбокомпрессоров), эксплуатируемых в черной металлургии, химической и нефтехимической промышленности. Его развитию способствуют наличие агрессивных сред, высокие температуры, интенсивный режим работы. В подобных условиях эксплуатируют компрессоры в металлургии при: подаче газовых сред в доменные печи; откачке продуктов сгорания от кислородных сталеплавильных конверторов и мартеновских печей; откачке от коксовых батарей продуктов коксования на коксохимических заводах и т. п.
Наиболее опасными видами коррозии для компрессоров, работающих в указанных условиях, являются межкристаллитная коррозия и коррозионное растрескивание, а также коррозионная усталость. Подобному изнашиванию в турбокомпрессорах подвергаются детали роторов, в частности лопатки, диски, валы [11].
Газовая коррозия деталей возникает при действии высоких температур: металл выгорает и выкрашивается, на поверхности появляются трещины. Газовая коррозия наблюдается у компрессоров, работающих с высокой скоростью, например центробежных, а также при неправильной эксплуатации (отсутствие смазывания, наличие загрязнений, перекос деталей и т. д.).
Коррозионно-механическое разрушение металлов (коррозионное растрескивание, коррозионная усталость, фреттинг-коррозия, кавитационная эрозия).
Коррозионное растрескивание, при этом характерно образование трещин, которые могут распространяться не только межкристально, но также и транскристально. Примером подобного разрушения является щелочная хрупкость котлов, сезонное растрескивание латуней, а также растрескивание некоторых конструкционных высокопрочных сплавов.
Коррозионная усталость, вызываемая воздействием коррозионной среды и знакопеременных или пульсирующих механических напряжений. Этот вид разрушения также характеризуется образованием меж- и транскристаллитных трещин. Разрушения металлов от коррозионной усталости встречаются при эксплуатации различных инженерных конструкций (валов гребных винтов, рессор автомобилей, канатов, штанг глубинных насосов, охлаждаемых валков прокатных станов и др.).
Фреттинг-коррозия – коррозионное разрушение на границе раздела двух тел, контактирующих друг с другом. Эти поверхности, находясь под воздействием коррозионной среды, двигаются (скользят) относительно друг друга. То есть фреттинг-коррозия – коррозия при трении. Чаще всего скольжение имеет колебательный характер, а объекты испытывают дополнительную достаточно большую нагрузку. Фреттинг-коррозия может наблюдаться при контакте двух металлических материалов, либо же металла и неметалла (резины, пластмассы, которые могут служить прокладочным материалом). Фреттинг-коррозии подвергаются: прижатые друг другу детали, на которые воздействуют колебательные, вращательные, вибрационные напряжения. К ним можно отнести болтовые, шпоночные, заклепочные, шлицевые соединения, контактирующие части подшипников, металлический канат, соприкасающиеся движущиеся валы и многое другое. Фреттинг – механический износ металла при движениях небольшой амплитуды. Совмещение механического износа и воздействия коррозионно активной среды и дает нам фреттинг-коррозию.
Кавитационная коррозия возникает в тех случаях, когда комбинация динамического перепада давления и статического давления вызывает появление растягивающих сил в жидкости, при этом образуются, а затем лопаются пузыри ( на металлической поверхности или вблизи от нее), что приводит к возникновению чередующихся растягивающих и сжимающих напряжений в металле. В теплообменниках эта чисто механическая форма повреждений возникает крайне редко, однако низкий эффективный перепад давлений, существующий в верхних трубах воздухоохладителей, приводит к образованию пузырей, разрушению защитной пленки на металлической поверхности и возникновению язвенной коррозии.
Методы защиты от коррозии.
Как бороться с коррозией? Чем может быть уменьшена или практически устранена коррозия? Нанесением защитных покрытий, например, лакокрасочных; введением в потенциально корродирующую среду ингибиторов, например хроматов, нитритов, арсенитов; применением коррозионностойких материалов.
Однако в каждом случае приходится решать каким из средств или в каком их сочетании можно получить наибольший экономический эффект. Современная наука о коррозии металлов и борьбе с ней достигла серьезных успехов, которые кратко описаны выше. В настоящее время в производство вводятся новые, непрерывно нарастающие объемы металлоизделий и соответственно растут ежегодные убытки, исчисляемые миллионами тонн прокорродировавшего металла и сотнями миллиардов рублей, затраченных на борьбу с коррозией. Перечисленные факты делают дальнейшие исследования в этой области науки крайне актуальными и важными
Современная защита металлов от коррозии базируется на следующих методах:
- повышение химического сопротивления конструкционных материалов,
- изоляция поверхности металла от агрессивной среды,
- понижение агрессивности производственной среды,
- снижение коррозии наложением внешнего тока (электрохимическая защита).
Эти методы можно разделить на две группы. Первые два метода обычно реализуются до начала производственной эксплуатации металлоизделия (выбор конструкционных материалов и их сочетаний еще на стадии проектирования и изготовления изделия, нанесение на него гальванических и иных защитных покрытий). Последние два метода, напротив, могут быть осуществлены только в ходе эксплуатации металлоизделия (пропускание тока для достижения защитного потенциала, введение в технологическую среду специальных добавок-ингибиторов) и не связаны с какой-либо предварительной обработкой до начала использования.
При применении первых двух методов не могут быть изменены состав сталей и природа защитных покрытий данного металлоизделия при непрерывной его работе в условиях меняющейся агрессивности среды. Вторая группа методов позволяет при необходимости создавать новые режимы защиты, обеспечивающие наименьшую коррозию изделия при изменении условий их эксплуатации. Например, на разных участках трубопровода в зависимости от агрессивности почвы можно поддерживать различные плотности катодного тока или для разных сортов нефти, прокачиваемой через трубы данного состава, использовать разные ингибиторы.
Создание новых режимов защиты имеет особо важное значение для защиты готовых изделий, подвергающихся коррозионному разрушению.
Широко распространенный метод гальванического (металлического) антикоррозионного покрытия при больших площадях и объемах обрабатываемых поверхностей становится экономически невыгодным, т.к. требует больших затрат на подготовку процесса. Поэтому различные лакокрасочные покрытия не случайно занимают важное место среди противокоррозионных покрытий. Широкое применение на практике этого способа защиты металлов объясняется удачным сочетанием необходимых для защиты от коррозии свойств (гидрофобности, водоотталкивания, низких газо- и паропроницаемости, препятствующих доступу воды и кислорода к поверхности металла), технологичности и возможности получения различных декоративных эффектов. Другое преимущество лакокрасочных покрытий - их ремонт осуществляется легче и с меньшими экономическими затратами.
Однако применение большинства широко распространенных материалов влечет за собой ряд недостатков: неполное смачивание поверхности металла; нарушение адгезии покрытия к металлу, что может привести к накоплению электролита под защитным покрытием и усилит коррозию. Причиной повышения влагопроницаемости является также наличие пор на поверхности создаваемого покрытия. Тем не менее, лакокрасочное покрытие продолжает защищать металл от коррозии даже при частичном повреждении пленки, в то время как гальванические покрытия могут ускорять коррозию железа.
С целью повышения долговечности строительных конструкций, зданий, сооружений проводятся работы в области улучшения противокоррозионной защиты.
Широко применяются следующие основные решения защиты металлических конструкций от коррозии:
- обработка коррозионной среды с целью снижения коррозионной активности. Примерами такой обработки могут служить: нейтрализация или обескислороживание коррозионных сред, а также применение различного рода ингибиторов коррозии;
- электрохимическая защита металлов;
- разработка и производство новых металлических конструкционных материалов повышенной коррозионной устойчивости путем устранения из металла или сплава примесей, ускоряющих коррозионный процесс (устранение железа из магниевых или алюминиевых сплавов, серы из железных сплавов и т.д.), или введения в сплав новых компонентов, сильно повышающих коррозионную устойчивость (например, хрома в железо, марганца в магниевые сплавы, никеля в железные сплавы, меди в никелевые сплавы и т.д.);
- переход в ряде конструкций от металлических к химически стойким материалам (пластические высокополимерные материалы, стекло, керамика и др.);
- рациональное конструирование и эксплуатация металлических сооружений и деталей (исключение неблагоприятных металлических контактов или их изоляция, устранение щелей и зазоров в конструкции, устранение зон застоя влаги, ударного действия струй и резких изменений скоростей потока в конструкции и др.).
Для гарантированной защиты от коррозии следует использовать материалы с максимальными показателями гидрофобности, водоотталкивания, низких газо- и паропроницаемости, препятствующих доступу воды и кислорода к поверхности металла. Такими материалами являются органосиликатные покрытия. Органосиликатные композиции имеют высокую химическую стойкость, светостойкость, обладают гидрофобными свойствами, имеют низкое водопоглощение. Кроме того, они имеют высокие показатели по адгезии (усилие на отрыв пленки превышает 2,5 Мпа) к бетону, металлу, керамике, атмосферостойкости, морозостойкости и срокам эксплуатации (безремонтный срок эксплуатации - 15 лет). Поэтому органосиликатные композиции незаменимы в качестве антикоррозионного покрытия для различных, прежде всего металлических, поверхностей.
Вопросам проектирования антикоррозионной защиты строительных конструкций уделяют серьезное внимание как у нас в стране, так и за рубежом. Западные фирмы при выборе проектных решений тщательно изучают характер агрессивных воздействий, условия эксплуатации конструкций, моральный срок службы зданий, сооружений и оборудования. При этом широко используются рекомендации фирм, производящих материалы для антикоррозионной защиты и располагающих лабораториями для исследования и обработки защитных систем из выпускаемых ими материалов.
В России накоплен определенный опыт проведения натурных обследований строительных конструкций промышленных зданий для определения скорости коррозионных процессов и методов защиты. Усилены работы в области повышения долговечности и улучшения противокоррозионной защиты строительных зданий и сооружений. Работы проводятся комплексно, включая натурные обследования, экспериментальные и производственные исследования и теоретические разработки. При натурных обследованиях выявляются условия работы конструкций, учитывающие особенности влияния на них нагрузок, температурно-влажностных и климатических воздействий, агрессивных сред.
Актуальность решения проблемы противокоррозионной защиты диктуется необходимостью сохранения природных ресурсов, защиты окружающей среды. Эта проблема находит широкое отражение в печати. Издаются научные труды, проспекты, каталоги, устраиваются международные выставки с целью обмена опытом между развитыми странами Мира.
Таким образом, необходимость исследования коррозионных процессов является одной из наиболее важных проблем.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
© cyberpedia.su 2017-2020 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!
Читайте также:
