Кристаллическая решетка металлов построена из атомов
Обновлено: 03.05.2024
Изучение металлов в соответствии с периодической системой элементов Менделеева показывает, что за исключением Mn и Hg элементы подгруппы А, в том числе переходные металлы и большинство редкоземельных элементов, а также металлы подгрупп IB и IIB и некоторые элементы группы IIIB, в том числе Al образуют одну из следующих типичных металлических структур:
А1 – кубическая гранецентрированная решетка (ГЦК)
Кубической гранецентрированной решеткой обладают следующие металлы: g - Fe, Al, Cu, Ni, a - Co, Pb, Ag, Au, Pt и др.
В кубической гранецентрированной решетке атомы располагаются по вершинам элементарной ячейки и в центрах ее граней (рис.1.5).
Каждый атом в этой решетке окружен 12-ю ближайшими соседями, располагающихся на одинаковых расстояниях, равных = 0,707×а, где а – ребро элементарной ячейки. Число ближайших соседей, равное 12-ти называется координационным числом кристаллической решетки. Кроме этих ближайших атомов, в кристаллической решетке имеется 6 атомов, удаленных на значительно большие расстояния, равные а.
Рассматриваемая кристаллическая решетка имеет два вида пустот, (междоузлий, в которых могут располагаться более мелкие атомы других элементов в сплавах) образующих твердые растворы внедрения.
Наибольшие междоузлия или пустоты находятся в центре куба и посередине его ребер. Каждая из этих пустот окружена шестью атомами ГЦК решетки, занимающими места в вершинах правильного октаэдра. В связи с этим, они называются октаэдрическими пустотами (рисунок 1.5, б). Такие положения различных элементов в гранецентрированной кубической решетке занимают атомы Na и Cl в решетке NaCl. Такие же положения занимает углерод в решетке g - Fe.
Кроме этих пустот в ГЦК решетке имеются более мелкие пустоты, называемые тетраэдрическими, в связи с тем, что их окружают 4 атома. Всего в ГЦК решетке 8 тетраэдрических пустот (рисунок 1.5, в).
Размеры тетраэдрических и октаэдрических пустот можно ощутить, если предположить, что решетка построена из жестких шаров, радиусом r, соприкасающихся друг с другом; в этом случае в имеющиеся промежутки можно было бы поместить сферы, радиусом 0,41 r и 0,225 r соответственно для октаэдрической и тетраэдрической пустот.
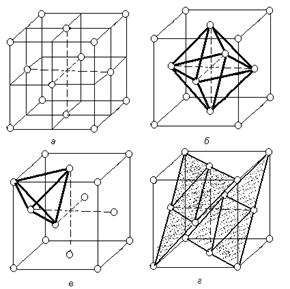 |
| Рисунок 1.5. Гранецентрированная кубическая решетка (а), размещение в ней октаэдрических (б) и октаэдрических (в) пустот; г - расположение плотноупакованных плоскостей (111) |
Наиболее плотноупакованными плоскостями в структуре гранецентрированного куба являются плоскости изображенные на рисунке. Их условное обозначение (рисунок 1.5., г).
Объемно-центрированную кубическую решетку А2 (ОЦК) имеют металлы a - Fe, хром, вольфрам, молибден, ванадий, натрий, литий и другие. Структура А2 является менее плотноупакованной.
Атомы в решетке ОЦК располагаются в вершинах и в центре элементарной ячейки (рисунок 1.6).
Каждый атом в этой ячейке имеет 8 ближайших соседей, располагающихся на расстоянии где, а – длина ребра куба. Следовательно, координационное число решетки равно 8. Иногда его обозначают (8 + 6), т.к. следующие по удаленности атомы расположено на расстоянии а, число их равно 6.
В структуре ОЦК также имеются 2 типа пустот. Крупные занимают положения на гранях куба (рисунок 1.6, в). Они окружены 4 атомами, располагающимися в вершинах тетраэдра, ребра которых попарно равны. Более мелкие пустоты, окруженные 6 атомами, занимающими места в вершинах неправильного октаэдра, располагаются посередине ребер и граней ячейки (рисунок 1.6, г). Если структуру ОЦК решетки построить из жестких шаров, то в тетраэдрические пустоты можно поместить сферы радиусом 0,292 r, а в октаэдрические - 0,154 r.
 |
| Рисунок 1.6. Объемноцентрированная кубическая решетка (а), размещение в ней наиболее плотной системы плоскостей (110) б; тетраэдрических (в) и октаэдрических (г) |
Таким образом, максимальный размер сферы, которую можно поместить в пустоты более плотно упакованной решетки ГЦК оказывается большим, чем в решетку ОЦК.
Внедрение других атомов в октаэдрическую пору ОЦК решетки вызывает смещение двух атомов в направлении параллельными ребру куба, что вызывает расширение решетки в этом направлении. В структуре мартенсита, где атомы углерода внедряются в октаэдрические пустоты, расположенные только на ребрах, параллельных оси С и в центрах граней, перпендикулярных этой оси, это приводит к тетрагональному искажению решетки a - Fe.
Наиболее плотноупакованными плоскостями ОЦК являются 12 плоскостей семейства (рисунок 1.6.б). В этих плоскостях имеются 2 направления, в которых жесткие шары могут соприкасаться.
Гексагональной плотноупакованной решеткой А3 (ГПУ) обладают такие металлы, как Zn, b - Co, Cd, Mg, a - Ti, a - Zr.
Гексагональная решета построена из отдельных слоев, причем таким образом, что каждый атом любого слоя окружен 6 расположенными на равных расстояиях соседями, принадлежащими этому же слою, и, кроме того, имеет по три ближайших соседа в слоях, расположенных выше и ниже данного слоя (рисунок 1.7).
 |
| Рисунок 1.7. Гексагональная плотноупакованная решетка (ГПУ): а - расположение атомов; б - выделенные типы пустот в решетке: октаэдрическая (вверху) и тетраэдрическая (внизу) |
Расстояние между атомами в гексагональных слоях обозначается через а, высота ячейки через с. Шесть ближайших соседей, расположенных в смежных слоях будут также находиться на расстоянии, а от данного атома, если отношение осей с/а составит, то такая структура называется идеальной плотноупакованной. Причем координационное число в этом случае, также как и в ГЦК решетке, равно 12.
Большинство металлов с гексагональной плотноупакованной решеткой имеет отношение осей с/а = 1,56 – 1,63. Исключения составляют Zn и Cd (1,86; 1,89). Это связано с тем, что электронные облака атомов Zn и Cd не обладают сферической симметрией и вытянуты вдоль оси С. В гексагональной плотноупакованной решетке, также как и в ГЦК, имеется 2 вида пустот: октаэдрические и тетраэдрические (рисунок 1.7, б).
Диаметры жестких сфер, которые могут быть помещены в эти пустоты также как и для ГЦК равны 0,41 r и 0,225 r.
Достаточно взглянуть на построение плотноупакованных плоскостей ГЦК решетки (рисунок 1.8, а), чтобы найти полную аналогию в построении атомов в этих двух решетках. Разница этих решеток состоит в чередовании слоев. Если в гексагональной решетке происходит чередование слоев АВАВ и т.д., то в ГЦК решетке: АВСАВС (рисунок 1.8, б), т.е. при этом используется третье возможное положение плотноупакованного слоя.
Разница в энергетическом отношении между этими двумя решетками незначительна и, в связи с этим, последовательность чередования слоев может легко нарушиться при пластической деформации, а также в результате возникновения дефектов кристалла во время его роста, так называемых дефектов упаковки.
Таким образом, кажущаяся разница в построении ГПУ и ГЦК решетки совсем не велика (рисунок 1.8).
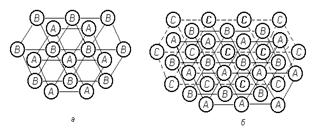 |
| Рисунок 1.8. Схема расположения плотноупакованных атомных слоев в решетках: а - ГПУ; б - ГЦК |
Углерод в виде алмаза, кремний, германий, a - олово (серое) имеют двойную кубическую решетку типа алмаза (рисунок 1.9). Она отличается от ГЦК решетки наличием в четырех из восьми тетраэдрических пустот дополнительно четырех атомов. В результате, структура оказывается более рыхлой.
Каждый атом алмаза окружен лишь четырьмя ближайшими соседями, располагающимися в углах правильного тетраэдра. Координационное число такой структуры равно 4.
Как было показано выше, одни и те же металлы при разных температурах могут иметь разное кристаллическое строение, что вызвано их аллотропией.
Аллотропическим (полиморфным) превращением называют изменение пространственной решетки кристаллического тела.
| Рисунок 1.9. Кристаллическая решетка алмаза |
В качестве примеров аллотропических превращений можно привести превращение низкотемпературной аллотропической формы a - Fe с объемно-центрированной кубической решеткой в высокотемпературную форму g - Fe с гранецентрированной кубической решеткой, при температуре 910 °С и последующее превращение при температуре 1392 °С g - Fe в d - Fe с объемно-центрированной кубической решеткой, аналогичной a - Fe. Аналогичные превращения можно наблюдать в титане, цирконии и т.д. В титане и цирконии низкотемпературной аллотропической формой являются a - Ti, a - Zr с гексагональной плотноупакованной решеткой. При температуре выше 882 °С для титана и 862 °С для циркония образуются b - Ti и b - Zr, обладающие объемно-центрированной решеткой.
Как вы видели, аллотропическое превращение заключается в том, что атомное строение кристаллического тела изменяется при нагреве и охлаждении. Сам процесс перестройки кристаллической решетки происходит изотермически при постоянной температуре, кривая охлаждения сплава претерпевающего аллотропические превращения, аналогична кривой, наблюдаемой при затвердевании жидкого металла. Температура перехода называется критической точкой превращения. При температуре (Т0) наблюдается фазовое равновесие двух аллотропических разновидностей.
Аналогично процессу кристаллизации аллотропическое превращение идет с поглощением тепла при нагреве и выделением его при охлаждении. Аллотропическое превращение (также по аналогии с процессом кристаллизации) происходит путем образования зародышей и их последующего роста, в связи с чем оно протекает всегда с наличием переохлаждения (при охлаждении) и перенагрева при нагреве.
Аллотропическое превращение происходит, так же как и процесс кристаллизации, в связи со стремлением системы к уменьшению свободной энергии.
Атомно-кристаллическое строение металлов
Все тела в зависимости от расположения атомов делятся на аморфные и кристаллические. В отличие от аморфных тел, атомы в которых расположены хаотично, металлы в твердом состоянии являются телами кристаллическими. Кристаллическое строение характеризуется закономерным расположением атомов.
Атомы металлов образуют кристаллическую решетку или ячейку. Каждый металл имеет определенный тип кристаллической решетки, чаще всего встречаются три типа решеток: кубическая объемноцентрированная – ОЦК (рис. 16, а), кубическая гранецентрированная – ГЦК (рис. 16, б) и гексагональная – ГПУ (рис. 16, в).
В кубической объемноцентрированной решетке атомы расположены в узлах ячейки и один атом в центре куба. Такие решетки имеют металлы: Feα, Сг, W, Mo, Tiβ, Nb, Та, Li n др.
В кубической гранецентрированной решетке атомы расположены в узлах ячейки и в центре каждой грани. Этот тип решетки имеют металлы: Feγ, Ni, Ag, Au, Pb, Сu, Соβ и др.
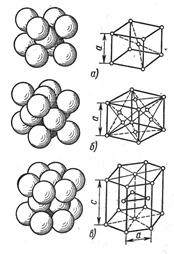
Рис. 16. Типы кристаллических решеток:
а – кубическая объемноцентрированная;
б – кубическая гранецентрированная;
В гексагональной решетке атомы расположены в узлах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Такую решетку имеют металлы: Zn, Cd, Be, Re, Coα, Tiα и др. Индексы α, β, γ обозначают, что у соответствующих металлов различные кристаллические решетки при различных температурах.
Типы кристаллических ячеек определяются при помощи рентгеноструктурного анализа.
Расстояния между центрами соседних атомов в кристаллической решетке называется периодом (а, b, с). Расстояния между атомами измеряются в ангстремах - , 1 = 1•10 -8 см.
Базис кристаллической решетки - это число атомов, принадлежащих одной элементарной кристаллической ячейке; для ОЦК базис равен 2, для ГЦК – 4, ГПУ – 6.
Плотность упаковки – это отношение объема занимаемого атомами к объему всей ячейки. Плотность упаковки для ОЦК составляет 68%, для ГЦК и ГПУ – 74%. Плотность упаковки характеризуется координационным числом, т. е. числом атомов, находящихся на равном и наименьшем расстоянии от данного атома. Координационное число для ОЦК – 8, для ГЦК и ГПУ – 12.
2.1. Полиморфизм металлов.
Полиморфизмом или аллотропией называют способность металла в твердом состоянии при изменении температуры перестраивать свою кристаллическую решетку. Полиморфные превращения сопровождаются выделением или поглощением теплоты, а также изменением свойств металла. Различные аллотропические состояния называют модификациями. Каждой модификации свойственно оставаться устойчивой лишь в пределах определенного для данного металла интервала температур. Аллотропические формы обозначаются греческими буквами α, β, γ и т. д. На кривых охлаждения и нагрева переход из одного состояния в другое характеризуется остановкой (для чистых металлов) или изменением характера кривой (для сплавов). При аллотропических превращениях кроме изменения свойств (теплопроводности, электропроводности, механических, магнитных и др.) наблюдают изменения объема металла и растворимости (например, углерода в железе). Аллотропические превращения свойственны многим металлам (железу, олову, титану и др.).
Железо известно в двух полиморфных модификациях — α и γ. На рис. 17 приведена кривая охлаждения, характеризующая его аллотропические превращения. Как видно, в интервале температур 911. 1392 °С железо имеет кубическую гранецентрированную решетку γ-железа (γFe), а в интервале от 0 до 911 °С и от 1392 до 1539 °С— объемноцентрированную решетку α-железа (αFe). Железо меняет свои магнитные свойства: выше 768 °С железо немагнитно, а ниже — магнитно.
Кристаллическая решетка

У каждого вещества есть набор физических свойств. Например, соли легко растворяются в воде и проводят электрический ток, а металлы имеют характерный блеск и ковкость. Такие характеристики зависят от строения вещества — от его кристаллической решетки. В этом материале мы расскажем о видах кристаллических решеток и о том, какие свойства придает веществу каждая из них.
· Обновлено 3 июня 2022
Ждём вас 8 октября в 13:00. Вместе с педагогами, психологами и другими экспертами в образовании и воспитании ответим на главные вопросы мам и пап.
Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
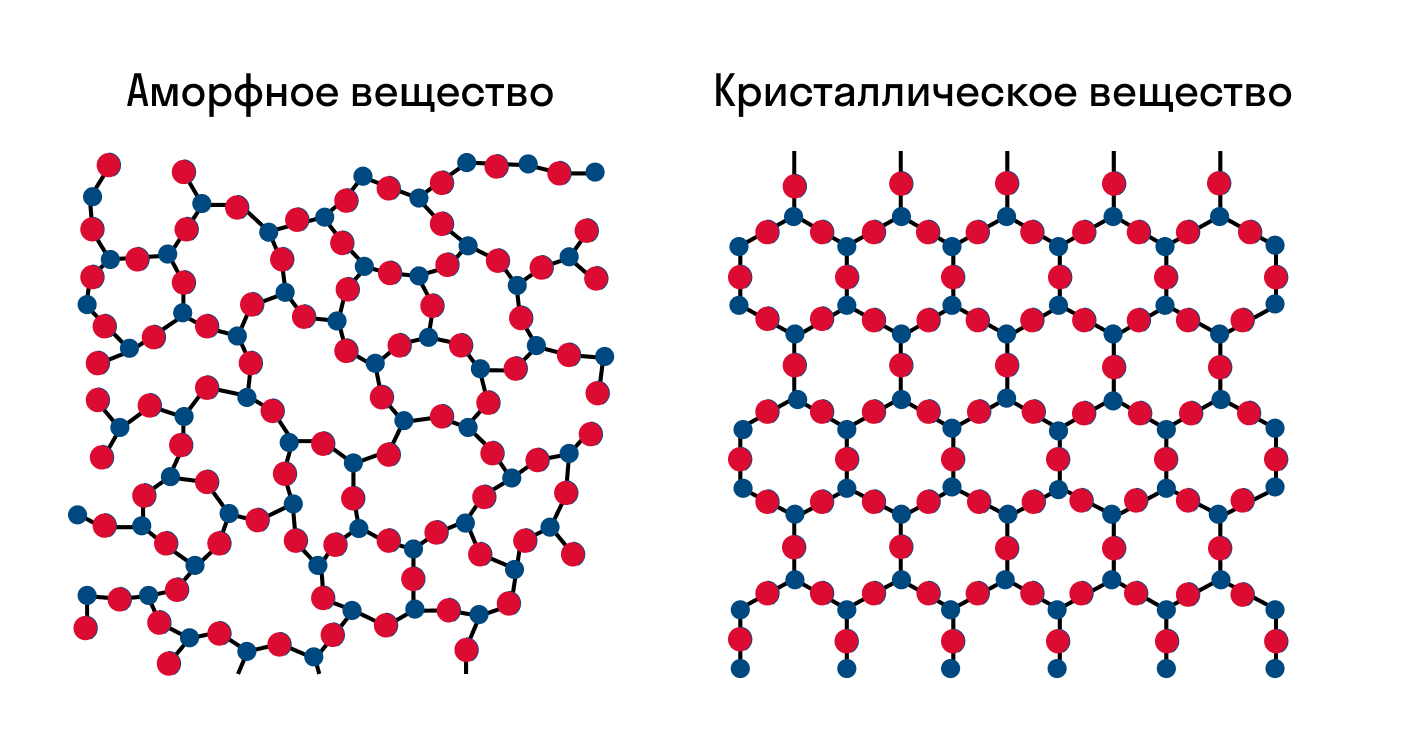
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков

Атомная кристаллическая решетка
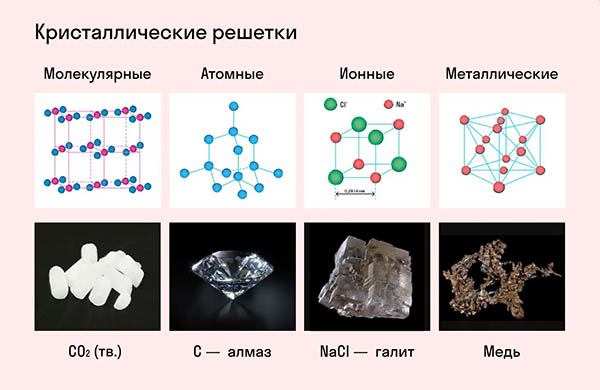
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
неспособность к растворению в воде,
высокая температура кипения и плавления.
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC.
Если нужно рассказать о свойствах веществ с атомной кристаллической решеткой, достаточно вспомнить песок и перечислить его характеристики.
Молекулярная кристаллическая решетка
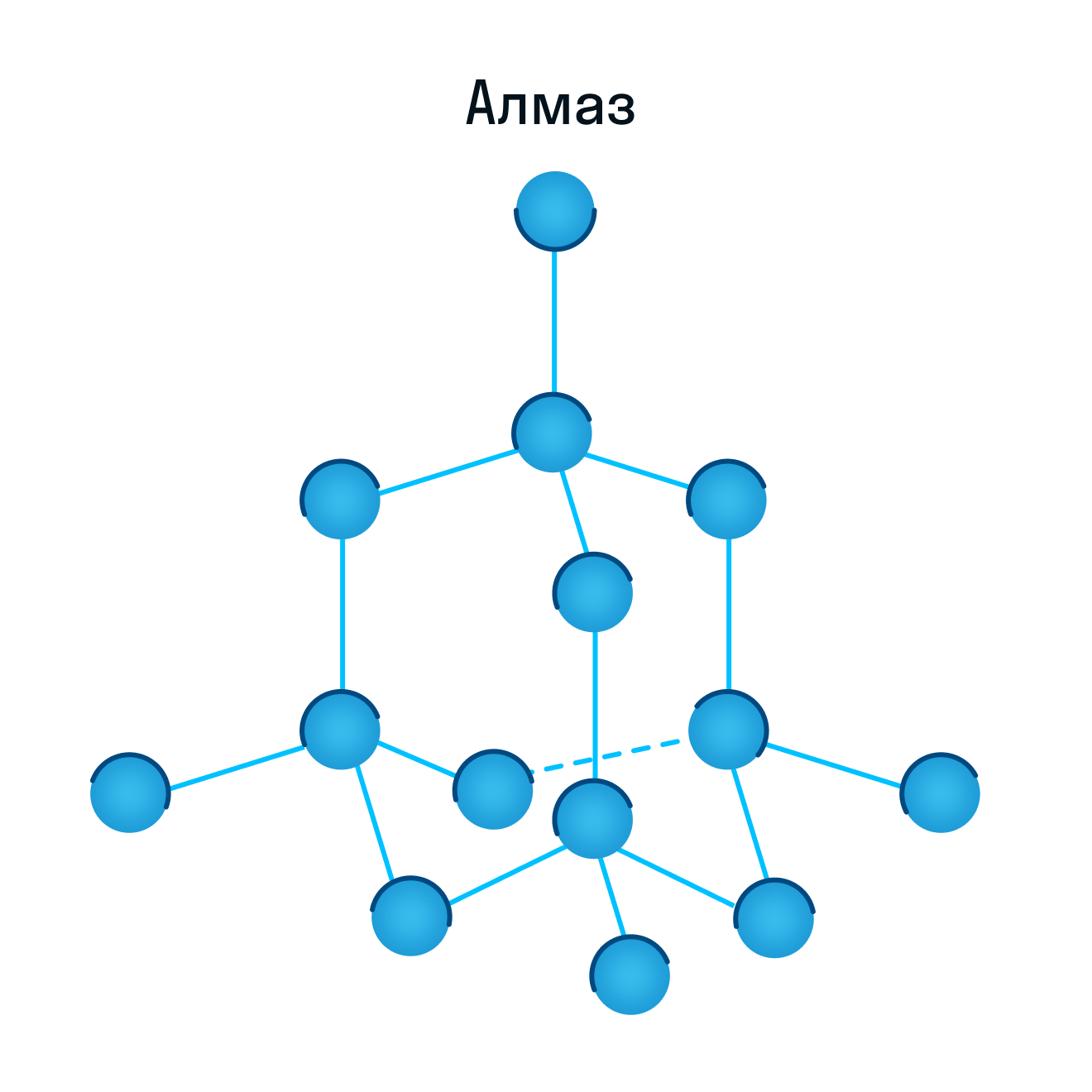
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
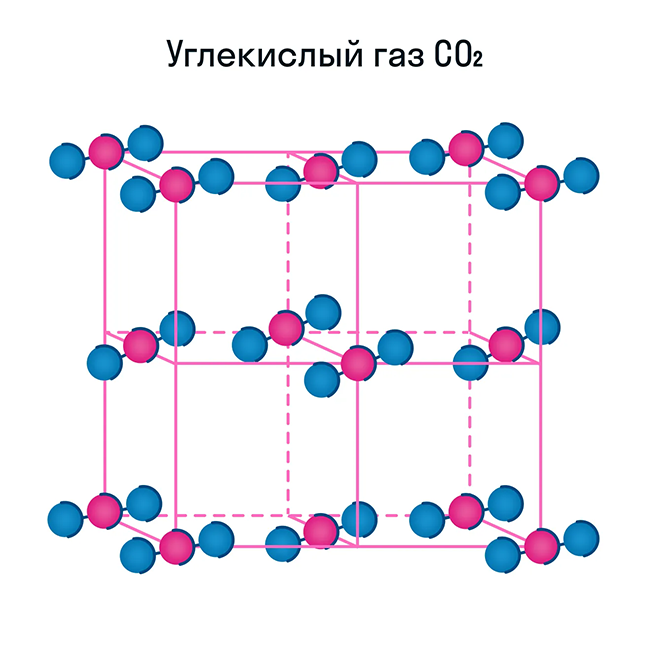
Свойства молекулярных веществ:
у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой.

Ионная кристаллическая решетка
Как известно, при ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
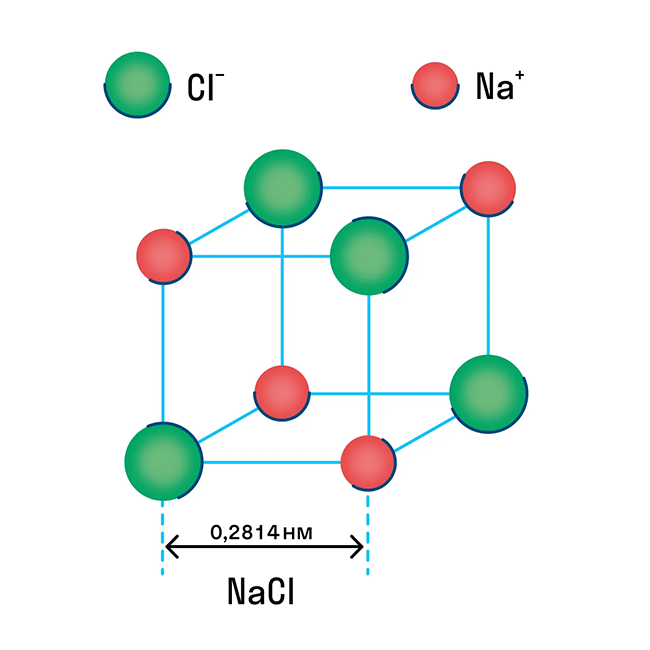
Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
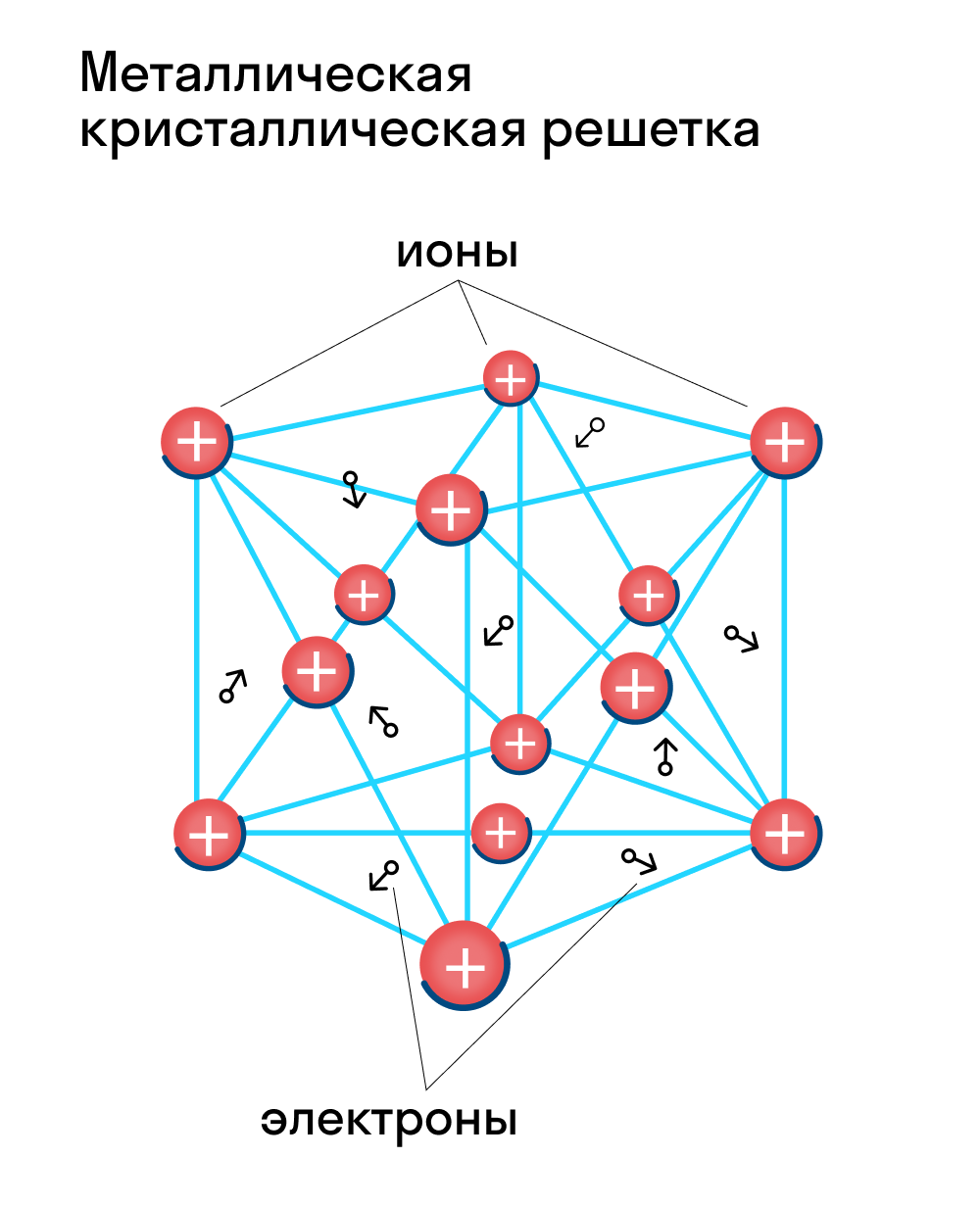
Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Кристаллическое строение металлов

Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны, предавая кристаллической решётке правильную геометрическую форму.
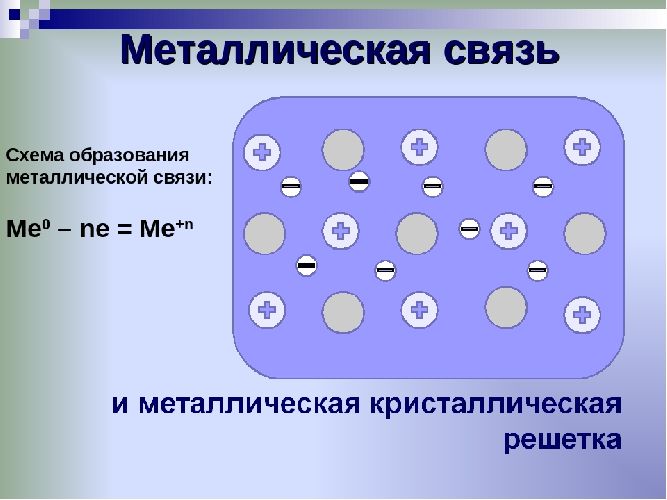
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
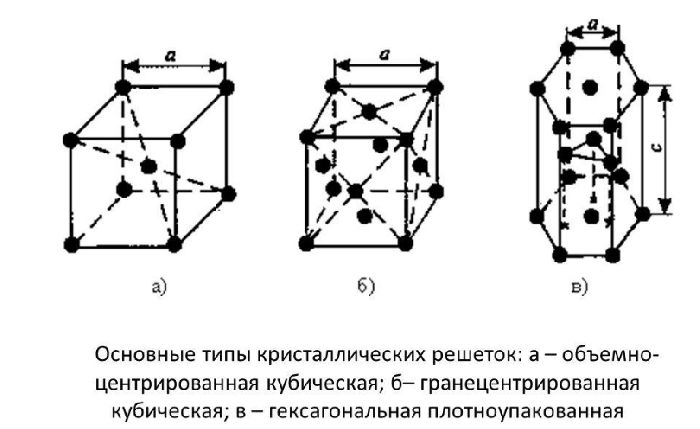
Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
Рис. 3. Кристаллические ячейки составляют решётку.
Что мы узнали?
Узнали кратко об атомно-кристаллическом строении металлов. Металлы – твёрдые кристаллические вещества. Единицей решётки является элементарная кристаллическая ячейка. Благодаря металлическим связям ионы в узлах ячеек удерживаются на одинаковом расстоянии. Различают три типа кристаллических решёток – ОЦК, ГЦК и ГПУ, отличающихся количеством атомов и геометрической формой.
Металлы — один из самых распространенных веществ в материальной культуре человека. Тысячелетиями медь, железо, серебро и золото были основным материалом для производства оружия, инструментов, ответственных частей транспорта и механизмов, деталей домашней утвари и украшений. В XIX веке, с освоением технологии получения чугуна, металлы пришли в строительство и станкостроение. XX век был веком металлов.

В нашу жизнь вошли алюминий, титан, бор и многие более редкие металлы. Используя их, человечество шагнуло в небо, космос и глубины океана. Металлы сделали возможным массовое производство домашней бытовой техники. В конце XX века пластмассы и композитные вещества ощутимо потеснили металлы с лидирующих позиций. Основные характеристики металлов — прочность, упругость и пластичность определяются их физико-химическими свойствами и атомным строением.
Основные группы металлов в промышленности
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.

Черные металлы покрывают до 90% мировой потребности в металлоизделиях.
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.

Легкие цветные металлы
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
Медь Олово Цинк Свинец
Чистый никель
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.
Золото и платина Серебро
На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.
Иттрий Сканидий Лантан
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.

Классификация металлов по химическому составу
Химические свойства чистых элементов определяются строением атомов реальных металлов и прежде всего их атомным числом, характеризующим их способность реагировать с водородом, кислородом и другими элементами. Химические характеристики реально применяемых металлов могут сильно отличаться от параметров чистого вещества как в лучшую, так и в худшую сторону.
Нежелательные добавки называют примесями, а те, что вносятся преднамеренно для изменения параметров в нужную сторону — легирующими присадками.
Общепризнанной является классификация, основанная на указании главного компонента сплава.
Атомно — кристаллическое строение металлов
Внутреннее строение металлов и их характеристики определяют их физико-химические свойства. Электроны на внешних орбитах атомов слабо связаны с ядром и имеют отрицательный заряд. При наличии разницы потенциалов электроны мигрируют к положительному полюсу, создавая электрический ток. Это физическое явление обуславливает электропроводность.
Кристаллическое строение свойственно металлам и их сплавам в твердом фазовом состоянии. Атомы выстраиваются в определенную объемную структуру, называемую кристаллической решеткой.
Число атомов в вершинах и на гранях этой структуры, а также дистанция между ними определяют такие физические свойства металла, как электро- и теплопроводность, вязкость, текучесть и т.д.
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция одинакова по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, и его физические параметры меняются в зависимости от направления.

Атомно-кристаллическое строение металлов
В реальном куске металлов, составленному из множества изолированных кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. В среднем свойства такого куска близки к изотропным.
При выстраивании кристаллической решетки некоторые атомы не попадают на свое место, смещаются или теряются. В этом случае говорят о дефектах кристаллического строения металлов. Дефекты структуры отрицательно влияют на свойства изделия, особенно если оно должно быть монокристаллом, как, например, в электронике, лазерной технике и других отраслях высоких технологий.
Физические свойства металлов
Физические свойства определяются внутренним строением металлов.
Главное отличие металлов от других элементов — это их электропроводность и магнитные свойства.

Физические свойства металлов
Добавление тех или иных присадок приводит к росту прочность получаемого вещества в десятки раз по отношению к исходному элементу.
Электронное строение металлов и их особенности
Внутреннее строение реальных металлов определяет их физико-химические параметры.
Кристаллическая решетка металлов
Все металлы в твердом фазовом состоянии имеют кристаллическое строение. Это пространственное образование из многократно повторяющихся первичных структур называют кристаллической решеткой.
схема кристаллической решетки.

Кристаллическое строение металлов
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция равна по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, его параметры зависят от направления.
В реальном куске металлов, который состоит из множества кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. Усредненные параметры такого куска близки к изотропным.
Типы кристаллических решеток
Дистанцию соседними атомами называют параметром решетки, у разных металлов он составляет 2 — 6 ангстрем. Существуют три основных типа кристаллических решеток:
- Кубическая: объемно-центрированная — включает в себя девять атомов. Свойственна железу, хрому, молибдену, и ванадию.
- Кубическая гранецентрированная: включает в себя уже 14 атомов. Присуща меди, золоту, свинцу, алюминию.
- Гексагональная: атомов уже 17 и размещены они наиболее плотно. Так кристаллизуются магний, цинк кадмий и другие.
Уникальная возможность железа заключается в том, что до 910°С оно имеет кубическую объемно-центрированную структуру, а при нагреве свыше этой температуры переходит к гранецентрированной.
Кристаллическое строение сплавов
Сплав это материал, состоящий из двух и более химических элементов. В его состав могут входить как металлы, так и неметаллы. Например, бронза — это сплав меди и олова, а чугун — сплав железа и углерода. Кроме основных, в состав могут входить и другие вещества, содержащиеся в небольших количествах. Если их добавляют специально и улучшают свойства материала, их называют легирующими присадками, если ухудшают — вредными примесями.
Кристаллическое строение сплавов сложнее, чем металлов.

Оно определяется взаимовлиянием компонентов при образовании кристалла, и принадлежит к трем подвидам:
- Твердые растворы. Один элемент растворяется в другом. Ведущий элемент строит кристаллическую структуру, а атомы второстепенного элемента размещаются в объеме этой решетки.
- Химическое соединение. Элементы химически реагируют друг с другом, образуя новое соединение. Из его молекул и составляется кристаллическая решетка.
- Механическая смесь. Элементы сплава не реагируют друг с другом. Каждый строит свои кристаллические структуры, срастающиеся в независимые кристаллы. Сплав будет представлять собой затвердевшую смесь из множества кристалликов двух разных типов. Такое вещество будет иметь собственную температуру перехода в жидкую фазу.
Физические свойства сплавов могут заметно меняться при изменении процентного соотношения составляющих.
Кристаллизация сплавов
Первичная кристаллизация — это затвердевание расплава с образованием кристаллических решеток. Пространственные атомные и молекулярные структуры, возникающие в ходе такого процесса, оказывают решающее влияние на свойства получаемого сплава.
Сначала в остывающем расплаве возникают центры кристаллизации, вокруг них в ходе процесса и нарастают кристаллы, многократно повторяя структуру центра. В качестве центров кристаллизации могут выступать:
- Первые образовавшиеся кристаллы в зонах локального охлаждения, чаще всего у стенок литейной формы.
- Частички неметаллических примесей.
- Тугоплавкие примеси, уже находящиеся в твердой форме.

Процесс кристаллизации металлов и сплавов
Кристаллы обычно растут в направлении роста градиента температуры. Если рост решеток не встречает физических препятствий, образуются ветвящиеся кристаллические структуры, напоминающие кораллы — дендриты. Если они растут из разных центров и встречаются в расплаве, то препятствуют росту друг друга и искажают свою форму. Такие искаженные кристаллы – это кристаллиты, или зерна. Совокупность отдельных зерен срастается в поликристаллическое тело.
Отдельные кристаллиты достигают размеров от одного до 10 000 микрон и по-разному развернуты в пространстве. На стыках отдельных кристаллитов образуется граничный слой, в котором кристаллические решетки разорваны. Такие слои обладают измененными химическими и физическими свойствами.
Решетки кристаллитов могут обладать разными дефектами структуры:
- точечные;
- линейные;
- поверхностные;

Дефекты кристаллического строения металлов
Дефекты определяются отсутствием атома или группы атомов в вершинах или гранях кристаллической решетки, смещением этих атомов со своих мест или замещением атома или их группы атомами или молекулами примесей.
Читайте также:
