Кусочек железа поместили в раствор нитрата неизвестного металла
Обновлено: 21.09.2024
А-1. Какие металлы и в какой последовательности будут вытесняться, если железную пластинку погрузить в раствор, содержащий одновременно NiSO4, CuSO4, K2SO4, Ag2SO4 и MgSO4 [1]?
А-2. Железная пластинка массой 18 г была погружена в раствор сульфата меди(II). Когда она покрылась медью, ее масса стала равной 20 г. Какая масса железа перешла в раствор?
А-3. Для извлечения серебра из раствора, содержащего его растворимые соли, раствор прокипятили с гранулированным цинком, после чего масса металла возросла на 7,5 г. Какое количество серебра по массе было извлечено из раствора [2, 3]*?
А-4. Железную пластинку массой 15 г продолжительное время выдерживали в растворе, содержащем 1,6 г сульфата меди(II). Затем пластинку вынули, промыли, высушили и взвесили. Чему равна ее масса [4]?
А-5. К раствору, содержащему 41,5 г хлорида меди(II), прибавили 14 г железных стружек. Как изменилась масса металлического остатка после реакции [2, 5]?
А-6. После погружения железной пластинки массой 5 г в 50 мл 15%-го раствора сульфата меди(II
(= 1,12 г/мл) количество этой соли в растворе уменьшилось в два раза. Определить массу пластинки после реакции [2, 4, 6].
А-7. Железную пластинку погрузили в раствор смеси дихлоридов меди и железа. После окончания реакции масса пластинки возросла на 1,6 г. Определите массы солей в исходном растворе, если молярные концентрации солей были одинаковыми [2].
А-8. Медную пластинку массой 18,2 г погрузили в 230 г раствора трихлорида железа с массовой долей соли 0,1. Через некоторое время пластинку вынули, при этом оказалось, что массовая доля трихлорида железа стала равной массовой доле образовавшейся соли меди(II). Определите массу пластинки после того, как ее вынули из раствора [7, 8].
А-9. Две пластинки одинаковой массы, изготовленные из одного металла (валентность металла равна двум), погрузили в растворы одинаковой концентрации: одну – в раствор соли свинца (Pb 2+ ), другую – в раствор соли меди (Cu 2+ ). Через некоторое время масса пластинки, находящейся в растворе соли свинца, увеличилась на 19%, а второй уменьшилась на 9,6%. Что это был за металл [2, 9, 10]?
А-10. В раствор, содержащий 15,4 г кристаллогидрата нитрата кадмия (четырехводного), погрузили цинковую пластинку. Через некоторое время пластинку вынули из раствора, промыли, высушили и взвесили. Масса ее увеличилась на 0,94 г. Раствор осторожно выпарили до образования кристаллогидратов нитрата кадмия (четырехводного) и нитрата цинка (шестиводного). Определите массовые доли кристаллогидратов в смеси [11].
А-11. В двух стаканах находится по 100 г растворов нитрата неизвестного металла. В первый стакан добавили порошок цинка, во второй – такую же массу порошка магния. После того как реакции завершились, осадки отделили от растворов и установили, что их массы отличаются на 0,123 г. При нагревании осадков с избытком разбавленной серной кислоты выделился газ, причем в обоих случаях осталось по 0,648 г металла, который не вступил во взаимодействие с кислотой. Установите формулу неизвестного нитрата и его массовую долю в исходном растворе [12].
А-12. В раствор, содержащий 3,2 г безводного сульфата меди(II) и 6,24 г безводного сульфата кадмия(II), погрузили цинковую пластинку. Определите, на сколько увеличилась масса пластинки, если медь и кадмий были вытеснены полностью [11, 13].
А-13. Медную пластинку массой 20 г погрузили в раствор нитрата ртути(II). Масса пластинки увеличилась на 2,74 г. Затем пластинку нагрели, и она приняла первоначальный вид. Определите, как при этом изменилась масса пластинки [13].
* Указание нескольких источников означает, что такая задача (или сходная с ней) встречается у разных авторов.
Решения и ответы
А-1. Железо будет вытеснять металлы из растворов их солей в такой последовательности:
1) сульфат серебра(I); 2) сульфат меди(II); 3) сульфат никеля. Остальные металлы вытесняться не будут.
А-2. Составим уравнение реакции:
Обозначим через х количество вещества (железа и меди) в моль.
Составим баланс изменения массы веществ для пластинки:
18 – 56х + 64х = 20.
Из этого уравнения х = 0,25 моль. Следовательно, в раствор перешло железо массой 14 г
(m(Fe) = x•M(Fe) = 0,25•56 = 14 г).
А-3.
2АgA + Zn = ZnA2 + 2Ag,
где А – одновалентный анион.
Масса пластинки увеличилась за счет того, что в раствор уходил цинк, а приходило серебро. В математическом виде это можно представить так: –Zn + Ag = m.
Пусть х – количество вещества цинка в моль, тогда:
–65х + 216х = 7,5 г.
Отсюда х = 0,05 моль. Масса извлеченного серебра: 0,05•216 = 10,8 г.
А-4.
Сначала найдем, что в избытке, а что в недостатке:
n(Fe) = 15/56 = 0,27 моль,
n(CuSO4) = 1,6/160 = 0,01 моль.
Следовательно, железо в избытке.
Найдем массу пластинки после реакции: 15 – 56•0,01 + 64•0,01 = 15,08 г.
А-5.
Определим количества веществ реагентов, взятых в реакцию:
n(СuСl2) = 41,5/135 = 0,307 моль,
n(Fe) = 14/56 = 0,25 моль.
Отсюда видно, что хлорид меди в избытке.
Найдем массу меди и разницу масс металлов до и после реакции:
m(Сu) = 0,25•64 = 16 г.
Масса осажденного металла после реакции возросла: m = 16 – 14 = 2 г.
А-6.
Масса раствора сульфата меди(II):
m = 50•1,12 = 56 г.
Масса сульфата меди(II) в исходном растворе: 0,15•56 = 8,4 г.
Масса СuSO4, вступившего в реакцию:
n(СuSO4) = n(Fe) = 4,2/160 = 0,02625 моль.
Масса пластинки после реакции составит: 5 – 56•0,02625 + 64•0,02625 = 5,21 г.
А-7. Fe + CuCl2 = FeCl2 + Cu.
Найдем количество вещества х (в моль) для реагентов, вступивших в реакцию, используя значения молярных масс железа и меди:
64х – 56х = 1,6 г.
Отсюда х = 0,2 моль;
m(CuCl2) = 0,2•135 = 27 г,
m(FeCl2) = 0,2•127 = 25,4 г.
A-8. Для составления уравнения реакции надо воспользоваться данными табл. 3 (см. «ключ Жукова», № 44/2003, с. 29):
Найдем сначала массу хлорида железа(III) в исходном растворе, она равна 23 г.
Обозначим за х количество вещества меди, тогда из уравнения ясно, что количество вещества хлорида меди(II) будет тоже х моль, а количество вещества хлорида железа(III) и хлорида железа(II) равно по 2х моль.
Масса образовавшегося хлорида меди(II) равна 134х г, а масса оставшегося трихлорида железа:
23 – 325х г.
По условию задачи:
23 – 325х = 134х.
Отсюда х = 0,05 моль.
Масса пластинки после реакции равна:
18,2 – 64•0,05 = 15 г.
А-9. Составим в общем виде уравнения реакций, протекающих в растворах разных солей, и рассмотрим два способа решения:
М + РbA = MA + Pb, (1)
где А – двухвалентный анион.
1-й способ. Пусть в обеих реакциях участвовало по одному моль веществ, тогда их массы будут совпадать с молярными.
Введем обозначения: х – масса неизвестного металла М, численно равная его молярной массе М, а у – масса пластины до реакции.
Отсюда для первой реакции:
–х + 207 = 0,19у
(в раствор переходил неизвестный металл М, из раствора приходил свинец, изменение массы составляет 0,19у).
Для второй реакции:
–х + 64 = –0,096у
(в раствор переходил неизвестный металл М, из раствора приходила медь, изменение массы составляет –0,096у, т. к. масса пластинки после опыта уменьшилась на 9,6%).
Решая эту систему уравнений, получим: у = 500 г, х = 112 г.
Молярная масса металла M(M) = 112 г/моль. По таблице Д.И.Менделеева находим, что искомый металл – кадмий (Сd).
2-й способ. Обозначим через m массу пластинки, через х – массу 1 моль неизвестного металла М, через n – количество моль каждого из металлов в наших уравнениях реакций (т. е. меди, свинца и М). Тогда 207n – масса выделившегося свинца; 64n – масса выделившейся меди; хn – масса перешедшего в раствор металла М; (207n – хn) – увеличение массы пластинки, погруженной в раствор соли свинца [см. уравнение (1)]; (хn – 64n) – убыль массы пластинки, погруженной в раствор соли меди [см. уравнение (2)].
Теперь мы можем составить следующие пропорции, преобразованием которых получим систему из двух уравнений:
следовательно,
(207n – хn)/m = 0,19; (а)
m г соответствуют 100%,
(хn – 64n) г соответствуют 9,6%,
Решая систему уравнений (а) и (б), находим х, т. е. массу 1 моль неизвестного металла М, х = 112 г. Следовательно, наш металл – кадмий.
А-10.
1-й способ. Обозначим за х количество вещества для цинка и кадмия, участвующих в реакции (они равны). Найдем, какое количество вещества вступило в реакцию:
–m(Zn) + m(Сd) = m,
–65х + 112х = 0,94 г.
Отсюда х = 0,02 моль.
Тогда масса кристаллогидрата кадмия, вступившего в реакцию, будет равна 0,02•308 = 6,16 г. Масса оставшегося (непрореагировавшего) кристаллогидрата нитрата кадмия будет равна:
15,4 – 6,16 = 9,24 г.
Масса нитрата цинка, получившегося в результате реакции, равна:
а масса кристаллогидрата нитрата цинка равна:
3,78 + 2,16 = 5,94 г.
Массовые доли кристаллогидратов солей в смеси равны:
2-й способ. Из условия задачи следует, что в растворе было 15,4/308 = 0,05 моль кристаллогидрата нитрата кадмия. Из уравнения реакции понятно, что растворение 1 моль цинка приводит к одновременному выделению на пластинке 1 моль кадмия. Тогда бы изменение массы пластинки составило: 112 – 65 = 47 г. Реальное изменение массы пластинки составило 0,94 г, т. е. можно определить количество вещества металла, выделившегося на пластинке: 0,94/47 = 0,02 моль.
С учетом того, что количества веществ реагентов, участвующих в этой реакции, равны, столько же – 0,02 моль – получено кристаллогидрата цинка.
Вычислим массу этого кристаллогидрата:
Следовательно, после выпаривания останется 5,94 г кристаллогидрата цинка и 0,05 – 0,02 = 0,03 моль кристаллогидрата кадмия (не вступившего в реакцию) или 0,03•308 = 9,24 г.
В процентах это составит:
3-й способ. Зная, что 112 г кадмия выделилось бы на пластинке, если бы в реакцию вступил
1 моль цинка (за х обозначим массу выделившегося на пластинке кадмия), запишем:
х = 0,94•112/47 = 2,24 г.
Из формулы кристаллогидрата четырехводного нитрата кадмия мы можем установить, какая масса кристаллогидрата (х1) содержит 2,24 г кадмия:
х1 = 2,24•308/112 = 6,16 г.
Затем вычислим массу цинка (х2), который растворился при выделении на пластинке 2,24 г кадмия:
х2 = 2,24•65/112 = 1,3 г.
Узнаем теперь, какая масса кристаллогидрата шестиводного нитрата цинка (х3) могла образоваться из 1,3 г растворившегося цинка:
х3 = 1,3•297/65 = 5,94 г.
Следовательно, в остатке после выпаривания будет находиться 5,94 г кристаллогидрата нитрата цинка и 15,4 – 6,16 = 9,24 г кристаллогидрата кадмия, что составит в процентах:
А-11. Уравнения происходивших реакций запишем в общем виде:
Анализ условия показывает, что в обоих случаях осадки – это смеси непрореагировавшего цинка и неизвестного металла (1-й стакан), а также непрореагировавшего магния и неизвестного металла
(2-й стакан).
Если бы в реакции вступило строго по 1 моль реагентов (цинка и магния), то разность масс полученных осадков составила бы: 65 – 24 = 41 г. В нашем же случае реальная разность составила 0,123 г. По этим данным вычислим количество вещества для прореагировавших цинка и магния:
n = 0,123/41 = 0,003 моль.
В соответствии с уравнениями (1) и (2) неизвестного металла выделяется вдвое большее количество, т. е. 0,006 моль. При этом масса этих 0,006 моль составляет 0,648 г (ведь цинк и магний полностью реагируют с разбавленной серной кислотой, находящейся в избытке). Тогда можно вычислить молярную массу неизвестного металла:
М(М) = 0,648/0,006 = 108 г/моль.
Этот металл – серебро. Следовательно, в стаканах находился нитрат серебра.
Используя уравнение (1), запишем:
х = 340•0,648/216 = 1,02 г.
Поскольку в стаканах содержалось по 100 г раствора, то эта цифра одновременно показывает процентную концентрацию нитрата серебра в каждом стакане:
А-12.
1-й способ.
n(CuSO4) = 3,2/160 =0,02 моль,
n(СdSO4) = 6,24/208 = 0,03 моль.
В первой реакции изменение массы равно:
m = –m(Zn) + m(Сu) = –0,02•65 + 0,02•64 = –0,02 г.
Во второй реакции изменение массы равно:
m = –m(Zn) + m(Сd) =–0,03•65 + 0,03•112 = 1,41 г.
Прирост массы равен:
1,41 – 0,02 = 1,39 г.
2-й способ. В условии задачи сказано, что в растворе содержалось 3,2 г сульфата меди и 6,24 г сульфата кадмия, что позволяет вычислить, сколько чистой меди и кадмия содержится в указанных массах веществ:
m(Cu) = 3,2•64/160 = 1,28 г,
m(Cd) = 6,24•112/208 = 3,36 г.
Из уравнения (1) можно вычислить массу цинка (х1), реально переходящего в раствор во время первой реакции:
х1 = 1,28•65/64 = 1,3 г.
Аналогично из уравнения (2) можно вычислить массу цинка (х2), перешедшего в раствор во время второй реакции:
х2 = 3,36•65/112 = 1,95 г.
Теперь можно вычислить суммарное изменение массы цинковой пластинки. После того как произошли обе реакции в растворе, на пластинке осело 1,28 г меди (после первой реакции) и 3,36 г кадмия (после второй реакции), т. е. 4,64 г металлов. При этом одновременно в раствор перешло
1,3 г цинка (после первой реакции), а затем 1,95 г цинка (после второй реакции), т. е. всего 3,25 г цинка. Изменение массы пластинки составило:
4,64 – 3,25 = 1,39 г.
А-13. Масса пластинки стала 18,72 г.
ЛИТЕРАТУРА
1. Власов Ю.Г., Корольков Д.В., Чарыков А.К., Артемьев В.И. Знания – молодежи. Химия. Л., 1969, 157 с.
2. Серова В.А., Серов Д.В. Металлы. Задачи по химии. Вып. IХ. Гатчина, 1996, 16 с.
3. Смирнова Л.М., Жуков П.А. Сборник задач по общей и неорганической химии. 8–11 классы. СПб., 2000, 126 с.
4. Соловьев С.Н., Винокуров Е.Г., Дикая Н.Н. Химия для абитуриентов Менделеевского университета. М., 1999, 72 с.
5. Михайлов М.Д., Петрова Г.А., Семенов И.Н. Тренировочные упражнения по химии. Л., 1989, 143 с.
6. Слета Л.А., Холин Ю.В., Черный А.В. Конкурсные задачи по химии с решениями. Харьков, 1998, 96 с.
7. Кузьменко Н.Е., Еремин В.В., Осин С.Б., Чуранов С.С., Зык Н.В., Путилин Ф.Н. Конкурсный экзамен по химии. МГУ, 1992–1993. М., 1994, 125 с.
8. Кузьменко Н.Е., Еремин В.В., Чуранов С.С. Сборник конкурсных задач по химии. М., 2001, 537 с.
9. Адамович Т.П., Васильева Г.И., Попкович Г.А., Улазова А.Р. Сборник упражнений и усложненных задач с решениями по химии. Минск, 1970, 160 с.
10. Адамович Т.П., Васильева Г.И., Попкович Г.А., Улазова А.Р. Сборник упражнений и усложненных задач с решениями по химии. Минск, 1979, 253 с.
11. Середа И.П. Конкурсные задачи по химии. Киев, 1978, 192 с.
12. Янклович А.И. Химия: В помощь выпускнику школы и абитуриенту. СПб., 1999, 255 с.
13. Сидельникова В.И. Сборник задач повышенной трудности и упражнений по химии. Тюмень, 1994, 151 с.
" В РАСТВОР ПОГРУЖЕНА ПЛАСТИНКА. "
В предлагаемом пучке задач задания К-5 и К-10 посвящены распознаванию неизвестного металла в растворе соли или пластинки. Для этого приведены количественные данные ряда химических реакций. Задачи К-3, К-6, К-7 – интересные примеры заданий на избыток-недостаток реагентов. Стандартные задания – определение массы металла, выделившегося на пластинке, по изменению массы пластинки (К-4, К-13), нахождение массовой доли соли в растворе после реакции замещения. В задаче К-12 с помощью железной пластинки удается рассчитать массовые доли солей в смеси NaBr и RbBr, реагирующей с раствором AgNO3.
Пучок ЗАДАЧ К
К-1. Какой из металлов будет вытеснен раньше, если в раствор, содержащий сульфат меди(II) и сульфат железа(II), погрузить очищенную от оксида цинковую пластинку [1]?
К-2. Медную проволоку (или медные стружки) поместили в растворы солей: а) нитрата серебра;
б) ацетата свинца; в) трихлорида железа. Что будет наблюдаться? Почему? Напишите уравнения возможных реакций в молекулярной и ионной формах [2].
К-3. В раствор, содержащий 0,1 моль нитрата свинца(II) и столько же нитрата ртути(II), погрузили цинковую пластинку массой 9,75 г. Сколько каждого металла по массе выделится из раствора, если цинковая пластинка полностью растворится [см. 1]?
К-4. Дихлорид меди используют для изготовления биметаллической формы алюминий–медь способом химического меднения. Сколько меди выделилось на алюминиевой пластинке, погруженной в раствор дихлорида меди, если ее масса увеличилась на 13,8 г [см. 1]?
К-5. Кусочек железа поместили в раствор нитрата неизвестного металла, который проявляет в соединениях степень окисления +1. Масса образца металла увеличилась при этом на 16 г. Через полученный раствор нитрата железа(II) пропустили избыток сероводорода и получили сульфид железа(II) массой 8,8 г. Какой металл был выделен из раствора [3, 4]?
К-6. В раствор сульфата меди(II) массой 248 г поместили порошок магния массой 20 г. Через некоторое время металлический осадок собрали и высушили. Его масса составила 28 г. Определите массовую долю сульфата магния в полученном растворе [см. 4].
К-7. К раствору, содержащему 40,5 г дихлорида меди, прибавили 14 г железных стружек. Как изменится масса металла после завершения реакции [5]?
К-8. В 250 г воды растворили 70 г медного купороса. В полученный раствор погрузили железную пластинку массой 10 г. Через некоторое время промытая и высушенная пластинка имела массу
11,4 г. Определите массовые доли веществ в получившемся растворе [6].
К-9. 40 г медной проволоки погрузили на некоторое время в 500 г 20%-го раствора нитрата серебра. Определите массовые доли солей и массу проволоки в момент, когда концентрации солей в растворе выравнялись [7].
К-10. В раствор соли неизвестного двухвалентного металла поместили пластинку другого неизвестного металла, атомная масса которого в 4,6 раза меньше атомной массы первого металла. Через некоторое время масса пластинки увеличилась на 21,24 г. Определите неизвестные металлы, если дополнительно известно, что масса выделившегося на пластинке металла в 8,34 раза меньше массы одного моля его атомов, а пластинка выполнена из трехвалентного металла [8].
К-11. Железную пластинку массой 100 г поместили в 0,5 л 20%-го раствора сульфата меди(II) плотностью 1,2 г/см 3 . Через некоторое время пластинку извлекли из раствора, промыли, высушили и взвесили. Ее масса составила 104 г. Определите, как изменилась концентрация сульфата меди(II) в растворе [9].
К-12. К 786 мл водного раствора нитрата серебра с концентрацией 0,70 моль/л добавили 70,1 г смеси бромидов натрия и рубидия. Осадок отфильтровали, а в раствор погрузили железную пластинку. После окончания реакции масса пластинки изменилась на 0,4 г. Рассчитайте массовые доли бромидов в исходной смеси [10].
К-13. В раствор нитрата серебра погрузили медную пластинку массой 9,547 г. Через некоторое время пластинку вынули из раствора, промыли, высушили и взвесили. Масса ее оказалась равна 9,983 г. Сколько серебра по массе выделилось на пластинке [11, 12]?
К-1. Сначала вытеснится медь.
К-2. Медная проволока в растворе нитрата серебра будет покрываться серебром, а в растворе трихлорида железа – растворяться. Уравнения реакций:
Настоящий пучок задач включает операции с цинковыми, медными и железными пластинками, погружаемыми в растворы солей CuSO4, AgNO3, Fe(NO3)3.
«Изюминки» представляют задания на определение неизвестного металла (Ж-7), составление уравнений реакций магния с растворами AlCl3 и AgNO3 (Ж-10), серебрение стальных колец (Ж-11).
Пучок задач Ж
Ж-1. Цинковая пластинка при погружении в раствор сульфата меди(II) покрывается слоем меди. Как изменяется при этом масса пластинки [1]?
Ж-2. Установлено, что масса медной пластинки, погруженной в раствор нитрата серебра, сначала увеличивается, а потом довольно быстро становится неизменной, несмотря на то, что раствор по-прежнему дает осадок при добавлении раствора поваренной соли. Объясните происходящее явление [2].
Ж-3. В раствор нитрата серебра погрузили медную пластинку. Через некоторое время пластинку вынули из раствора, промыли, высушили. Масса пластинки увеличилась на 0,440 г. Определите, сколько серебра отложилось на пластинке [1].
Ж-4. В раствор сульфата меди(II) была погружена железная пластинка. Через некоторое время масса пластинки увеличилась на 0,16 г. Сколько меди выделилось на пластинке [1]?
Ж-5. Железную пластинку погрузили в раствор сульфата меди(II). Через некоторое время ее вынули, промыли, высушили и взвесили. Масса пластинки увеличилась на 1,30 г. Найдите массу меди, которая выделилась на пластинке [3].
Ж-6. Цинковую пластинку поместили в раствор нитрата серебра. Какая масса цинка перешла в раствор, если масса раствора уменьшилась на 3,02 г [3]?
Ж-7. Раствор сульфата двухвалентного металла содержит 1,120 г металла в виде ионов. После полного выделения металла на цинковой пластинке ее масса увеличилась на 0,470 г. Установите неизвестный металл [3].
Ж-8. На железной пластинке, погруженной в раствор сульфата меди(II), выделилось 40 г меди. На сколько граммов изменилась масса железной пластинки [4, 5]?
Ж-9. Масса медной пластинки, находившейся некоторое время в растворе нитрата серебра, увеличилась на 2,18 г. Сколько граммов серебра выделилось на медной пластинке [4, 5]?
Ж-10. Смешали растворы трихлорида алюминия и нитрата серебра и поместили туда кусочек магния. Составьте молекулярные и ионные уравнения происходящих процессов [4].
Ж-11. При производстве серебряных колец, идущих на изготовление хрустальных ваз, стальное (железное) кольцо покрывают тонким слоем серебра. Пользуясь этой технологией, в раствор нитрата серебра погрузили стальное кольцо массой 40 г. Через некоторое время его вынули, промыли и высушили. Масса кольца стала 42 г. Сколько серебра отложилось на таком кольце [6]?
Ж-12. Медную пластинку массой 20 г погрузили в 300 мл раствора нитрата железа(III) с плотностью 1,3 г/см 3 и массовой долей соли 0,15. После некоторого выдерживания пластинки в растворе ее вынули, при этом оказалось, что массовая доля нитрата железа(III) стала равна массовой доле образовавшейся соли меди(II). Определите массу пластинки после того, как ее вынули из раствора [7].
Ж-13. Медную пластинку массой 20 г выдержали в растворе нитрата серебра до полного окончания реакции, после чего масса пластинки увеличилась на 19%. Вычислите массу нитрата серебра в исходном растворе.
Ж-1. Масса пластинки уменьшается. В реакции замещения со взятыми по 1 моль реагентами
Ж-2. Учтите, что серебро, выделяющееся на пластинке, покрывает ее равномерным слоем, плотно прилегающим к поверхности меди. Это делает невозможным дальнейшее осуществление реакции, хотя в растворе имеется еще достаточное количество нитрата серебра.
Ж-3. 0,625 г серебра.
Ж-5. На пластинке выделилось 10,4 г меди.
Ж-6. В раствор перешло 1,3 г цинка.
Ж-7. МSO4 + Zn = ZnSO4 + M,
где М – искомый металл.
Изменение массы пластинки равно:
m = –m(Zn) + m(М) = 0,47 г,
–m(Zn) = 0,47 – 1,12 г, m(Zn) = 0,65 г.
Отсюда можно предположить, что искомый металл – кадмий (М = 112 г/моль), т.к.
М(Zn) = 65 г/моль. Причем всех веществ, участвующих в реакции, было взято по 0,01 моль.
Ж-8. Масса пластинки изменилась на 5 г.
Ж-9. На пластинке выделилось 3,1 г серебра.
Ж-10. В водном растворе соль AlCl3 постепенно гидролизуется:
Поэтому с нитратом серебра могут реагировать три разные соли алюминия, например:
Магний, добавленный к такой смеси, реагирует с имеющейся в растворе соляной кислотой (если AlCl3 в избытке):
В результате кислота HCl выводится из раствора и гидролиз AlCl3, не прореагировавшего с AgNO3, может пройти полностью до Al(OH)3. Если в растворе избыток AgNO3, то идет другая реакция:
Еще одна реакция – вытеснение магнием алюминия из его соли:
Ж-11. Химизм серебрения железных колец может быть представлен следующим образом:
Пусть х г – масса серебра, отложившегося на кольце. Если бы растворилось 56 г железа, то образовалось бы 216 г серебра, при растворении же (х•56/216) г железа образуется х г серебра.
Уравнение баланса массы: х – х•56/216 = 2 (реальный прирост массы кольца составил 2 г).
Из этого уравнения х = 2,7 г, т.е. на кольце отложилось 2,7 г серебра.
Ж-12. Медь растворяется в растворе Fe(NO3)3 и восстанавливает ионы Fe 3+ до Fe 2+ :
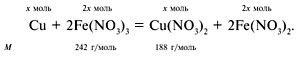
Найдем массу нитрата железа(III) в исходном растворе:
Обозначим через х моль – количество вещества меди. Тогда масса образовавшегося
нитрата меди(II):
а масса оставшегося нитрата железа(III):
По условию задачи:
58,5 – 484х = 188х.
Отсюда х = 0,09 моль.
Масса пластинки после реакции равна:
20 – 64•0,09 = 14,24 г.
1. Абкин Г.Л. Задачи и упражнения по химии. М., 1967, 88 с.
2. Чуранов С.С. Химические олимпиады в школе. М., 1982, 191 с.
3. Чмиленко Ф.В., Виниченко И.Г., Чмиленко Т.С. Подготовка к экзамену по химии с контролем на ЭВМ. М., 1994, 144 с.
4. Гуськова Л.Г. Задачи и упражнения по химии. М., 1976, 190 с.
5. Журин А.А. Сборник задач по химии. М., 1997, 254 с.
6. Решетова М.Д. Сборник задач по химии (с решениями). М., 1992, 58 с.
7. Янклович А.И. Химия. В помощь выпускнику школы и абитуриенту. СПб., 1999, 255 с.
Подборка задач на тему "Электрохимический ряд напряжения металлов"

Задачи с условным названием «на изменение массы пластинок» одни из самых сложных в школьном курсе химии. В задачи этого типа говорится о взаимодействии металла с солью менее активного металла, в результате чего более атомы, более активного металла замещают в составе соли атомы менее активного металла. Работать с задачами данного типа целесообразно либо в курсе 9 класса, при изучении темы «Химические свойства металлов» либо в 11 классе, в теме «Общий обзор металлов». Можно выделить несколько разновидностей задач указанного типа и два разных подхода к их решению.
Просмотр содержимого документа
«Подборка задач на тему "Электрохимический ряд напряжения металлов"»
В раствор хлорида меди(II) поместили железную пластинку массой 40г. Через некоторое время пластинки стала равна 41,6 г. Какая масса меди выделилась на пластинке?
В 136г 25%-ного раствора нитрата серебра поместили медную пластинку массой 15г. Через некоторое время пластинку вынули из раствора, высушили и взвесили. Её масса оказалась равной 22,6г. Какова массовая доля нитрата серебра в растворе после реакции?
В раствор хлорида олова(II) массой 380г внесли кусочек цинка. После реакции масса кусочка металла увеличилась на 5,4г. Вычислите массовую долю хлорида цинка в растворе после реакции.
В раствор хлорида кобальта(II) массой 380 г с массовой долей соли 40 % поместили кусочек неизвестного металла (М). Через некоторое время вынули из раствора, высушили и взвесили, его масса увеличилась на 14 г. Массовая доля хлорида кобальта в растворе после реакции стала равной 8,75 %. Определите неизвестный металл, если известно, что в образовавшемся оксиде он имеет степень окисления +2.
Кусочек марганца поместили в 257,4 г раствора хлорида неизвестного металла (М), проявляющего в соединении степень окисления +2. По окончании реакции масса образца увеличилась на 5,4г, а массовая доля хлорида марганца(II) в растворе составила 30%. Определите неизвестный металл.
В 150 г 9,6% -ного раствора сульфата меди(II) поместили оловянную пластинку массой 13,1 г. Найдите массу пластинки по окончании реакции.
В раствор нитрата серебра внесли никелевую пластинку массой 25 г. Через некоторое время пластинку вынули из раствора и высушили, её масса стала равна 48,55 г. Вычислите массовую долю Ni (в %) в пластинке по окончании реакции.
В раствор нитрата свинца(II) массой 150 г с массовой долей растворённого вещества 20% поместили железную пластинку массой 20 г. Пластинку вынули из раствора, когда массовая доля нитрата свинца(II) в растворе стала равной 5%. Найдите массу пластинки после реакции.
В 300г раствора, содержащего нитрат железа(II) (массовая доля соли 6%) и хлорид меди(II) (массовая доля соли 9%), поместили опилки магния, масса которых равна 6 г. Определите массу металлического осадка по окончании реакции.
Алюминиевую пластинку массой 50 г опустили в раствор хлорида меди(II). Спустя некоторое время пластинку извлекли из раствора, аккуратно промыли, высушили и взвесили, ее масса оказалась равной 63,8 г. Чему равна масса меди, выделившейся на пластинке?
В раствор сульфата меди(II) массой 248 г поместили порошок магния массой 20 г. Через некоторое время металлический осадок собрали и высушили. Его масса составила 28 г. Определите массовую долю сульфата магния в полученном растворе. 3 (w(MgSO4) = 10%.)
Железную пластинку массой 5,2 г продолжительное время выдерживали в растворе, содержащем 1,6 г сульфата меди. По окончании реакции пластинку вынули из раствора и высушили. Чему стала равна ее масса?
Железная пластинка массой 18 г была погружена в раствор сульфата меди(II). Когда она покрылась медью, ее масса стала равной 20 г. Какая масса железа перешла в раствор?
Цинковую пластинку массой 100 г длительное время выдерживали в растворе сульфата железа(II) объемом 304 мл. плотностью 1,1 г/мл с массовой долей 6%. Затем пластинку вынули, промыли и высушили. Рассчитайте массу пластинки и массовую долю сульфата цинка в образовавшемся растворе
Железные стружки поместили в раствор нитрата неизвестного металла, проявляющего в соединениях степень окисления +1. После окончания реакции стружки извлекли из раствора, оказалось, что их масса увеличилась на 3,2 г. Через полученный раствор пропустили избыток сероводорода и получили 1,76 г осадка сульфида железа(II). Определите неизвестный металл.
В 200 мл раствора нитрата свинца и нитрата серебра с концентрацией каждой соли 0,1 моль/л, поместили железные стружки массой 1,2 г. После окончания реакции металлический осадок отделили, промыли и высушили. Рассчитайте массу осадка.
25 г медной проволоки погрузили в 140 г 15%-го раствора нитрата серебра. Спустя некоторое время оказалось, что массовые доли солей в растворе одинаковы. Чему будет равна масса проволоки в этот момент?
К раствору нитрата ртути(I) массой 264 г с массовой долей соли 20% добавили цинковые опилки. Через некоторое время массовая доля нитрата ртути(I) в растворе составила 6%. Рассчитайте, как изменится масса металла.
Хлорид металла I группы Периодической системы массой 6,75 г растворили в воде и в полученный раствор погрузили железную пластинку массой 50 г. После окончания реакции пластинку извлекли, промыли, высушили и взвесили. Оказалось, что ее масса возросла на 0,8%. Определите металл.
Цинковую пластинку массой 8 г опустили в 50 мл 15%-ного раствора нитрата свинца (плотность 1,32 г/мл) и вынули, когда ее масса стала равной 10,84 г. Во сколько раз уменьшилась масса нитрата свинца в растворе к этому моменту?
В 50 г раствора сульфата двухвалентного металла поместили кадмиевую. пластинку. Спустя некоторое время масса пластинки уменьшилась на 1,2 г, а массовая доля сульфата кадмия в растворе составила 8,125%. Определите металл.
Читайте также:
