Медь это легкий или тяжелый металл
Обновлено: 05.10.2024
Тяжёлые мета́ллы — группа химических элементов со свойствами металлов (в том числе и полуметаллы) и значительным атомным весом либо плотностью. Известно около сорока различных определений термина тяжелые металлы, и невозможно указать на одно из них, как наиболее принятое. Соответственно, список тяжелых металлов согласно разным определениям будет включать разные элементы. Используемым критерием может быть атомный вес свыше 50, и тогда в список попадают все металлы, начиная с ванадия, независимо от плотности. Другим часто используемым критерием является плотность, примерно равная или большая плотности железа (8 г/см3), тогда в список попадают такие элементы как свинец, ртуть, медь, кадмий, кобальт, а, например, более легкое олово выпадает из списка. Существуют классификации, основанные и на других значениях пороговой плотности или атомного веса. Некоторые классификации делают исключения для благородных и редких металлов, не относя их к тяжелым, некоторые исключают нецветные металлы (железо, марганец).
Термин тяжелые металлы чаще всего рассматривается не с химической, а с медицинской и природоохранной точек зрения [1] и, таким, образом, при включении в эту категорию учитываются не только химические и физические свойства элемента, но и его биологическая активность и токсичность, а также объем использования в хозяйственной деятельности. [2]
Содержание
Биологическая роль
Многие тяжелые металлы, такие как железо, медь, цинк, молибден, участвуют в биологических процессах и в определенных количествах являются необходимыми для функционирования растений, животных и человека микроэлементами. С другой стороны, тяжёлые металлы и их соединения могут оказывать вредное воздействие на организм человека, способны накапливаться в тканях, вызывая ряд заболеваний. Не имеющие полезной роли в биологических процессах металлы, такие как свинец и ртуть, определяются как токсичные металлы. Некоторые элементы, такие как ванадий или кадмий, обычно имеющие токсичное влияние на живые организмы, могут быть полезны для некоторых видов. [3]
Загрязнение тяжелыми металлами
Среди разнообразных загрязняющих веществ тяжёлые металлы (в том числе ртуть, свинец, кадмий, цинк, мышьяк) и их соединения выделяются распространенностью, высокой токсичностью, многие из них — также способностью к накоплению в живых организмах. Они широко применяются в различных промышленных производствах, поэтому, несмотря на очистительные мероприятия, содержание соединения тяжелых металлов в промышленных сточных водах довольно высокое. Они также поступают в окружающую среду с бытовыми стоками, с дымом и пылью промышленных предприятий. Многие металлы образуют стойкие органические соединения, хорошая растворимость этих комплексов способствует миграции тяжелых металлов в природных водах. К тяжелым металлам относят более 40 химических элементов, но при учете токсичности, стойкости, способности накапливаться во внешней среде и масштабов распространения токсичных соединений, контроля требуют значительно меньшее число элементов.
Загрязнение океана
Помимо сточных вод, большие массы соединений тяжелых металлов поступают в океан через атмосферу и с захоронением разнообразных отходов в Мировом океане. Для морских биоценозов наиболее опасны ртуть, свинец и кадмий.
Ртуть
Ртуть переносится в океан с материковым стоком (прежде всего — из стока промышленных вод) и через атмосферу. В составе атмосферной пыли содержится около 12 тыс.т. ртути. До трети от этого количества образуется при выветривании пород, содержащих ртуть (киноварь). Ртуть антропогенного происхождения попадает в атмосферу в первую очередь при сжигании угля на электростанциях. Около половины годового промышленного производства этого металла (910 тыс. тонн) попадает в океан. Некоторые бактерии переводят токсичные хлориды ртути в еще более токсичную метилртуть. [4] Соединения ртути накапливается многими морскими и пресноводными организмами в концентрациях, во много раз превышающих содержание ее в воде.
Употребление в пищу рыбы и морепродуктов неоднократно приводило к ртутному отравлению населения. Так, к 1977 году насчитывалось 2800 жертв болезни Минамата, причиной которой послужило поступление в залив Минамата со сточными водами отходов предприятий, на которых в качестве катализатора использовалась хлористая ртуть. Соединения ртути высокотоксичны для человека.
Свинец
Свинец — рассеянный элемент, содержащийся во всех компонентах окружающей среды: в горных породах, почвах, природных водах, атмосфере, живых организмах. Помимо того, свинец поступает в окружающую среду в результате хозяйственной деятельности человека, в том числе с выхлопными газами поступает используемый в топливе тетраэтилсвинец. Через атмосферу океан получает 20-30 тысяч тонн свинца в год с континентальной пылью. [4]
В организм человека свинец попадает как с пищей и водой, так и из воздуха. Свинец может выводиться из организма, однако малая скорость выведения может приводить к накоплению в костях, печени и почках.
Кадмий
Кадмий является относительно редким и рассеянным элементом, в природе концентрируется в минералах цинка. Поступает в природные воды в результате смыва почв, выветривания полиметаллических и медных руд, и со сточными водами рудообогатительных, металлургических и химических производств. Кадмий в норме присутствует в организме человека в микроскопических количествах. При накоплении организмом соединений кадмия поражается нервная система, нарушается фосфорно-кальциевый обмен. Хроническое отравление приводит к анемии и разрушению костей.
Медь это легкий или тяжелый металл
МЕДЬ
Cu (cuprum),
химический элемент IB подгруппы (семейства монетных металлов - Cu, Ag, Au) периодической системы элементов. Известна и широко используется с древних времен (медный век, бронзовый век). Медь наряду с серебром и золотом используется для чеканки монет, применяется в произведениях искусства и в электротехнике. Медь получают из ее руд: куприта, содержащего оксид меди, малахита, содержащей основной карбонат меди, халькозина (медный блеск) и халькопирита (медный колчедан), содержащих сульфид меди. Мировым лидером по производству меди считается Чили, затем идут США, Россия, Казахстан, Канада, Замбия, Заир, Польша и Перу.
Свойства. Медь - мягкий, тяжелый, ковкий, тягучий, вязкий и достаточно прочный металл красновато-желтого цвета в отраженном свете и зеленый в проходящем (в очень тонком слое). Чистая медь очень хорошо проводит тепло и электрический ток, уступая в этом только серебру, но ее электрическая проводимость резко падает в присутствии примесей мышьяка, сурьмы, кремния и др. Расплавленная медь поглощает воздух и после затвердевания в отливке остаются пузырьки воздуха, затрудняющие обработку. В ряду напряжений медь стоит после водорода и при реакции с кислотами не вытесняет из них водород, поэтому медь широко используется в гальванических элементах. Медь устойчива к коррозии при обычной температуре в сухом воздухе, но при нагревании окисляется, образуя оксиды меди(I) и меди(II): Cu2O и CuO. При долговременной атмосферной коррозии постепенно образует основной карбонат, по составу аналогичный малахиту: 2Cu + O2 + CO2 + H2O = Cu2(OH)2CO3. С галогенами медь соединяется уже при комнатной температуре, легко взаимодействует с серой и селеном; с водородом, азотом и углеродом не реагирует даже при высокой температуре. В отсутствие кислорода медь не реагирует ни с хлороводородной (соляной) кислотой, ни с разбавленной серной, но растворяется в горячей концентрированной серной кислоте (Cu + 2H2SO4 (r) CuSO4 + SO2 + 2H2O) и хорошо в азотной, образуя нитрат меди и оксиды азота. СВОЙСТВА МЕДИ
Атомный номер 29 Атомная масса 63,54 Изотопы
Температура плавления, ° С 1083 Температура кипения, ° С 2567 Плотность, г/см3 8,92 Твердость (по Моосу) 2,5 Содержание в земной коре, % (масс.) 0,007 Степени окисления +1, +2
Применение. Большая часть мирового производства меди используется в электротехнической промышленности для изготовления проводов. Листовая медь широко применяется для изготовления кровли, желобов, водостоков. Из-за коррозионной стойкости в морской воде, и в частности к действию морских организмов и растений, она является прекрасным материалом для кораблей. Медь часто используют в химической, пищевой промышленности и промышленности ферментов, для изготовления чайников, перегонных аппаратов, емкостей, теплообменников и другой утвари. Благодаря своему блеску и красивому цвету медь широко используется в декоративных изделиях и произведениях искусства, а также в гальванопластике и гравировании. Медь входит в состав многочисленных сплавов, которых известно более 1000. Самые распространенные из них - латуни (сплавы с цинком), бронзы (сплавы с оловом), медно-никелевые сплавы (мельхиор, нейзильбер, манганин, копель и т.д.); одним из наиболее распространенных применений меди является ее использование в сплавах для чеканки монет. Медь принадлежит к числу микроэлементов, необходимых для нормальной жизнедеятельности растений. Ее вносят в почву с микроудобрениями. Она способствует росту растений, повышению устойчивости против засухи, холода и некоторых заболеваний.
Соединения. Электронное строение атома меди 1s22s22p63s23p63d104s1. Атом меди легко отдает внешний электрон, образуя соединения Cu(I). Не все электроны на 3d-оболочке прочно удерживаются ядром, поэтому многие элементы способны оттягивать два электрона от атома меди, образуя устойчивый ион Cu2+. Соединения Cu(II) наиболее распространены и более стабильны, а относительно малый радиус иона и высокий заряд ядра позволяют меди проявлять акцепторные свойства с образованием комплексных ионов, например [[CuCl4]]2-, имеющего координационную связь. Ионы меди координируют молекулы воды в растворе, образуя стабильный комплексный ион [[Cu(H2O)4]]2+, который и вызывает голубую окраску разбавленных водных растворов соединений меди. Медь образует много соединений в степени окисления +1 и +2, но известны и некоторые нестабильные соединения меди в степени окисления +3. Соединения в степени окисления +1 обычно плохо растворяются в воде, являются восстановителями, легко окисляются на воздухе и, как правило, менее практически ценны и реже используются по сравнению с соединениями, в которых медь находится в степени окисления +2.
Соединения меди(I). Cu2O - темнокрасный кристаллический порошок, применяемый для изготовления рубинового стекла, окрашивания фарфора, гальванопластики металлических поверхностей. Хлорид меди(I) CuCl - серовато-белый кристаллический порошок, используемый как инсектицид, для очистки ацетилена и денитрации искусственного шелка. Кислота HCuCl2 (с комплексным анионом) используется в газовом анализе для поглощения CO.
Соединения меди(II). Оксид CuO - черный порошок, активный окислитель, используемый при сжигании органических соединений в элементном анализе. CuO используется также для производства солей, окраски в зеленый или голубой цвет стекла, фарфора, глиняных изделий, для очистки нефти от серы и в медицине. Гидроксид Cu(OH)2 - голубовато-зеленый порошок - в горячих растворах превращается в черный оксид меди(II). Гидроксид меди(II) растворяется в растворе тартрата щелочного металла с образованием тартрата меди CuC4H4O6 (реактив Фелинга), применяемого для обнаружения и определения восстанавливающих сахаров. Гидроксид меди(II) используется также как фунгицид в составе бордоской жидкости для уничтожения или предотвращения развития патогенных грибов и бактерий на семенах и сельскохозяйственных растениях на полях и на фабриках производства кормов. Гидроксид тетрамминмеди(II) (комплексное соединение) темноголубого цвета используется в качественном анализе на медь, как растворитель для хлопка, шелка, полотна и в производстве искусственного шелка. Хлорид меди CuCl2.2H2O в виде голубовато-зеленых кристаллов поглощает влагу из влажного воздуха, может увлажнять сухой воздух и используется в производстве краски, стойких чернил и в текстильной промышленности. Сульфат меди CuSO4 - наиболее распространенное соединение меди - получают растворением оксида (гидроксида или карбоната) меди в серной кислоте или металла в конц. серной кислоте. В промышленности его получают обжигом сульфида с дальнейшим растворением оксида в серной кислоте. Безводный сульфат бесцветен, но, хорошо поглощая воду, образует голубой пентагидрат CuSO4.5H2O (медный купорос). Сульфат меди(II) используется в изготовлении электролитических покрытий, гальванопластике, для изготовления пигментов, инсектицидов, для консервирования и дубления кожи, пропитки шпал, в крашении хлопка и шелка и как вяжущее средство. Он ядовит для низших организмов, особенно для морских водорослей, и поэтому используется на станциях водоподготовки. Ацетат меди(II) Cu(CH3COO)3*H2O (ярь-медянка) применяется для приготовления зеленой масляной краски. Смешанный ацетат-арсенит меди(II) Cu(CH3COO)2*Cu3(AsO3)2 (парижская зелень) применяется для уничтожения вредителей растений. Все соли меди ядовиты, поэтому медную посуду лудят, т.е. покрывают внутри слоем олова, чтобы предотвратить возможность образования солей.
См. также
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ;
МЕДНАЯ ПРОМЫШЛЕННОСТЬ.
ЛИТЕРАТУРА
Смирнягин А.П. и др. Промышленные цветные металлы и сплавы. М., 1974 Подчайнова В.Н., Симонова Л.Н. Медь. М., 1990
Медь – цветной металл планеты номер один
Медь не относится к благородным или редким элементам. Это самый распространенный цветной металл на Земле. Благодаря своим характеристикам в почете у промышленников и ювелиров. Предмет охоты сборщиков лома.

Что представляет собой
Медь – это розоватый металл с золотисто-металлическим блеском. Элемент №29 периодической системы Менделеева. Международное обозначение – Cu (Cuprum).
Чистый металл мягок, поэтому чаще используется с примесями. Пластичен: вытягивается до микронных диаметров.
На воздухе покрывается пленкой, обретая желтовато-красный оттенок. Тонкие пластинки на просвет зеленовато-голубые.
По официальной классификации причислен к тяжелым цветным металлам. В эту же группу входят свинец, цинк, олово, никель.
История
Медь – один из первых металлов, с которыми имело дело человечество. Этому способствовали преимущества: большая распространенность, доступность, относительно низкая температура плавления.
Достоинства меди люди оценили восемь тысячелетий назад.
Медный век начался сразу после каменного:
- Древнейшими признаны медные артефакты, откопанные на территории современной Турции. Это бусинки и декоративные накладки.
- Из металла делали режущий инструментарий и посуду.
- История открытия медных рудников на Руси начинается на Урале за две тысячи лет до новой эры. Затем были Кавказ, Алтай, Сибирь.
- Промышленная переработка с использованием бронзы началась в XIV веке. Из сплава отливали пушки и колокола.
Из бронзы отлиты Царь-колокол и Царь-пушка.
Предполагается, что металл назван по имени острова Кипр. Здесь еще в III веке до нашей эры обнаружились медные залежи, а население освоило выплавку меди.
Происхождение русскоязычного термина медь «Этимологический словарь русского языка» М.Фасмера увязывает с древненемецким корнем smid – кузнец, металл.
Запасы, добыча
Глобальные объемы медной руды оцениваются в миллиард тонн (разведанные). Наличие половины подтверждено. Ученые полагают, что земная кора таит еще три миллиарда тонн меденосной руды.

Самородная медь
Богатыми запасами располагают страны на всех континентах:
- Америка – Чили, Канада, США.
- Азия – Казахстан, Иран.
- Африка – ЮАР, Замбия, Заир.
На Россию приходится 3% мировых запасов. Месторождения сосредоточены на Урале. Основной добытчик – концерн «Норильский никель».
Руду добывают открытым либо закрытым способом, в зависимости от глубины залегания.
Ежегодный мировой объем добычи руды – 15-20 млн. тонн.
Физико-химические параметры
Медь – металл с типичными внешними признаками (блеск, гладкость) и структурой кристаллической решетки. Наделена высокой электро- и теплопроводностью. По этим физическим свойствам вторая после серебра.
| Название, символ, номер | Медь/Cuprum (Cu), 29 |
|---|---|
| Атомная масса (молярная масса) | 63,546(3)а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d10 4s1 |
| Радиус атома | 128 пм |
| Химические свойства | |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+2e) 73 (+1e) 77 (K=6) пм |
| Электроотрицательность | 1,90 (шкала Полинга) |
| Электродный потенциал | +0,337 В/ +0,521 В |
| Степени окисления | 3, 2, 1, 0 |
| Энергия ионизации (первый электрон) | 745,0 (7,72) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 8,92 г/см³ |
| Температура плавления | 1356,55 K (1083,4 °С) |
| Температура кипения | 2567 °С |
| Уд. теплота плавления | 13,01 кДж/моль |
| Уд. теплота испарения | 304,6 кДж/моль |
| Молярная теплоёмкость | 24,44 Дж/(K·моль) |
| Молярный объём | 7,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 3,615 Å |
| Температура Дебая | 315 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 401 Вт/(м·К) |
| Номер CAS | 7440-50-8 |
Главное химическое свойство металла, оцененное человеком, – нулевая коррозийность. Медь химически малоактивна, при стандартных условиях не окисляется.
Медь в природе
В природе выявлено два проявления элемента – самородки и компонент соединений с другими элементами.

Самородок меди
Чаще это соединения: оксиды, сульфиды, гидрокарбонаты. Самое распространенное сырье – медный колчедан.
Медь придает глубокие синие, голубые, зеленоватые оттенки малахиту, бирюзе, хризоколле, другим минералам ювелирно-декоративного сегмента.
Способы получения
Содержание металла в рудах не превышает 2%. Поэтому перед плавкой их обогащают. Существует два способа получения меди: пиро- и гидрометаллургический.
Пирометаллургический
Многоуровневый процесс, включающий следующие этапы:
- Обогащение. Руды обогащают методом флотации. Взвешенные в воде медные частички «цепляются» к воздушным пузырькам, которые увлекают их на поверхность. На выходе получается порошок-концентрат с 12-36% меди.
- Обжиг. Процедура показана бедным (9-24% меди) медным рудам и концентратам, сильно «загрязненным» серой. При прокаливании с кислородом доля серы падает вдвое.
- Плавка. Кусками руды или порошком-концентратом загружают печи шахтного либо отражательного типа при 1452°С. Получают медный штейн.
- Продувка. В конвертерах на него воздействуют сжатым воздухом. Сульфиды и железо окисляются, образуется почти чистая (98,51 – 99,51%) черновая медь плюс железо, другие ценные компоненты в следовых количествах.
- Рафинирование. Черновой продукт отправляют на рафинирование – пламенем, затем электролитом. Примеси удаляются с газами. После первого этапа металл очищается до 99,51%, после заключительного – до 99,96%.
Способ применяется к 9/10 добытого сырья.
Гидрометаллургический
Состоит в обработке сырья растворенной серной кислотой малой концентрации и выделении металлического медного продукта.
Метод оптимален для руд с минимальным процентом меди. Извлечения других компонентов не предусматривается.
Сплавы
Номенклатура сплавов меди с другими компонентами насчитывает десятки позиций.

Сплавы меди и их применение
Они применяются чаще чистого металла, поскольку уменьшают недостатки, присущие чистому металлу. То есть делают продукт прочнее, устойчивее, дешевле.
Медные соединения подразделяются на две группы:
Помимо этих главных легирующих компонентов, в составе соединения алюминий, никель, висмут, титан, серебро, золото, неметаллические элементы.
Сферы применения
Свойства металла обусловили его применение разными сферами. Главный потребитель – промышленный комплекс.

Промышленность
Металл и сплавы разбирают следующие отрасли:
- Электротехника, радиоэлектроника. Кабели (силовые, другие), провода. Обмотка в трансформаторах. Теплообменные устройства (радиаторы отопления, кондиционеры, кулеры компьютеров, тепловые трубки ноутбуков).
- Приборо-, машиностроение. Из сплавов меди с цинком, оловом, алюминием делают детали, узлы машин. Без нее невозможно создание гальванических элементов и батарей.
- Трубы. Для транспортировки пара, воды, газа. В энергетике, судостроении, для бытовых потребностей.
В Японии медные трубопроводы признаны сейсмоустойчивыми, что для этой страны жизненно важно.

Медные трубы
Строительство
Крыши из медного листа экологичны, их можно не красить, поскольку влага, погодные катаклизмы не страшны. Срок службы – до 100 лет.
Медицина
Медициной востребованы характеристики металла как антисептика и вяжущего средства.
Это компонент глазных капель и смесей для лечения ожогов.
Медные ручки дверей, другие поверхности – атрибут лечебных учреждений.
Соединения меди подавляют вирус свиного гриппа.
Ювелирное дело
Ювелиры используют сплавы на основе меди.

Кольцо из меди
Красное или розовое золото – это конгломерат благородного металла с медью.
Ее количество в составе определяет финальный оттенок:
Эти виды золота – самые любимые ювелирами. Медь делает изделия прочнее, попутно удешевляя стоимость.

Второй популярный ювелирный сплав – мельхиор (медь + никель).
Другие отрасли
- Оксид меди – основа купрата, используемого в сверхпроводниках.
- Латунь идет на изготовление гильз для винтовок и артиллерии.
- Из мельхиора чеканят монеты, создают интерьерные украшения, столовые приборы.
- Медь задействована при синтезе хлорофилла. Ее всегда добавляют в минеральные удобрения для растений.
Значение для человека
Медь заложена в организм человека изначально:
- Участвует в образовании красных кровяных телец, коллагена, эластина.
- Активирует работу эндокринной системы, замедляет старение организма.
- Ее дефицит чреват замедлением белкового обмена. Это влечет патологии в развитии скелета и составе крови.
Она есть во многих продуктах питания. Медью богаты говяжья печень, устрицы, кунжут, какао-порошок, черный перец, гречневая крупа. А также орехи (лесной, грецкий, кешью, арахис, миндаль).
Предостережение
В составе металла есть изотопы: два стабильных плюс два десятка нестабильных. Хотя период полураспада «долгожителя» – менее 2,5 суток, материал токсичен.
Поэтому применение меди контролируется.
В России на федеральном уровне (национальный стандарт, федеральный Свод Правил) регламентируется:
- Производство и использование медных водо- паро- и газопроводных труб.
- Количество меди в питьевой воде.
В 1 литре питьевой воды не должно быть больше 1 мг меди.
Избыток медных компонентов вызывает отравление организма. Для приготовления пищи медная посуда непригодна.
Карьер, в котором медную руду извлекали открытым способом, становится источником токсичных соединений.
Мировая цена меди устанавливается на Лондонской бирже металлов. Она зависит от спроса, определяемого состоянием экономики.

И колеблется соответственно:
- К началу 2008 года преодолена психологическая отметка $8000 за тонну.
- Через полгода было уже $+940, что стало рекордом за всю историю биржи.
- На начало 2011 года взята планка $10 000.
Затем произошел спад. На 2021 год тонна меди торгуется по $8057. Сказалось торможение экономики из-за пандемии коронавируса.
Тяжелые металлы – перечень, свойства и риски элементов
Официально такой группы химических элементов не существует. Однако металлурги, аграрии, особенно экологи, оперируют понятием «тяжелые металлы». Этот сегмент привлекает повышенное внимание.

Что представляют собой
Термин «тяжелые металлы» еще двести лет назад пытался ввести в научный оборот немецкий химик Лео Гмелин.
Однако в номенклатуре Международного союза, курирующего вопросы теории и практики химии (IUPAC), такое подразделение отсутствует.
В академических и промышленных кругах циркулирует четыре десятка критериев, по которым металл признается тяжелым.
Самые популярные основания:
- Атомный номер выше 50.
- Плотность 5+ г/см3.
На практике чаще востребован второй критерий.
То есть к тяжелым металлам относятся элементы с плотностью, превышающей 5 г/см3.
В соответствии с ним таковыми считаются:
- Традиционные: железо, медь, хром, марганец, кобальт, олово, свинец, никель, цинк.
- Менее известные: кадмий, молибден, вольфрам, сурьма. Плюс экзотика – галлий, теллур.
- И самые коварные – ртуть, таллий, висмут.
На бытовом уровне они считаются токсичными элементами. Подобное отождествление некорректно.
Не каждый тяжелый металл токсичен, но таким способно стать при благоприятных условиях безобидное вещество.
Экология, медицина
У экологов и врачей свои подходы. Для них тяжелыми металлами являются особо значимые (полезные либо опасные) для биологических организмов элементы.
Суровее критерии Организации Объединенных наций (ООН). В соответствии с ее экологической доктриной, тяжелыми считаются стабильные металлы либо металлоиды, их соединения (особенно соли тяжелых металлов) с плотностью более 4,5 г/см3.
Критерий действует с 1998 года.
Классификация
Кроме плотности, маркером принадлежности к группе служат температура плавления, степень использования, другие свойства.
На основании этого выделяют следующие виды тяжелых металлов:
- – цинк, медь, олово, свинец, никель. – железо.
- Редкие – галлий, висмут, таллий, кадмий. – молибден, вольфрам, хром. – кадмий, кобальт, свинец, ртуть, олово, галлий, таллий, висмут.
Самый тяжелый металл планеты – иридий. Кубик с ребром в 1 см весит 22,6 грамма. Но вещество попадает на Землю только с метеоритами.

Иридий
В сегменте обычных земных «тяжеловесов» лидирует вольфрам – он на три грамма легче. Это восьмая позиция среди металлов.
Откуда берутся
Естественных поставщиков тяжелых металлов четыре:
- Горное сырье. Чаще это магматические либо осадочные породы.
- Породообразующие минералы. У меди, например, это малахит и другие минералы.
- Вулканы. Частицы вещества извергаются попутно с вулканическими продуктами (газами, гейзерами).
Еще один источник – Вселенная. Вещество заносится в стратосферу метеоритами либо облаками космической пыли.
Получение продукта
На большинстве металлургических комбинатах сырье плавят в доменных и мартеновских печах. Это оборудование из позапрошлого века делает процесс тяжелым, опасным для экологии и человека.
Внедрение « зеленых » технологий продвигается медленно, поскольку требует инвестиций.
Результат недостаточной очистки отходов производства – высокое содержание вредных компонентов. Следствие – загрязнение почвы, воды, воздуха.
Влияние на экологию
Особо опасные загрязнители биосферы – именно тяжелые металлы. Самая вредная форма соединений – соли.
Пути поступления
Загрязнение биосферы происходит следующими способами:
- Металлургия. Выбросы в процессе плавки, обжига. Вымывание тяжелых веществ из отвалов месторождений либо меткомбинатов водой, выветривание.
- Агросектор. Полив плантаций, удобрение полей илом бытовых стоков либо пестицидами.
- Быт. Использование как топлива торфа, угля, другого сырья.
- Автобаны. Свинцом, цинком, кадмием насыщены обочины автострад.
Свинец пропитывает почву минимум на 100 м по обе стороны дороги.

Свинец
Способы очищения
Почва очищается от такого груза десятилетиями, иногда столетиями.
Концентрация цинка уменьшается наполовину спустя столетие, кадмию требуется вдвое меньше.
Медь исчезает через три столетия, свинец – через десять:
- Токсичные соединения растворяются в воде.
- В почве процесс активируют влажность и растительность.
Флора вытягивает «свои» металлы. Так, лишайники «кушают» цинк, никель, медь.
Токсичность тяжелых металлов возрастает с увеличением атомного номера.
Воздействие на человека
Влияние большинства таких веществ двояко:
- Микродозы цинка, железа, меди задействованы в биологических процессах. Например, поддержании уровня гемоглобина в крови.
- Превышение микродоз опасно: тормозится работа нервной системы, сердца, почек, других органов. Разрушается скелет, идет разбалансировка жизненных процессов.
- Токсичны бесполезные свинец, ртуть.
Отравление организма внешне проявляется как тошнота, рвота, головная боль, нарушение координации движений. Плюс более тяжелые последствия, до летального исхода.
В зоне риска следующие категории:
- Работники меткомбинатов.
- Жители мегаполисов, окрестностей автострад.
- Потребители продуктов со стихийных рынков (не прошедших санитарный контроль).
Уровень загрязненности территории экологи определяют благодаря местным животным.
Чуткие «индикаторы» загрязненности на европейской части – лоси, мышь-полевка, кроты, бурый мишка.
14 различных типов металлов

Термин "металл" происходит от греческого слова "metalléuō", что означает выкапываю или добываю из земли. Наша планета содержит много металла. На самом деле из 118 элементов периодической системы порядка 95 являются металлами.
Это число не является точным, потому что граница между металлами и неметаллами довольно расплывчата: нет стандартного определения металлоида, как нет и полного согласия относительно элементов, соответствующим образом классифицированных как таковые.
Сегодня мы используем различные виды металлов, даже не замечая их. Начиная с зажимов в сантехнике и заканчивая устройством, которое вы используете для чтения этой статьи, все они сделаны из определенных металлов. Фактически, некоторые металлические элементы необходимы для биологических функций, таких как приток кислорода и передача нервных импульсов. Некоторые из них также широко используются в медицине в виде антацидов.
Все металлы в периодической таблице можно классифицировать по их химическим или физическим свойствам. Ниже мы перечислили некоторые различные типы металлов вместе с их реальным применением.
Классификация по физическим свойствам
14. Легкие металлы

Сплав титана 6AL-4V
Примеры: Алюминий, титан, магний
Легкие металлы имеют относительно низкую плотность. Формального определения или критериев для идентификации этих металлов нет, но твердые элементы с плотностью ниже 5 г/см³ обычно считаются легкими металлами.
Металлургия легких металлов была впервые развита в середине 19 века. Хотя большинство из них происходит естественным путем, значительная их часть образуется при электротермии и электролизе плавленых солей.
Их сплавы широко используются в авиационной промышленности благодаря их низкой плотности и достаточным механическим свойствам. Например, сплав титана 6AL-4V составляет почти 50 процентов всех сплавов, используемых в авиастроении. Он используется для изготовления роторов, лопастей компрессоров, мотогондол, компонентов гидравлических систем.
13. Тяжелые металлы

Окисленные свинцовые конкреции и кубик размером 1 см3
Примеры: железо, медь, кобальт, галлий, олово, золото, платина.
Тяжелые металлы - это элементы с относительно высокой плотностью (обычно более 5 г/см³) и атомным весом. Они, как правило, менее реактивны и содержат гораздо меньше растворимых сульфидов и гидроксидов, чем более легкие металлы.
Эти металлы редки в земной коре, но они присутствуют в различных аспектах современной жизни. Они используются в солнечных батареях, сотовых телефонах, транспортных средствах, антисептиках и ускорителях частиц.
Тяжелые металлы часто смешиваются в окружающей среде из-за промышленной деятельности, ухудшая качество почвы, воды и воздуха, а затем вызывая проблемы со здоровьем у животных и растений. Выбросы транспортных средств, горнодобывающие и промышленные отходы, удобрения, свинцово-кислотные батареи и микропластики, плавающие в океанах, являются одними из наиболее распространенных источников тяжелых металлов в этом контексте.
12. Белый металл

Подшипники из белого металла
Примеры: Обычно изготавливается из олова, свинца, висмута, сурьмы, кадмия, цинка.
Белые металлы - это различные светлые сплавы, используемые в качестве основы для украшений или изделий из серебра. Например, многие сплавы на основе олова или свинца используются в ювелирных изделиях и подшипниках.
Белый металлический сплав изготавливается путем объединения определенных металлов в фиксированных пропорциях в соответствии с требованиями конечного продукта. Основной металл для ювелирных изделий, например, формуется, охлаждается, экстрагируется, а затем полируется, чтобы придать ему точную форму и блестящий вид.
Они также используются для изготовления тяжелых подшипников общего назначения, подшипников внутреннего сгорания среднего размера и электрических машин.
11. Хрупкий металл

Хрупкое разрушение чугуна
Примеры: сплавы углеродистой стали, чугуна и инструментальной стали.
Металл считается хрупким, если он твердый, но не может противостоять ударам или вибрации под нагрузкой. Такие металлы под воздействием напряжения ломаются без заметной пластической деформации. Они имеют низкую прочность на разрыв и часто издают щелкающий звук при поломке.
Многие стальные сплавы становятся хрупкими при низких температурах, в зависимости от их обработки и состава. Чугун, например, твердый, но хрупкий из-за высокого содержания углерода. Напротив, керамика и стекло гораздо более хрупки, чем металлы, из-за их ионных связей.
Галлий, висмут, хром, марганец и бериллий также хрупки. Они часто используются в различных гражданских и военных целях, связанных с высокими деформационными нагрузками. Чугун, устойчивый к повреждениям в результате окисления, используется в машинах, трубах и деталях автомобильной промышленности, таких как корпуса коробок передач и головки цилиндров.
10. Тугоплавкий металл
Микроскопическое изображение вольфрамовой нити в лампе накаливания
Примеры: молибден, вольфрам, тантал, рений, ниобий.
Тугоплавкие металлы имеют чрезвычайно высокие температуры плавления (более 2000 °С) и устойчивы к износу, деформации и коррозии. Они являются хорошими проводниками тепла и электричества и имеют высокую плотность.
Другой ключевой характеристикой является их термостойкость: они не расширяются и не растрескиваются при многократном нагревании и охлаждении. Однако они могут деформироваться при высоких нагрузках и окисляться при высоких температурах.
Благодаря своей прочности и твердости они идеально подходят для сверления и резки. Карбиды и сплавы тугоплавких металлов используются почти во всех отраслях промышленности, включая горнодобывающую, автомобильную, аэрокосмическую, химическую и ядерную.
Металлический вольфрам, например, используется в ламповых нитях. Сплавы рения используются в гироскопах и ядерных реакторах. А ниобиевые сплавы используются для форсунок жидкостных ракетных двигателей.
9. Черные и цветные металлы

Валы-шестерни из (черной) нержавеющей стали
Черные металлы: Сталь, чугун, сплавы железа.
Цветные металлы: Медь, алюминий, свинец, цинк, серебро, золото.
Термин "железо" происходит от латинского слова "Ferrum", что переводится как "железо". Таким образом, термин "черный металл" обычно означает "содержащий железо", тогда как "цветной металл" означает металлы и сплавы, которые не содержат достаточного количества железа.
Поскольку черные металлы могут иметь широкий спектр легирующих элементов, которые значительно изменяют их характеристики, очень трудно поместить свойства всех черных металлов под один зонт. Тем не менее некоторые обобщения могут быть сделаны, например, большинство черных металлов являются твердыми и магнитными.
Черные металлы используются для применения с высокой нагрузкой и низкой скоростью, в то время как цветные металлы предпочтительны для применения с высокой скоростью и нулевой нагрузкой для применения с низкой нагрузкой.
Сталь является наиболее распространенным черным металлом. Она составляет около 80% всего металлического материала благодаря своей доступности, высокой прочности, низкой стоимости, простоте изготовления и широкому спектру свойств. Она широко используется в строительстве и обрабатывающей промышленности. Фактически, рост производства стали показывает общее развитие промышленного мира.
8. Цветные и благородные металлы

Ассортимент благородных металлов
Цветные металлы: медь, алюминий, олово, никель, цинк
Благородные металлы: родий, ртуть, серебро, рутений, осмий, иридий
Цветные металлы - это обычные и недорогие металлы, которые корродируют, окисляются или тускнеют быстрее, чем другие металлы, когда подвергаются воздействию воздуха или влаги. Они в изобилии встречаются в природе и легко добываются.
Они широко используются в промышленных и коммерческих целях и имеют неоценимое значение для мировой экономики благодаря своей полезности и повсеместности. Некоторые цветные металлы обладают отличительными характеристиками, которые не могут быть продублированы другими металлами. Например, цинк используется для гальванизации стали, чтобы защитить ее от коррозии, а никель - для изготовления нержавеющей стали.
Благородные металлы, с другой стороны, устойчивы к окислению и коррозии во влажном воздухе. Согласно атомной физике, благородные металлы имеют заполненный электрон d-диапазона. В соответствии с этим строгим определением, медь, серебро и золото являются благородными металлами.
Они находят применение в таких областях, как орнамент, металлургия и высокие технологии. Их точное использование варьируется от одного элемента к другому. Некоторые благородные металлы, такие как родий, используются в качестве катализаторов в химической и автомобильной промышленности.
7. Драгоценные металлы

Родий: 1 грамм порошка, 1 грамм прессованного цилиндра и 1 г аргонодуговой переплавленной гранулы
Примеры: палладий, золото, платина, серебро, родий.
Драгоценные металлы считаются редкими и имеют высокую экономическую ценность. Химически они менее реакционноспособны, чем большинство элементов (включая благородные металлы). Они также пластичны и имеют высокий блеск.
Несколько веков назад эти металлы использовались в качестве валюты. Но сейчас они в основном рассматриваются как промышленные товары и инвестиции. Многие инвесторы покупают драгоценные металлы (в основном золото), чтобы диверсифицировать свои портфели или победить инфляцию.
Серебро - второй по популярности драгоценный металл для ювелирных изделий (после золота). Однако его значение выходит далеко за рамки красоты. Оно обладает исключительно высокой тепло- и электропроводностью и чрезвычайно низким контактным сопротивлением. Именно поэтому серебро широко используется в электронике, батареях и противомикробных препаратах.
Классификация по химическим свойствам
6. Щелочные металлы

Твердый металлический натрий
Примеры: натрий, калий, рубидий, литий, цезий и франций.
Щелочь относится к основной природе гидроксидов металлов. Когда эти металлы реагируют с водой, они образуют сильные основания, которые легко нейтрализуют кислоты.
Они настолько реактивны, что обычно встречаются в природе в слиянии с другими веществами. Карналлит (хлорид калия-магния) и сильвин (хлорид калия), например, растворимы в воде и, таким образом, легко извлекаются и очищаются. Нерастворимые в воде щелочи, такие, как фторид лития, также существуют в земной коре.
Одно из самых популярных применений щелочных металлов - использование цезия и рубидия в атомных часах, наиболее точных из известных эталонов времени и частоты. Литий используется в качестве анода в литиевых батареях, композиты калия используются в качестве удобрений, а ионы рубидия используются в фиолетовых фейерверках. Чистый металлический натрий широко используется в натриевых лампах, которые очень эффективно излучают свет.
5. Щелочноземельные металлы

Изумрудный кристалл, основной минерал бериллия.
Примеры: бериллий, кальций, магний, барий, стронций и радий.
Щелочноземельные металлы в стандартных условиях мягкие и серебристо-белые. Они имеют низкую плотность, температуру кипения и температуру плавления. Хотя они не так реакционноспособны, как щелочные металлы, они очень легко образуют связи с элементами. Как правило, они вступают в реакцию с галогенами, образуя галогениды щелочноземельных металлов.
Все они встречаются в земной коре, кроме радия, который является радиоактивным элементом. Радий уже распадался в ранней истории Земли из-за относительно короткого периода полураспада (1600 лет). Современные образцы поступают из цепочки распада урана и тория.
Щелочноземельные металлы имеют широкий спектр применения. Бериллий, например, используется в полупроводниках, теплопроводниках, электрических изоляторах и в военных целях. Магний часто сплавляют с цинком или алюминием для получения материалов со специфическими свойствами. Кальций в основном используется в качестве восстановителя, а барий используется в вакуумных трубках для удаления газов.
4. Переходные металлы
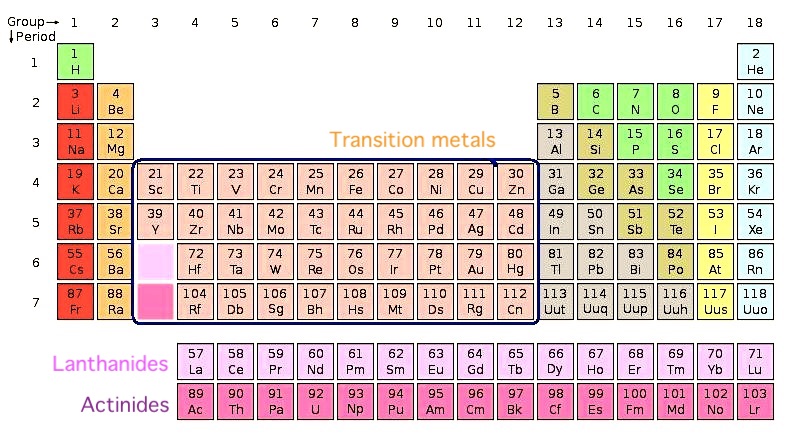
Примеры: титан, ванадий, хром, никель, серебро, вольфрам, платина, кобальт.
Большинство элементов используют электроны из своей внешней оболочки для связи с другими элементами. Переходные металлы, однако, могут использовать две крайние оболочки для соединения с другими элементами. Это химическая особенность, которая позволяет им связываться со многими различными элементами в различных формах.
Они занимают среднюю часть таблицы Менделеева, служа мостом между (или переходом) между двумя сторонами таблицы. Более конкретно, есть 38 переходных металлов в группах с 3 по 12 периодической таблицы. Все они являются пластичными, податливыми и хорошими проводниками тепла и электричества.
Многие из этих металлов, такие как медь, никель, железо и титан, используются в конструкциях и в электронике. Большинство из них образуют полезные сплавы друг с другом и с другими металлическими веществами. Некоторые из них, включая золото, серебро и платину, называются благородными металлами, потому что они крайне инертны и устойчивы к кислотам.
3. Постпереходные металлы

Висмут в виде синтетических кристаллов
Примеры: алюминий, галлий, олово, свинец, таллий, индий, висмут.
Постпереходные металлы в периодической таблице - это элементы, расположенные справа от переходных металлов и слева от металлоидов. Из-за своих свойств они также называются "бедными" или "другими" металлами.
Физически они хрупки (или мягки) и имеют более низкую температуру плавления и механическую прочность, чем переходные металлы. Их кристаллическая структура довольно сложна: они проявляют ковалентные или направленные эффекты связи.
Различные металлы этого семейства имеют различное применение. Алюминий, например, используется для изготовления оконных рам, кухонной посуды, банок, фольги, деталей автомобилей. Оловянные сплавы используются в мягких припоях, оловянных и сверхпроводящих магнитах.
Индиевые сплавы используются для изготовления плоских дисплеев и сенсорных экранов, а галлий - в топливных элементах и полупроводниках.
2. Лантаноиды

1-сантиметровый кусок чистого лантана
Примеры: лантан, церий, прометий, гадолиний, тербий, иттербий, лютеций.
Лантаноиды - это редкоземельные металлы с атомными номерами от 57 до 71. Впервые они были обнаружены в 1787 году в необычном черном минерале (гадолините), обнаруженном в Иттербю, Швеция. Позже минерал был разделен на различные элементы лантаноидов.
Лантаноиды - это металлы с высокой плотностью, плотность которых колеблется от 6,1 до 9,8 г/см³, и они, как правило, имеют очень высокие температуры кипения (1200-3500 °C) и очень высокие температуры плавления (800-1600 °C).
Сплавы лантаноидов используются в металлургии из-за их сильных восстановительных способностей. Около 15 000 тонн лантаноидов ежегодно расходуется в качестве катализаторов и при производстве стекол. Они также широко используются в лазерах и оптических усилителях.
Некоторые исследования показывают, что лантаноиды могут быть использованы в качестве противораковых средств. Лантан и церий, в частности, могут подавлять пролиферацию раковых клеток и способствовать цитотоксичности.
1. Актиниды

Металлический уран, высокообогащенный ураном-235
Примеры: актиний, уран, торий, плутоний, фермий, нобелий, лоренций
Подобно лантаноидам, актиниды образуют семейство редкоземельных элементов с аналогичными свойствами. Они представляют собой серию из 15 последовательных химических элементов в периодической системе от атомных номеров 89 до 103.
Все они радиоактивны по своей природе. Синтетически произведенный плутоний, а также природные уран и торий являются наиболее распространенными актинидами на Земле. Первым актинидом, который был открыт в 1789 году, был уран. И большая часть существующих продуктов актинидов была произведена в 20 веке.
Их свойства, такие как излучение радиоактивности, пирофорность, токсичность и ядерная критичность, делают их опасными для обращения. Сегодня значительная часть (кратковременных) актинидов производится ускорителями частиц в исследовательских целях.
Некоторые актиниды нашли применение в повседневной жизни, например, газовые баллоны (торий) и детекторы дыма (америций), большинство из них используются в качестве топлива в ядерных реакторах и для изготовления ядерного оружия. Уран-235 является наиболее важным изотопом для применения в ядерной энергетике, который широко используется в тепловых реакторах.
Читайте также:
