Металлическая связь обеспечивает электро и теплопроводность
Обновлено: 11.05.2024
Механизм образования металлической химической связи. Для атомов металлов характерны некоторые отличительные особенности строения. Первая: они, как правило, имеют 1—3 электрона на внешнем энергетическом уровне. Однако у атомов олова и свинца валентных электронов 4, у сурьмы и висмута — 5, а у полония — 6. Почему же эти элементы являются металлами? Ответ получим, зная о второй особенности строения атомов металлов — у них сравнительно большой радиус. Поэтому валентные электроны притягиваются к положительному ядру слабее и легко отрываются от атома.
Атом, от которого «ушли» электроны, превращается в ион. В результате этого в металлическом изделии или кусочке металла формируется совокупность свободных электронов, которые непрерывно перемещаются между ионами. При этом, притягиваясь к положительным ионам металла, электроны вновь превращают их в атомы, затем снова отрываются, превращая в ионы, и так бесконечно. Следовательно, в металлах происходит непрерывный процесс превращения «атомТо же самое наблюдается и в металлических сплавах.
Эта связь определяет особое кристаллическое строение металлов и сплавов — металлическую кристаллическую решётку, в узлах которой расположены атом-ионы.
Наиболее характерные свойства металлов. Такие свойства металлов, как пластичность, ковкость, электро- и теплопроводность, металлический блеск, способность к образованию сплавов, обусловлены именно металлической кристаллической решёткой и металлической связью.
Пластичность — важнейшее свойство металлов, выражающееся в их способности деформироваться под воздействием механической нагрузки. Это свойство лежит в основе обработки металла давлением (ковка, прокатка и др.), протягивании его в проволоку и т. п.
Пластичность металла объясняется тем, что под внешним воздействием одни слои атом-ионов в кристаллах легко смещаются, как бы скользят относительно друг друга без разрыва связи между ними.
Наиболее пластичны золото, серебро и медь. Недаром для своего знаменитого опыта, позволившего создать планетарную модель атома, Э. Резерфорд использовал именно золото, из которого была изготовлена фольга толщиной всего 0,003 мм. Такие же тонкие листочки фольги используются для золочения художественных изделий, например деревянной резьбы. Потрясает воображение сиянием золота декор залов Петергофского дворца (рис. 17) под Санкт-Петербургом и резной золочёный деревянный алтарь Успенского собора во Владимире.

Рис. 17. Золочёная резьба по дереву — основной элемент декора аудиенц-зала Большого Петергофского дворца. 1714—1755
Замечательные изделия из золота дошли до нас через тысячелетия (рис. 18).

Рис. 18. Так называемая золотая маска Агамемнона (XIV в. до н. э.), найденная Г. Шлиманом при раскопках в Микенах
Высокая электропроводность металлов объясняется наличием в них подвижных электронов, которые под действием электрического поля начинают двигаться направленно. Лучшими проводниками электрического тока являются золото, серебро и медь, немного уступает им алюминий. Однако в большинстве стран провода и кабели делают в основном не из меди, а из более дешёвого алюминия. Хуже всего электрический ток проводят марганец, свинец, ртуть, вольфрам и некоторые другие тугоплавкие металлы.
Теплопроводность металлов также объясняется высокой подвижностью электронов, которые, сталкиваясь с колеблющимися в узлах решётки ионами металлов, обмениваются с ними тепловой энергией. С повышением температуры эти колебания ионов с помощью электронов передаются другим ионам, и температура металла быстро выравнивается. О практическом значении этого свойства вы можете судить по равномерному нагреванию кухонной металлической посуды.
Гладкая поверхность металла или металлического изделия характеризуется металлическим блеском, который является результатом отражения световых лучей. Высокой световой отражательной способностью обладают ртуть (её раньше использовали для изготовления знаменитых венецианских зеркал), серебро, палладий и алюминий. Последние три металла в настоящее время используются при производстве зеркал, прожекторов и фар.
В порошкообразном виде металлы теряют блеск, приобретая чёрную или серую окраску, и только магний и алюминий сохраняют его. Поэтому из алюминиевой пыли делают краску серебрянку для декоративных покрытий.
Большинство металлов имеет серебристобелый цвет, золото и медь — соответственно жёлтый (червонный) или красно-жёлтый (медный) цвет (рис. 19).


Рис. 19. Самородки: а — золота; б — меди; в — серебра
Металлы также классифицируются в зависимости от своей плотности, температуры плавления и твёрдости. Все металлы при обычных условиях — твёрдые вещества. Исключение составляет жидкая ртуть. Наиболее твёрдые — металлы побочной подгруппы VI группы (так, хром по твёрдости приближается к алмазу). Самые мягкие — щелочные металлы, натрий и калий, например, легко режутся ножом.
По плотности металлы делят на лёгкие (плотность меньше 5 г/см 3 ) и тяжёлые (плотность больше 5 г/см 3 ). К лёгким относят щелочные, щёлочноземельные металлы и алюминий, из металлов побочных подгрупп — скандий, иттрий и титан. Эти металлы благодаря легкоплавкости и тугоплавкости всё шире применяют в различных областях техники.
Самый лёгкий металл — литий, плотность которого 0,53 г/см 3 , самый тяжёлый — осмий с плотностью 22,6 г/см 3 .
Лёгкие металлы обычно легкоплавки (галлий может плавиться уже на ладони руки), а тяжёлые металлы — тугоплавки. Наибольшая температура плавления — у вольфрама (+3422 °С). Это его свойство (так же как и огромное электрическое сопротивление) используют для изготовления ламп накаливания. Однако сейчас в Российской Федерации, как и ранее в Евросоюзе и США, на государственном уровне принято решение о замене привычных ламп накаливания на более экономичные и долговечные современные лампы — галогенные, люминесцентные и светодиодные. Галогенная лампа — это та же лампа накаливания с вольфрамовой нитью, но заполненная инертными газами с добавкой паров галогенов (брома и иода). Люминесцентные лампы — это хорошо знакомые вам лампы дневного света, имеющие один существенный недостаток: они содержат ртуть, а потому нуждаются в соблюдении особых правил утилизации на специальных пунктах приёма. Светодиодные лампы самые экономичные и самые долговечные (срок их работы — до 100 тыс. ч).
Металлические сплавы и области их применения. Металлическая химическая связь и металлическая кристаллическая решётка характерны не только для чистых металлов, но и для их сплавов. Это отличает металлические сплавы от неметаллических, как искусственных (стекла, керамики, фарфора, фаянса), так и природных (гнейсов, базальтов, гранитов и т. д.).
Ещё в глубокой древности люди заметили, что сплавы обладают другими, нередко более полезными свойствами, чем входящие в их состав чистые металлы. Поэтому металлы в чистом виде используются редко. Например, у первого полученного человеком сплава — бронзы — прочность выше, чем у её составляющих — меди и олова. Сталь и чугун прочнее чистого железа. Чистый алюминий — очень мягкий металл, сравнительно непрочный на разрыв. Но сплав, состоящий из алюминия, магния, марганца, меди, никеля, называемый дюралюминием, в 4 раза прочнее алюминия и используется в самолётостроении (рис. 20), а потому образно называется «крылатым» металлом.

Рис. 20. Один из самых больших пассажирских самолётов «Конкорд» — 20 тонн дюралюминия
Кроме большей прочности сплавы обладают и лучшими литейными свойствами, чем чистые металлы. Так, чистая медь очень плохо поддаётся литью, а оловянная бронза имеет прекрасные литейные качества — из неё отливают художественные изделия, памятники, которые требуют тонкой проработки деталей (рис. 21).

Рис. 21. Э. Фальконе. Медный всадник — памятник Петру I в Санкт-Петербурге. 1768—1770
Чугун — сплав железа с углеродом — также великолепный литейный материал (рис. 22).

Рис. 22. Чугунная решётка Летнего сада в Санкт-Петербурге, вы полненная по проекту архитекторов Ю. Фельтена, И. Фока и П. Егорова. 1771—1784
Кроме высоких механических качеств, сплавам присущи свойства, которых нет у чистых металлов. Например, нержавеющая сталь — сплав на основе железа — обладает высокой коррозионной стойкостью даже в агрессивных средах и высокой жаропрочностью.
Начавшаяся примерно 100 лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов и сплавов (рис. 23).

Рис. 23. Эйфелева башня в Париже, названная в честь своего конструктора Густава Эйфеля. 1887—1889
На основе вольфрама, молибдена, титана и других металлов начали создавать устойчивые к коррозии, сверхтвёрдые и тугоплавкие сплавы, применение которых значительно расширило возможности машиностроения. В ядерной и космической технике из сплава вольфрама и рения делают детали, выдерживающие температуру до +3000 °С (рис. 24). В медицине используют хирургические инструменты и имплантаты из сплавов тантала и платины.

Рис. 24. Космическая техника, при создании которой используются современные сплавы
В следующем параграфе познакомимся с молекулярно-кинетической теорией, рассмотрим различные агрегатные состояния вещества и взаимные переходы из одного состояния в другое.
Металлическая связь. Свойства металлической связи
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Когда два атома металла сближаются, орбитали их внешних оболочек перекрываются, образуя молекулярные орбитали. Если подходит третий атом, его орбиталь перекрывается с орбиталями первых двух атомов, что дает еще одну молекулярную орбиталь. Когда атомов много, возникает огромное число трехмерных молекулярных орбиталей, простирающихся во всех направлениях. Вследствие многократного перекрывания орбиталей валентные электроны каждого атома испытывают влияние многих атомов.
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt,Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей. Также важным свойством является металлическая ароматичность.
Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой – металлической связью.
Металлы в твердом состоянии существуют в виде кристаллов из положительных ионов, как бы “плавающих” в море свободно движущихся между ними электронов.
Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов.
Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в “ электронном море” по всему образцу с большой скоростью.
Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала: этот поток электронов, движущихся в одном направлении, и представляет собой всем знакомый электрический ток.
Металлическая связь
Теорию ионной связи предложил в 1916г. немецкий ученый В. Коссель. Эта теория объясняет образование связей между атомами типичных металлов и атомамитипичных неметаллов:CsF, CsCl, NaCl, KF, KCl, Na2O и др.
Согласно этой теории, при образовании ионной связи атомы типичных металлов отдают электроны, а атомы типичных неметаллов принимают электроны.
В результате этих процессов атомы металлов превращаются в положительно заряженные частицы, которые называются положительными ионами или катионами; а атомы неметаллов превращаются в отрицательные ионы — анионы. Заряд катиона равен числу отданных электронов.
Атомы металлов отдают электроны внешнего слоя, а образующиеся ионы имеют завершенные электронные структуры (предвнешнего электронного слоя).
Величина отрицательного заряда аниона равна числу принятых электронов.
Атомы неметаллов принимают такое количество электронов, какое им необходимо для завершения электронного октета (внешнего электронного слоя).
Например: общая схема образования молекулы NaCl из атомов Na и С1: Na°-le = Na +1 Образование ионов
Na +1 + Сl - = Nа + Сl -
Na°+ Сl°= Nа + Сl - Соединение ионов
· Связь между ионами называется ионной связью.
Соединения, которые состоят из ионов, называются ионными соединениями.
Алгебраическая сумма зарядов всех ионов в молекуле ионного соединения должна быть равна нулю,потому что любая молекула является электронейтральной частицей.
Резкой границы между ионной и ковалентнои связями не существует. Ионную связь можно рассматривать как крайний случай полярной ковалентнои связи, при образовании которой общая электронная пара полностьюсмещается к атому с большей электроотрицательностью.
Атомы большинства типичных металлов на внешнем электронном слое имеют небольшое число электронов (как правило, от 1 до 3); эти электроны называются валентными. В атомах металлов прочность связи валентных электронов с ядром невысокая, то есть атомы обладают низкой энергией ионизации. Это обусловливает легкость потери валентных электронов ч превращения атомов металла в положительно заряженные ионы (катионы):
В кристаллической структуре металла валентные электроны обладают способностью легко перемещаться от одного атома к другому, что приводит к обобществлению электронов всеми соседними атомами. Упрощенно строение кристалла металла представляется следующим образом: в узлах кристаллической решетки находятся ионы Ме п+ и атомы Ме°, а между ними относительно свободно перемещаются валентные электроны, осуществляя связь между всеми атомами и ионами металла (рис. 3). Это особый тип химической связи, называемой металлической.
· Металлическая связь — связь между атомами и ионами металлов в кристаллической решетке, осуществляемая обобществленными валентными электронами.
Благодаря этому типу химической связи металлы обладают определенным комплексом физических и химических свойств, отличающим их от неметаллов.
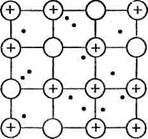
Рис. 3. Схема кристаллической решетки металлов.
Прочность металлической связи обеспечивает устойчивость кристаллической решетки и пластичность металлов (способность подвергаться разнообразной обработке без разрушения). Свободное передвижение валентных электронов позволяет металлам хорошо проводить электрический ток и тепло. Способность отражать световые волны (т.е. металлический блеск) также объясняется строением кристаллической решетки металла.
Таким образом, наиболее характерными физическими свойствами металлов в зависимости от наличия металлической связи являются:
■металлический блеск и непрозрачность;
■пластичность, ковкость, плавкость;
■высокие электро- и теплопроводность; и склонность к образованию сплавов.
Общие свойства металлов. Металлическая связь. Тепло- и электропроводность. Физико-механические и химические свойства металлов.
Общие свойства металлов. Физико-механические и химические свойства металлов.
Объясняются особым строением кристаллической решетки - наличием свободных электронов ("электронного газа").
- Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду Au,Ag,Cu,Sn,Pb,Zn,Fe уменьшается.
- Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света.
- Электропроводность.Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду Ag,Cu,Al,Fe уменьшается. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа".
- Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути.
- Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
- Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (r=0,53 г/см3); самый тяжелый – осмий (r=22,6 г/см3).
- Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -390C), самый тугоплавкий металл – вольфрам (t0пл. = 33900C).
Металлы с t0пл. выше 10000C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 – ne Men+
I. Реакции с неметаллами
С водородом (реагируют только щелочные и щелочноземельные металлы):
II. Реакции с кислотами
Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl MgCl2 + H2
2Al+ 6HCl 2AlCl3 + 3H2
6Na + 2H3PO4 2Na3PO4 + 3H2
Восстановление металлами кислот-окислителей смотри в разделах: "окислительно-восстановительные реакции", "серная кислота", "азотная кислота".
III. Взаимодействие с водой
Активные (щелочные и щелочноземельные металлы) образуют растворимое основание и водород:
2Na0 + 2H2O 2NaOH + H2
Ca0 + 2H2O Ca(OH)2 + H2
Металлы средней активности окисляются водой при нагревании до оксида:
Zn0 + H2O ZnO + H2
Неактивные (Au, Ag, Pt) - не реагируют.
Вытеснение более активными металлами менее активных металлов из растворов их солей:
Fe+ CuSO4 Cu + FeSO4
Металлическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве.
Металлическая связь отличается от ковалентной также и по прочности: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Энергия связи — энергия, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества. Энергии ковалентных и ионных связей обычно велики и составляют величины порядка 100-800 кДж/моль.
Теплопроводность Способность тела передавать теплоту от более нагретых его частей менее нагретым Ag, Cu, Au, Al, W, Fe
В ряду наблюдается уменьшение теплопроводности
Электропроводность Свойство вещества проводить электрический ток (обусловлено наличием в нем свободных электронов) Ag, Cu, Au, Al, W, Fe
В ряду наблюдается уменьшение электропроводности.
При нагревании электропроводность уменьшается, так как усиливается колебательное движение атомов и ионов в узлах решетки и затрудняется движение электронов -
§ 9. Физические свойства металлов
Из курса химии 8 класса вы уже имеете представление о природе химической связи, существующей в кристаллах металлов, — металлической связи. Напомним, что в узлах металлических кристаллических решёток располагаются атомы и положительные ионы металлов, связанные посредством обобществлённых внешних электронов, принадлежащих всему кристаллу. Эти электроны компенсируют силы электростатического отталкивания между положительными ионами и тем самым связывают их, обеспечивая устойчивость металлической решётки.
Металлическая связь обусловливает все важнейшие физические свойства металлов: пластичность, электро- и теплопроводность, металлический блеск и другие свойства, характерные для этого класса простых веществ.
Пластичность — это свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия.
Способность расплющиваться от удара или вытягиваться в проволоку под действием силы составляет важнейшее механическое свойство металлов. Оно лежит в основе такой уважаемой большинством народов мира профессии, как профессия кузнеца. Недаром покровителем кузнечного дела у разных народов был бог огня: у греков — Гефест, у римлян — Вулкан, у славян — Сварог.
Пластичность металлов обусловлена способностью одних слоёв атом-ионов в кристаллах под внешним воздействием легко смещаться (как бы скользить) по отношению к другим слоям без разрыва связей между ними (рис. 26).

Рис. 26.
Смещение слоёв в металлической кристаллической решётке при механическом воздействии
Наиболее пластичны золото, серебро и медь. Например, из золота можно изготовить «золотую фольгу» толщиной 0,003 мм, которую используют для золочения изделий (рис. 27).

Рис. 27.
Высокую пластичность золота используют для золочения интерьеров дворцов
Высокая электропроводность большинства металлов обусловлена присутствием в их кристаллических решётках подвижных электронов, которые направленно перемещаются под действием электрического поля (рис. 28).

Рис. 28.
В металлических кристаллических решётках подвижные электроны под действием электрического поля перемещаются, создавая электрический ток
При нагревании колебательные движения ионов в кристалле усиливаются, что затрудняет направленное движение электронов и ведёт к снижению электрической проводимости. При охлаждении электропроводность металлов увеличивается и вблизи абсолютного нуля переходит в сверхпроводимость. Наибольшую электропроводность имеют серебро и медь, наименьшую — марганец, свинец, ртуть и вольфрам.
Такое свойство, как теплопроводность металлов, также связано с высокой подвижностью свободных электронов: сталкиваясь с колеблющимися в узлах решётки ионами, электроны обмениваются с ними энергией. С повышением температуры колебания ионов при посредстве электронов передаются другим ионам, и температура всего металлического предмета быстро выравнивается.
Для гладкой поверхности металлов характерен металлический блеск — результат отражения световых лучей. В порошкообразном состоянии большинство металлов теряет блеск, приобретая чёрную или серую окраску, и только алюминий и магний сохраняют блеск в порошке. Из алюминия, серебра и палладия, обладающих наиболее высокой отражательной способностью, изготовляют зеркала, в том числе и применяемые в прожекторах.
Для большинства металлов характерен белый или серый цвет. Золото и медь окрашены соответственно в жёлтый и жёлто-красный цвет.
Из других физических свойств металлов наибольший практический интерес представляют твёрдость, плотность и температура плавления.
Для всех металлов (кроме ртути) при обычных условиях характерно твёрдое агрегатное состояние. Однако твёрдость их различна. Наиболее твёрдые — металлы побочной подгруппы VI группы (VIB группы) Периодической системы Д. И. Менделеева. Так, хром по твёрдости приближается к алмазу. Самые мягкие — металлы главной подгруппы I группы (IA группы) Периодической системы Д. И. Менделеева — щелочные металлы. Например, натрий и калий легко режутся ножом.
По плотности металлы делят на лёгкие (плотность меньше 5 г/см 3 ) и тяжёлые (плотность больше 5 г/см 3 ). К лёгким относят щелочные, щёлочноземельные металлы и алюминий. Из переходных металлов сюда включают скандий, иттрий и титан. Эти металлы, благодаря лёгкости и тугоплавкости, всё шире применяют в различных областях техники.
Самый лёгкий металл — это литий (р = 0,53 г/см 3 ). Самый тяжёлый — осмий (р = 22,6 г/см 3 ).
Лёгкие металлы обычно легкоплавки, галлий может плавиться уже на ладони руки, а тяжёлые металлы — тугоплавки. Наибольшей температурой плавления, которая равна 3380 °С, обладает вольфрам. Это свойство вольфрама используют для изготовления ламп накаливания (рис. 29, 1). Кроме него в конструкцию лампы входят ещё семь металлов.

Рис. 29.
Лампы, при изготовлении которых используют различные металлы: 1 — лампа накаливания; 2 — галогенная лампа; 3 — люминесцентная лампа; 4 — светодиодная лампа
В Российской Федерации в настоящее время, как и ранее в Евросоюзе и США, на государственном уровне принято решение о замене привычных ламп накаливания на более экономичные и долговечные современные лампы, например галогенные, люминесцентные и светодиодные. Галогенная лампа (рис. 29, 2) — это та же лампа накаливания с вольфрамовой нитью, заполненная инертными газами с добавкой паров галогенов (брома или иода). Люминесцентные (рис. 29, 3) — это хорошо знакомые вам лампы дневного света, имеющие один существенный недостаток — они содержат ртуть, а потому нуждаются в соблюдении особых правил утилизации на специальных пунктах приёма. Светодиодные лампы (рис. 29, 4) — самые экономичные и самые долговечные (срок работы до 100 тыс. ч), но пока и самые дорогие из ламп.

Рис. 30.
Металлы условно делят на две группы: чёрные (а — чугун; б — сталь); цветные (в — медь; г — алюминий)
В технике, как вы уже знаете, металлы делят на чёрные (железо и его сплавы) и цветные (все остальные, более подробно о них будет рассказано в следующем параграфе) (рис. 30). Золото, серебро, платину и некоторые другие металлы относят к драгоценным металлам (рис. 31).

Рис. 31.
Драгоценные металлы: золото (1, 2); платина (3); серебро (4, 5);
Читайте также:
