Металлы их положение в периодической системе химических элементов д и менделеева
Обновлено: 16.05.2024
2NaCl – расплав, электр. ток. → 2 Na + Cl2↑
CaCl2 – расплав, электр. ток. → Ca + Cl2↑
4NaOH – расплав, электр. ток. → 4Na + O2↑ + 2H2O
2. Восстановление металлов средней активности и неактивных металлов электролизом из растворов их солей.
- Олово образуется при электролизе раствора хлорида олова(II): Sn +2 Cl2 −1 → (электролиз) Sn 0 +Cl 0 2
- Алюминий в промышленности получают в результате электролиза расплава оксида алюминия в криолите Na3AlF6 (из бокситов): 2Al2O3 – расплав в криолите, электр. ток. → 4Al + 3O2↑
- Электролиз водных растворов солей используют для получения металлов средней активности и неактивных:2CuSO4+2H2O – раствор, электр. ток. → 2Cu + O2 + 2H2SO4
Электролиз используют для очистки металлов (электролитическое рафинирование).

Для рафинирования (очистки) металла электролизом из него отливают пластины и помещают их в качестве анодов 1 в электролизер 3. При пропускании тока металл, подлежащий очистке 1, подвергается анодному растворению, то есть переходит в раствор в виде катионов. Затем эти катионы металла разряжаются на катоде 2, благодаря чему образуется компактный осадок уже чистого металла. Примеси, находящиеся в аноде, либо остаются нерастворимыми 4, либо переходят в электролит и удаляются.
Большинство металлов переводят в слитки при помощи литья: расплавленный металл заливают в форму, где он и застывает. Однако наиболее тугоплавкие металлы, например, вольфрам, из которого делают нити накаливания элепктроламп, расплавить в печи необычайно трудно. Для получения их слитков применяют порошковую металлургию – особый метод, позволяющий избежать литья. Он основан на спекании предварительно спрессованного порошка металла при температуре выше 1000°C в атмосфере водорода. Затем через брусок из металла пропускают электрический ток, за счет чего он разогревается до температуры плавления, и при этом отдельные его зерна свариваются друг с другом. Полученное изделие подвергают горячей ковке и прокатке.
V. Нахождение металлов в природе
Самый распространённый в земной коре металл – алюминий. Металлы встречаются как в соединениях, так и в свободном виде.
1. Активные – в виде солей (сульфаты, нитраты, хлориды, карбонаты)
2. Средней активности – в виде оксидов, сульфидов (Fe3O4, FeS2)
3. Благородные – в свободном виде (Au, Pt, Ag)
В свободном состоянии присутствуют в природе металлы, которые либо плохо окисляются кислородом, либо совсем не окисляются. Например, платина, золото, серебро. Реже – медь, ртуть и некоторые другие. Самородные металлы встречаются в природе в небольших количествах в виде зерен или вкраплений в различных минералах. Лишь изредка они образуют большие куски – самородки. Самый большой самородок золота весил 112 кг. Иногда металлы практически в чистом виде содержатся в метеоритах. Так, некоторые предметы из высокочистого железа, найденные археологами, объясняются именно тем, что они были изготовлены из метеоритного железа. Но чаще всего металлы существуют в природе в связанном состоянии в составе минералов.
Минерал – это химически и физически индивидуализированный продукт природной физико-химической реакции, находящийся в кристаллическом состоянии.
Очень часто это оксиды. Например, оксид железа (III) Fe2O3 – гематит, или красный железняк. Рис. 1.
Fe3O4 – магнетит, или магнитный железняк. Нередко минералами являются сульфидные соединения: галенит ZnS, киноварь HgS.
Активные металлы часто присутствуют в природе в виде солей (сульфаты, нитраты, хлориды, карбонаты).
Минералы входят в состав горных пород и руд. Рудами называются природные образования, содержащие минералы в таком количестве, чтоб из этих руд было выгодно получать металлы. Обычно перед получением металла из руды руду обогащают, удаляя пустую породу и различные примеси. При этом образуется концентрат, который и является исходным сырьем для металлургической промышленности.
VI. Химические свойства металлов
Общие химические свойства металлов представлены в таблице:

Важно запомнить, что в химических реакциях металлы выступают в качестве восстановителей: отдают электроны и повышают свою степень окисления. Рассмотрим некоторые реакции, в которых участвуют металлы.
1. Взаимодействие с кислородом
Многие металлы могут вступать в реакцию с кислородом. Обычно продуктами этих реакций являются оксиды, но есть и исключения, о которых вы узнаете на следующем уроке. Рассмотрим взаимодействие магния с кислородом.
Магний горит в кислороде, при этом образуется оксид магния:
2Mg 0 + O2 0 = 2Mg +2 O -2
Рис. 1. Горение магния в кислороде
Атомы магния отдают свои внешние электроны атомам кислорода: два атома магния отдают по два электрона двум атомам кислорода. При этом магний выступает в роли восстановителя, а кислород – в роли окислителя.
Обратите внимание. Серебро, золото и платина с кислородом не реагируют.
2. Взаимодействие с галогенами, образуются галогениды
Для металлов характерна реакция с галогенами. Продуктом такой реакции является галогенид металла, например, хлорид.
Рис. 2. Горение калия в хлоре
Калий сгорает в хлоре образованием хлорида калия:
2К 0 + Cl2 0 = 2K +1 Cl -1
Два атома калия отдают молекуле хлора по одному электрону. Калий, повышая степень окисления, играет роль восстановителя, а хлор, понижая степень окисления,- роль окислителя
3. Взаимодействие с серой
Многие металлы реагируют с серой с образованием сульфидов. В этих реакциях металлы также выступают в роли восстановителей, тогда как сера будет окислителем. Сера в сульфидах находится в степени окисления -2, т.е. она понижает свою степень окисления с 0 до -2. Например, железо при нагревании реагирует с серой с образованием сульфида железа (II):
Fe 0 + S 0 = Fe +2 S -2
Рис. 3. Взаимодействие железа с серой
Металлы также могут реагировать с водородом, азотом и другими неметаллами при определенных условиях.
4. Взаимодействие с водой
Металлы по - разному реагируют с водой:
Помните.
Алюминий реагирует с водой подобно активным металлам, образуя основание:
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe3O4 и водород: 3Fe 0 +4H +1 2O −2 → Fe +2 O −2 ⋅Fe +3 2O −2 3 + 4H 0 2
5. Взаимодействие с кислотами
Металлы особо реагируют с серной концентрированной и азотной кислотами:
Металлы их положение в периодической системе химических элементов Д.И.Менделеева, строение их атомов, металлическая связь. Общие химические свойства металлов.
Известно, что от периода к периоду число металлов, составляющих главные подгруппы, увеличивается. Это связано с тем, что от периода к периоду радиус атома, как правило, увеличивается, поэтому внешние электроны становятся более свободными. Это в значительной степени и определяет, будет элемент металлом или нет. Например, во втором периоде имеется только два металла – литий и бериллий; в состав третьего периода входят три металла – натрий, магний и алюминий. Эту закономерность среди элементов главных подгрупп можно продолжить.
Кроме того, все элементы побочных подгрупп – металлы, они имеют на внешнем слое, как правило, 1-2 электрона, это во многом определяет их свойства.
У металлов главных подгрупп, как правило, на внешнем слое может быть от одного до трёх электронов, однако некоторые из них могут иметь существенно большее число электронов. Например, элемент полоний на внешнем слое имеет шесть электронов. Но этот элемент принадлежит (IV) периоду. Поэтому свойства простого вещества полония сильно отличаются от свойств, например, кислорода или серы, хотя они представители одной подгруппы.
Лёгкость выхода внешних электронов из атомов металлов определяет их свойства как восстановителей. Восстановители – это элементы, повышающие свою степень окисления в процессе реакции. Это происходит, в следствие отдачи электронов окислителям.
Восстановительные свойства металлов проявляются в следующих реакциях:
а) с неметаллами
в данной реакции металл Fe восстановитель, а катион Cu 2+ окислитель.
Электрохимический ряд напряжения металлов. Вытеснение металлов из растворов солей другими металлами.
- Общие свойства металлов как восстановителей.
- Характеристика активности металлов.
- Вытеснение металлов из растворов солей.
Общим свойством металлов является их способность к окислению: Ме 0 -ne - →Me n + . Способность отдавать электроны у металлов проявляется по-разному: наиболее активные щелочные металлы и кальций, они восстанавливают водород даже из воды:
К 0 -1е - →К +1 восстановитель
2Н +1 +2е - →Н2 0 окислитель
Менее активные восстановители – магний, алюминий, цинк и др., ещё менее активны железо, свинец: эти металлы восстанавливают водород из водных растворов кислот, а из растворов солей менее активных металлов – металл.
Zn 0 -2e - →Zn +2 восстановитель
Fe 0 -3e - →Fe +3 восстановитель.
Русский химик Н.Н.Бекетов расположил металлы в порядке убывания их восстановительной активности в водных растворах и назвал его электрохимический ряд напряжения металлов (приложение 5). При этом следует помнить следующее правила: каждый левее стоящий металл может вытеснять все последующие из водных растворов их солей, а сам вытесняется предыдущими металлами. В этом ряде следует обратить внимание на водород как единственный неметалл, имеющий с металлами общее свойство – способность образовывать положительно заряженные ионы. Поэтому водород может замещать некоторые металлы и сам замещаться активными металлами из водных растворов кислот и воды.
Вытеснение менее активных металлов из растворов их солей более активными металлами происходит в соответствии с рядом напряжения. Можно привести дополнительные примеры взаимодействия щелочных металлов с водой.
Металлы, их положение в периодической системе химических элементов Д.И. Менделеева, строение атома, химические свойства, применение.
В периодической системе элементов Д.И.Менделеева металлы расположены в левом нижнем углу от диагонали B–At.
Класс металлов образован элементами s-семейства (кроме Н и Не), p-элементы главных подгрупп III (кроме В), IV (Ge, Sn, Pb), V (Sb, Bi) и VI (Po), все d- и f-элементы. Элементы, расположенные вблизи диагонали (Be, Al, Ti, Ge), обладают двойственным характером. Металлов в периодической системе элементов – большинство (Из 109 элементов только 22 неметаллы).
На наружном электронном уровне находятся 1,2 или 3 электрона, слабо связанных с ядром.
2 8 1 2 8 8 2 2 8 3
1s 2 2s 2 2p 6 3s 1 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 1s 2 2s 2 2p 6 3s 3
В металлах связь металлическая и металлическая кристаллическая решётка чем объясняются физические свойства металлов.
Для главных подгрупп: чем левее и ниже металл, тем большую химическую активность он проявляет. В периодах металлические свойства убывают, а в группах усиливаются (с увеличением порядкового номера), так как изменяется радиус атома.
Для металлов характерны общие физические свойства:
1) твёрдость; 2) электро и теплопровдность; 3) непрозрачность; 4) металлический блеск;
5) ковкость или пластичность (объяснение – металлическая кристаллическая решётка).
Химические свойства: n=1,2,3. (металлы всегда восстановители)
I. С простыми веществами:
1) с кислородом:
а) 2Ca + O2 → 2CaO б) 2Mg + O2 2 ↛
в-ль ок-ль многие металлы покрыты тонкой плёнкой, которая препятствует дальнейшему окислению.
2) с галогенами:
а) 2Na + Cl2 → 2NaCl б) 2Fe + 3Cl23) с серой: Fe + S → FeS
II. Со сложными веществами (ряд активности металлов):
а) (для щелочных и щелочноземельных металлов) 2Na + 2H2O → 2NaOH + H2↑
б) металлы средней активности Mg + H2O 2↑
в) правее водорода Au + H2O ↛
2) с растворами кислот, кроме HNO3
а) Zn + 2HCl → ZnCl2 + H2 б) Cu + HCl ↛
3) с солями: Fe + CuSO4 → FeSO4 + Cu
1) в быту – посуда, бытовые приборы; 2) в технике, в промышленности;
3) в самолёто- и ракетостроении; 4) в медицине и т.д.
Билет №9 (2)
Фенол, его строение, свойства, получение и применение.
Фенол – это производное бензола, в котором один атом водорода замещён на группу ОН.
Взаимное влияние бензольного кольца и ОН-групп:
1) Радикал С6Н5 обладает свойством оттягивать на себя электроны атома кислорода ОН-группы, делая связь О–Н более полярной и атом водорода более подвижным.
2) ОН-группа придаёт большую подвижность атомам водорода в положениях 2,4,6 – бензольного кольца.
Этим взаимовлиянием и определяются свойства фенола.
Фенол – бесцветное, кристаллическое вещество с характерным запахом больницы.
Температура плавления 40,9℃ , хорошо растворим в горячей воде (карболовая кислота).
Фенол – ядовит!
1) В воде диссоциирует на ионы:
2) Проявляет слабые кислотные свойства, реагирует с металлами:
3) Реагирует со щёлочью:
4) Реакции замещения:
В промышленности фенол получают по схеме:
1) 2)
Фенол применяют для производства:
1) полимеров и пластмасс на их основе, красителей;
3) взрывчатых веществ. Водородный раствор фенола используется как дезинфицирующее средство.
Билет 21
1. Железо: положение в периодической системе химических элементов Д. И. Менделеева, строение атома, возможные степени окисления, физические свойства, взаимодействие с кислородом, галогенами, растворами кислот и солей. Роль железа в современной технике. Сплавы железа.
Железо находится в побочной подгруппе VIII группы периодической системы. Электронная формула атома железа:
Типичные степени окисления железа +2 и +3. Степень окисления +2 проявляется за счет потери двух 4s-электронов. Степень окисления +3 соответствует также при потере еще одного Зd-электрона, при этом Зd-уровень оказывается заполненным наполовину; такие электронные конфигурации относительно устойчивы.
Физические свойства. Железо – типичный металл, образует металлическую кристаллическую решетку. Железо проводит электрический ток, довольно тугоплавко, температура плавления 1539°С. От большинства других металлов железо отличается способностью намагничиваться.
Химические свойства. Железо реагирует со многими неметаллами:
Образуется железная окалина – смешанный оксид железа. Его формулу записывают также так: FeО•Fe2О3.
Реагирует с кислотами с выделением водорода:
Вступает в реакции замещения с солями металлов, расположенных правее железа в ряду напряжений:
Соединения железа. FeО — основной оксид, реагирует с растворами кислот с образованием солей железа (II). Fe2О3 — амфотерный оксид, реагирует также с рас творами щелочей.
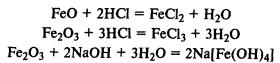
Гидроксиды железа. Fe(ОН)2 — типичный основной оксид, Fe(ОН)3 обладает амфотерными свойствами, реагирует не только с кислотами, но и с концентрированными растворами щелочей.
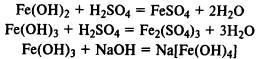
Гидроксид железа (II) легко окисляется до гидроксида железа (III) кислородом воздуха:
При реакции солей железа (II) и (III) со щелочами в осадок выпадают нерастворимые гидроксиды:
Сплавы железа. Современная металлургическая промышленность производит железные сплавы разнообразного состава.
Все железные сплавы разделяются по составу и свойствам на две группы. К первой группе относятся различные сорта чугуна, ко второй — различные сорта стали.
Чугун хрупок; стали же пластичны, их можно ковать, прокаты^ вать, волочить, штамповать. Различие в механических свойствах чугунов и сталей зависит прежде всего от содержания в них углерода — в чугунах содержится около 4% углерода, а в сталях — обычно менее 1,4%.
В современной металлургии из железных руд получают сначала чугун, а затем из чугуна — сталь. Чугун выплавляют в доменных печах, сталь варят в сталеплавильных печах. До 90% всего выплавленного чугуна перерабатывают в стали.
Чугун. Чугун, предназначенный для переработки в сталь, называют передельным чугуном. Он содержит от 3,9 до 4,3% С, 0,3—1,5% Si, 1,5—3,5% Мn, не более 0,3% Р и не более 0,07% S. Чугун, предназначенный'для получения отливок, называется литейным чугуном, В доменных печах выплавляются также ферросплавы, применяемые преимущественно в производстве сталей в качестве добавок. Ферросплавы имеют, по сравнению с передельным чугуном, повышенное содержание кремния (ферросилиций), марганца (ферромарганец), хрома (феррохром) и других элементов.
Стали. Все стали делятся на углеродистые и легированные.
Углеродистые стали содержат в несколько раз меньше углерода, кремния и марганца, чем чугун, а фосфора и серы совсем мало. Свойства углеродистой стали зависят прежде всего от содержания в ней углерода: чем больше в стали углерода, тем она твёрже. Промышленность производит мягкие стали, стали средней твёрдости и твёрдые. Мягкие стали и стали средней твёрдости применяются для изготовления деталей машин, труб, болтов, гвоздей и т. д., а твёрдые стали—для изготовления инструментов.
В сталях должно быть возможно меньше серы и фосфора, так как эти примеси ухудшают механические свойства сталей. В повышенных количествах сера вызывает красноломкость — образование трещин при горячей механической обработке металла. Фосфор вызывает хладноломкость—хрупкость стали при обыкновенной температуре. -
Легированные стали. Физические, химические и механические свойства сталей существенно изменяются от введения в их состав повышенного количества марганца и кремния, а также хрома, никеля, вольфрама и других элементов. Эти элементы называются легирующими, а стали — легированными [от латинского слова ligare – связывать, соединять].
Наиболее широко в качестве легирующего элемента применяется хром. Особенно большое значение для сооружения машин, аппаратов и многих деталей машин имеют хромоникелевые стали. Эти стали обладают высокой пластичностью, прочностью, жаростойкостью и стойкостью к действию окислителей. Азотная кислота любой концентрации не разрушает их даже при температурах кипения. Хромоникелевые стали не ржавеют в атмосферных условиях и в воде. Блестящие, серебристого цвета, листы хромоникелевой стали украшают арки станции «Маяковская» Московского метро. Из этой же стали делают нержавеющие ножи, ложки, вилки и другие предметы домашнего обихода.
Молибден и ванадий повышают твёрдость и прочность сталей при повышенных температурах и давлениях. Так,хромомолибденовые и хромованадиевые стали применяются для изготовления трубопроводов и деталей компрессоров в производстве синтетического аммиака, авиационных моторов.
При резании с большой скоростью инструмент сильно разогревается и быстро изнашивается. При добавлении вольфрама твёрдость стали сохраняется и при повышенных температурах. Поэтому хромовольфрамовые стали применяются для изготовления режущих инструментов, работающих при больших скоростях '
Увеличение содержания в стали марганца повышает её сопротивление трению и удару. Марганцовистые стали применяются для изготовления железнодорожных скатов, стрелок, крестовин, камнедробильных машин.
Применение легированных сталей позволяет значигельно снизить вес металлических конструкций, повысить их прочность, долговечность и надёжность в эксплуатации.
2. Белкикак биополимеры. Первичная, вторичная и третичная структуры белков. Свойства и биологические функции белков.
Белки (протеины, полипептиды) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот.
Белки, подобно полисахаридам, являются биологическими полимерами. Большинство белковых молекул достигает гигантских размеров по сравнению с другими органическими соединениями и имеет очень большую молекулярную массу:
Металлы их положение в периодической системе химических элементов д и менделеева
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
Элементы IA группы
В IA группу (главная подгруппа первой группы) таблицы Менделеева входят металлы — литий Li, натрий Na, калий К, рубидий Rb, цезий Cs и франций Fr. Традиционно, данные элементы называют щелочными металлами (ЩМ), так как их простые вещества образуют при взаимодействии с водой едкие щелочи. Последний из известных представителей группы щелочных металлов (Fr) является радиоактивным элементом, в связи с чем его химические свойства изучены недостаточно: период полураспада его наиболее долгоживущего изотопа 223 Fr составляет всего лишь около 22 мин.
Электронные формулы, а также некоторые свойства щелочных металлов представлены в таблице ниже:
| Свойство | Li | Na | К | Rb | Cs | Fr |
| Заряд ядра Z | 3 | 11 | 19 | 37 | 55 | 87 |
| Электронная конфигурация в основном состоянии | [He]2s1 | [Ne]3s1 | [Аr]4s1 | [Kr]5s1 | [Хе]6s1 | [Rn]7s1 |
| Металлический радиус rмет, нм | 0,152 | 0,186 | 0,227 | 0,248 | 0,265 | 0,270 |
| Ионный радиус rион*, нм | 0,074 | 0,102 | 0,138 | 0,149 | 0,170 | 0,180 |
| Радиус гидратированного иона,rион , нм | 0,340 | 0,276 | 0,232 | 0,228 | 0,228 | — |
| Энергия ионизации, кДж/моль: I1 I2 | 520,2 7298 | 495,8 4562 | 418,8 3052 | 403,0 2633 | 375,7 2234 | (380) (2100) |
| Электроотрицательность | 0,98 | 0,93 | 0,82 | 0,82 | 0,79 | 0,70 |
При движении вниз по IA группе возрастает радиус атомов металлов (rмет), что, собственно, характерно для любых элементов всех главных подгрупп. Относительно малое увеличение радиуса при переходе от K к Rb и далее к Cs обусловлено заполнением 3d- и 4d-подуровней соответственно.
Ионные радиусы ЩМ существенно меньше металлических, что связано с потерей единственного валентного электрона. Они также закономерно возрастают от Li + к Cs + . Размеры же гидратированных катионов изменяются в противоположном направлении, что объясняется в рамках простейшей электростатической модели. Наименьший по размеру ион Li + лучше катионов остальных щелочных металлов притягивает к себе полярные молекулы воды, образуя наиболее толстую гидратную оболочку. Исследования показали, что в водном растворе катион лития Li + окружен 26 молекулами воды, из которых только 4 находятся в непосредственном контакте с ионом лития (первой координационной сфере). По этой причине многие соли лития, например, хлорид, перхлорат и сульфат, а также гидроксид выделяются из водных растворов в виде кристаллогидратов. Хлорид LiCl·Н2O теряет воду при температуре 95 °С, LiOH·Н2O — при 110°С, а LiClO4·Н2O — только при температуре выше 150°С. С увеличением ионного радиуса катиона щелочного металла сила его электростатического взаимодействия с молекулами воды ослабевает, что приводит к снижению толщины гидратной оболочки и, как следствие, радиуса гидратированного иона [М(Н2O)n] (где n = 17, 11, 10, 10 для М + = Na + , К + , Rb + , Cs + соответственно).
Внешний энергетический уровень атома ЩМ содержит один единственный электрон, который слабо связан с ядром, о чем говорят низкие значения энергии ионизации I1. Атомы щелочных металлов легко ионизируются с образованием катионов М + , входящих в состав практически всех химических соединений этих элементов. Значения I2 для всех щелочных металлов настолько высоки, что в реально осуществимых условиях ион М 2+ не образуется. Электроотрицательность щелочных элементов мала, их соединения с наиболее электроотрицательными элементами (хлор, кислород, азот)имеют ионное строение, как минимум в кристаллическом состоянии.
Маленький радиус иона Li + и высокая плотность заряда, являются причиной того, что соединения лития оказываются схожими по свойствам аналогичным соединениям магния (диагональное сходство) и в то же время отличаются от соединений остальных ЩМ.
Элементы IIA группы
В IIA группу Периодической системы элементов входят бериллий Ве, магний Мg и четыре щелочноземельных металла (ЩЗМ): кальций Са, стронций Sr, барий Ва и радий Ra, оксиды которых, раньше называемые «землями», при взаимодействии с водой образуют щелочи. Радий — радиоактивный элемент (α-распад, период полураспада примерно 1600 лет).
Электронная конфигурация и некоторые свойства элементов второй группы приведены в таблице ниже.
По электронному строению атомов элементы второй группы близки щелочным металлам. Они имеют конфигурацию благородного газа, дополненную
| Свойство | Be | Mg | Ca | Sr | Ba | Ra |
| Заряд ядра Z | 4 | 12 | 20 | 38 | 56 | 88 |
| Электронная конфигурация в основном состоянии | [He]2s 2 | [Ne]3s 2 | [Ar]4s 2 | [Kr]5s 2 | [Xe]6s 2 | [Rn]7s 2 |
| Металлический радиус rмет, нм | 0,112 | 0,160 | 0,197 | 0,215 | 0,217 | 0,223 |
| Ионный радиус rион*, нм | 0,027 | 0,72 | 0,100 | 0,126 | 0,142 | 0,148 |
| Энергия ионизации, кДж/моль: |
двумя s-электронами на внешнем уровне. В то же время от элементов первой группы они отличаются более высокими значениями энергии ионизации, убывающими в ряду Ве—Мg—Са—Sr— Ва. Эта тенденция нарушается при переходе от бария к радию: повышениe П и І, для Rа по сравнению с Ва объясняется эффектом инертной 6s 2 -пары.
Следует отметить, что в то время как для щелочных металлов характерна значительная разница между I1 и I2 для элементов второй группы подобный скачок наблюдается между I2 и I3. Именно поэтому щелочные металлы в сложных веществах проявляют только степень окисления +1, а элементы второй группы +2. Наличие единственной положительной степени окисления и невозможность восстановления ионов M 2+ в водной среде придает большое сходство всем металлам s-блока.
Изменение свойств по группе следует общим закономерностям, рассмотренным на примере щелочных металлов. Элемент второго периода бериллий, подобно элементу первой группы литию, значительно отличается по своим свойствам от других элементов второй группы. Так, ион Be 2+ благодаря чрезвычайно малому ионному радиусу (0,027 нм), высокой плотности заряда, большим значениям энергий атомизации и ионизации оказывается устойчивым лишь в газовой фазе при высоких температурах. Поэтому химическая связь в бинарных соединениях бериллия даже с наиболее электроотрицательными элементами (кислород, фтором) обладает высокой долей ковалентности. Химия водных растворов бериллия также имеет свою специфику: в первой координационной сфере бериллия могут находиться лишь четыре лиганда ([Be(H2O)4] 2+ , (Bе(OH)4] — ), что связано с малым ионным радиусом металла и отсутствием d-орбиталей.
Щелочноземельные металлы (Са, Sr, Ва, Ra) образуют единое семейство элементов, в пределах которого некоторые свойства (энергия гидратации, растворимость и термическая устойчивость солей) меняются монотонно с увеличением ионного радиуса, а многие их соединения являются изоморфными.
Элементы IIIA группы
Элементы IIIA группы: бор В, алюминий Al, галлий Ga, индий In и таллий Tl — имеют мало стабильных изотопов, что характерно для атомов с нечетными порядковыми номерами. Электронная конфигурация внешнего энергетического уровня в основном состоянии ns 2 nр 1 характеризуется наличием одного неспаренного электрона. В возбужденном состоянии элементы IIIA группы содержат три неспаренных электрона, которые, находясь в sp 2 -гибридизации, принимают участие в образовании трех ковалентных связей. При этом у атомов остается одна незанятая орбиталь. Поэтому многие ковалентные соединения элементов IIIA группы являются акцепторами электронной пары (кислоты Льюиса), т.е. могут образовывать четвертую ковалентную связь по донорно-акцепторному механизму, создавая которую, они изменяют геометрию своего окружения — она из плоской становится тетраэдрической (состояние sp 3 -гибридизации). Бор сильно отличается по свойствам от других элементов IIIA группы. Он является единственным неметаллом, химически инертен и образует ковалентные связи со фтором, азотом, углеродом и т.д. Химия бора более близка химии кремния, в этом проявляется Диагональное сходство. У атомов алюминия и его тяжелых аналогов появляются вакантные d-орбитали, возрастает радиус атома. Галлий, индий и таллий расположены в Периодической системе сразу за металлами d-блока, поэтому их часто называют постпереходными элементами. Заполнение d-оболочки сопровождается последовательным сжатием атомов, в 3d-pяду оно оказывается настолько сильным, что нивелирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d-сжатия ионные радиусы алюминия и галлия близки, а атомный радиус галлия даже меньше, чем алюминия.
Для таллия, свинца, висмута и полония наиболее устойчивы соединения со степенью окисления +1, +2, +3, +4 соответственно.
| Свойство | B | Al | Ga | In | Tl |
| Заряд ядра Z | 5 | 13 | 31 | 49 | 81 |
| Электронная конфигурация в основном состоянии | [He]2s 2 2p 1 | [Ne]3s 2 3p 1 | [Ar]3d 10 4s 2 4p 1 | [Kr]4d 10 5s 2 5p 1 | [Xe]4f 14 5d 10 6s 2 6p 1 |
| Атомный радиус, нм | 0,083 | 0,143 | 0,122 | 0,163 | 0,170 |
| Энергия ионизации, кДж/моль: I1 I2 I3 | 801 2427 3660 | 577 1817 2745 | 579 1979 2963 | 558 1821 2704 | 589 1971 2878 |
| Электроотрицательность | 2,04 | 1,61 | 1,81 | 1,78 | 2,04 |
Для соединений элементов IIIA группы наиболее характерна степень окисления +3. В ряду бор-алюминий-галлий-индий-таллий устойчивость таких соединений уменьшается, а устойчивость соединений со степенью окисления +1, напротив, увеличивается. Энергия связи М—Hal в галогенидах последних при переходе от легких к более тяжелым элементам М уменьшаются, амфотерные свойства оксидов и гидроксидов смещаются в сторону большей основности, склонность катионов к гидролизу (взаимодействию с водой) ослабевает.
Химия индия и особенно галлия вообще очень близка химии алюминия. Соединения этих металлов в низших степенях окисления (Ga2O, Ga2S, InCl и др.) в водных растворах диспропорционируют. Для таллия состояние +1, напротив, является наиболее устойчивым из-за инертности электронной пары 6s 2 .
Читайте также:
