Мпг что за металл
Обновлено: 02.07.2024
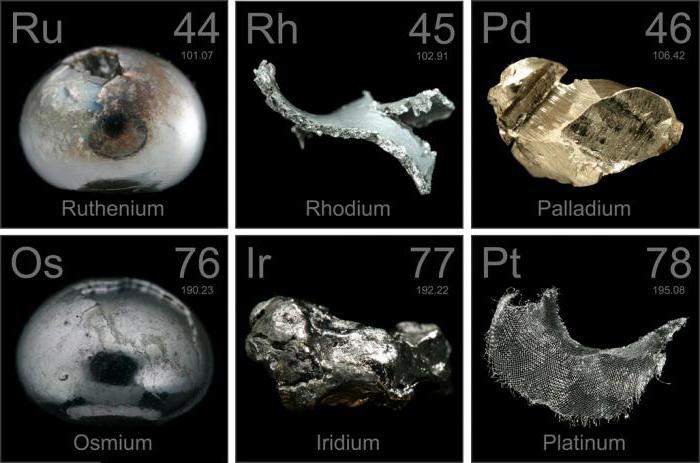
платиноиды, химические элементы второй и третьей триад VIII группы периодической системы Менделеева. К ним принадлежат: рутений (Ruthenium) Ru, родий (Rhodium) Rh, палладий (Palladium) Pd (лёгкие П. м., плотность Платиновые металлы12 г/см 3 ); осмий (Osmium) Os, иридий (Iridium) lr, платина (Platinum) Pt (тяжёлые П. м., плотность Платиновые металлы22 г/см 3 ). Серебристо-белые тугоплавкие металлы; благодаря красивому внешнему виду и высокой химической стойкости П. м. наряду с Ag и Au называют благородными металлами (См. Благородные металлы).
Историческая справка. Имеются указания, что самородная платина в древности была известна в Египте, Эфиопии, Греции и Южной Америке. В 16 в. исп. Конкистадоры обнаружили в Южной Америке вместе с самородным золотом очень тяжёлый белый тусклый металл, который не удавалось расплавить. Испанцы назвали его платиной — уменьшительным от исп. plata — серебро. В 1744 исп. морские офицер Антонио де Ульоа привёз образцы Pt в Лондон. Они вызвали живой интерес учёных Европы. Самостоятельным металлом Pt, которую первоначально считали белым золотом, была признана в середине 18 в.
В 1803 английский учёный У. Х. Волластон обнаружил в самородной платине палладий, получивший это название от малой планеты Паллады (открытой в 1802), и родий, названный так по розовато-красному цвету его солей (от греч. rhódon — роза). В 1804 английский химик Смитсон Теннант в остатке после растворения самородной Pt в царской водке открыл ещё 2 металла. Один из них получил название иридий вследствие разнообразия окраски его солей (от греч. íris, род. падеж íridos — радуга), другой был назван осмием по резкому запаху его четырёхокиси (от греч. osmá — запах). В 1844 К. К. Клаус при исследовании остатков от аффинажа (очистки) уральской самородной Pt в Петербургском монетном дворе открыл ещё один П. м. — рутений (от позднелат. Ruthenia — Россия).
Распространение в природе. П. м. принадлежат к наиболее редким элементам, их среднее содержание в земной коре (кларки) точно не установлено, ориентировочные значения приведены в таблице. Самые редкие в земной коре — Rh и lr (1․10 -7 % по массе), наиболее распространён Os (5․10 -6 %). Содержание П. м. повышено в ультраосновных и основных изверженных породах, происхождение которых связано с глубинными магматическими процессами. К этим породам приурочены месторождения П. м. Ещё выше среднее содержание П. м. в каменных метеоритах, которые считаются аналогами средней мантии Земли (кларки П. м. в каменных метеоритах составляют n․10 -4 — n․10 -5 % по массе). Для земной коры характерно самородное состояние П. м., а у Rh, Pd, Os и Pt известны также немногочисленные соединения с серой, мышьяком и сурьмой. Установлено около 30 минералов П. м., больше всего их у Pd (13) и Pt (9). Все минералы образовались на больших глубинах при высоких температурах и давлениях (см. Платиновые руды, Платина самородная). Платина и другие П. м. встречаются в виде примеси во многих сульфидах и силикатах ультраосновных и основных пород. Геохимия П. м. в биосфере почти не изучена, их содержание в гидросфере и живом веществе не установлено. Некоторые осадочные марганцевые руды обогащены Pt (до 1․10 -3 %), в углях наблюдалась концентрация Pt и Pd (1․10 -6 %); повышенное содержание П. м. отмечалось в фосфоритах (вятских), в золе деревьев, растущих на месторождениях Pt.
Физические и химические свойства. Физические и механические свойства П. м. сопоставлены в таблице. В дополнение необходимо указать, что Ru и Os очень тверды и хрупки (возможно вследствие присутствия примесей). Rh и lr обладают меньшими твёрдостью и хрупкостью, а Pd и Pt ковки, поддаются прокатке, волочению, штамповке при комнатной температуре. Интересна способность некоторых П. м. (Ru, Pd, Pt) поглощать водород. Особенно это свойственно Pd, объём которого поглощает до 900 объёмов H2. При этом Pd сохраняет металлический вид, но растрескивается и становится хрупким. Все П. м. парамагнитны. Магнитная восприимчивость χs․10 -6 электро-магнитных единиц при 18 °С равна 0,05 у Os; 0,50 у Ru; 5,4 у Pd; у Rh, lr и Pt она несколько более 1,0.
Согласно давно установившейся традиции, П. м. принято помещать в VIII группу периодической системы элементов (См. Периодическая система элементов). В соответствии с этим следовало ожидать, что все П. м. должны иметь высшую степень окисления +8. Однако это наблюдается только у Ru и Os, прочие же П. м. проявляют валентность не выше +6. Объясняется это тем, что у атомов Ru и Os остаются незаполненными соответственно внутренние подуровни 4f и 5f. Поэтому для атомов Ru и Os возможно возбуждение не только с подуровней 5s и 6s на подуровни 5p и 6p, но и с подуровней 4d и 5d на подуровни 4f и 5f. Вследствие этого в атомах Ru и Os появляется по 8 непарных электронов и валентность +8. Электронные конфигурации атомов Rh, lr, Pd, Pt такой возможности не допускают. Поэтому в некоторых вариантах таблицы Менделеева эти элементы (а также Со и Ni) выносят за пределы VIII группы. Все П. м. легко образуют Комплексные соединения, в которых имеют различные степени окисления и различные координационные числа. Комплексные соединения П. м., как правило, окрашены и очень прочны.
Химические свойства П. м. имеют много общего. Все они в компактном виде (кроме Os) малоактивны. Однако в виде т. н. черни (мелкодисперсного порошка) П. м. легко адсорбируют S, галогены и др. неметаллы. (Чернь обычно получают восстановлением П. м. из водных растворов их соединений.) Компактные Ru, Rh, Os, lr, будучи сплавлены с Pt, Zn, Pb, Bi, переходят в раствор при действии царской водки, хотя она не действует на эти П. м., взятые отдельно.
Семейство П. м. можно разделить на 3 диады (двойки), образованные двумя стоящими один под другим лёгким и тяжёлым П. м., а именно: Ru, Os; Rh, lr; Pd, Pt.
При нагревании с O2 и сильными окислителями Ru и Os образуют легкоплавкие кристаллы — четырёхокиси (тетроксиды) — оранжевую RuO4 и желтоватую OsO4. Оба соединения летучи, пары их имеют неприятный запах и весьма ядовиты. При действии восстановителей превращаются в низшие окислы RuO2 и OsO2 или в металлы. Со щелочами RuO4 образует рутенаты, например рутенат калия K2RuO по реакции:
Четырёхокись OsO4 даёт с KOH комплексное соединение K2[OsO4(OH)2]. С фтором и др. галогенами Ru и Os легко реагируют при нагревании, образуя соединения типа RuF3, RuF4, RuF5, RuF6. Осмий даёт подобные же соединения, кроме OsF3; существование OsF8 не подтверждено. Весьма интересны комплексные соединения Ru с Ксеноном Xe [RuF6] (канадский химик Н. Бартлетт, 1962), а также с молекулярным азотом — [(NO)(NH3)4 N2Ru (NH3)4 NO] CI (советский химик Н. М. Синицын, 1962) и [Ru (NH3)5N2] Cl2 (канадский химик А. Аллен, 1965).
На компактные Rh и lr царская водка не действует. При прокаливании в O2 образуются окислы Rh2O3 и Ir2O3, разлагающиеся при высоких температурах.
Pd легко растворяется при нагревании в HNO3 и концентрированной H2SO4 с образованием нитрата Pd (NO3)2 и сульфата PdSO4. На Pt эти кислоты не действуют. Царская водка растворяет Pd и Pt, причём образуются комплексные кислоты — тетрахлоропалладиевая кислота H2[PdCl4] и гексахлороплатиновая — коричнево-красные кристаллы состава H2[PtCl6]․6H2O Из её солей наибольшее значение для технологии П. м. имеет хлороплатинат аммония (NH4)2[PtCl6] — светло-жёлтые кристаллы, малорастворимые в воде и почти не растворимые в концентрированных растворах NH4CI. При прокаливании они разлагаются по реакции:
Получение. Разделение П. м. и получение их в чистом виде очень сложно вследствие большого сходства их химических свойств; это требует большой затраты труда, времени, дорогих реактивов. Для получения чистой Pt исходные материалы — самородную платину, платиновые шлихи (тяжёлые остатки от промывки платиноносных песков), лом (негодные для употребления изделия из Pt и её сплавов) обрабатывают царской водкой при подогревании. В раствор переходят: Pt, Pd, частично Rh, lr в виде комплексных соединений H2[PtCl6], H2[PdCl4], Нз [RhCl6] и H2[IrCl6], а также Fe и Cu в виде FeClз и CuCl2. Нерастворимый в царской водке остаток состоит из осмистого иридия, хромистого железняка (FeCrO2), кварца и др. минералов.
Из раствора осаждают Pt в виде (NH4)2[PtCl6] хлористым аммонием. Но чтобы в осадок вместе с Pt не выпал lr в виде аналогичного нерастворимого соединения (NH4)2[lrCl6] (остальные П. м. NH4Cl не осаждает), предварительно восстанавливают Ir (+4) до Ir (+3) (например, прибавлением сахара C12H22O11 по способу И. И. Черняева). Соединение (NH4)3[IrCl6] растворимо и не загрязняет осадка.
Хлороплатинат аммония отфильтровывают, промывают концентрированным раствором NH4CI (в котором осадок практически не растворим), высушивают и прокаливают. Полученную губчатую платину спрессовывают, а затем оплавляют в кислородно-водородном пламени или в электрической печи высокой частоты. Из фильтрата, оставшегося после осаждения (NH4)2[PtCl6], и из осмистого иридия извлекают прочие П. м. путём сложных химических операций. В частности, для перевода в растворимое состояние нерастворимых в царской водке П. м. и осмистого иридия используют спекание с перекисями BaO2 или Na2O2. Применяют также хлорирование — нагревание смеси Pt-концентратов с NaCl и NaOH в струе хлора.
В результате аффинажа получают труднорастворимые комплексные соединения: гексахлорорутенат аммония (NH4)3[RuCl6], дихлорид тетрамминдиоксоосмия [OsO2(NH3)4] Cl2, хлорпентамминдихлорид родия [Rh (NH3)5CI] Cl2, гексахлороиридат аммония (NH4)2[lrCl6] и дихлордиаммин палладия [Pd (NH3)2] Cl2. Прокаливанием перечисленных соединений в атмосфере H2 получают П. м. в виде губки, например
Основным источником получения П. м. служат сульфидные медно-никелевые руды, месторождения которых находятся в СССР (Норильск, Красноярский край), Канаде (округ Садбери, провинция Онтарио), ЮАР и др. странах. В результате сложной металлургической переработки этих руд благородные металлы переходят в т. н. черновые металлы — нечистые Никель и Медь. П. м. собираются почти полностью в черновом Ni, a Ag и Au — в черновой Cu. При последующем электролитическом рафинировании Ag, Au и П. м. осаждаются на дне электролитической ванны в виде шлама, который отправляют на аффинаж.
Металлы платиновой группы (МПГ)
- Платина.
- Палладий.
- Родий.
- Рутений.
- Иридий.
- Осмий.
Главными особенностями металлов платиновой группы, являются:
- серебристо-серый оттенок, кроме осмия (бело-голубой);
- кристаллические свойства, способствующие ускорению химических процессов;
- катализаторы, контролирующие скорость окисления, реакции гидрирования;
- химически стойкие металлы по отношению к действию многих реагентов;
- обладают высокой электропроводностью;
- выдерживают высокие температуры;
- тугоплавкость.
Основными источниками платиновых металлов являются минералы редких элементов. Сегодня драгоценные платиновые металлы используют в ювелирном производстве, но в разной степени, а биологически активные соединения платиновых металлов в медицине.
Платина
Платина известна издревле, а название произошло с испанского языка: «маленькое серебро». Конкистадоры, это первые европейцы, которые познакомились с платиной в середине 16 века в Южной Америке. А в 1735 году король Испании издал указ, по которому следовало топить платину в реке и не ввозить в страну. Позже речку назвали Платино-дель-Пинто. Указ был отменен только через сорок лет, для фальсифицирования золотых и серебряных монет мадридскими властями. Позже с платиной познакомились алхимики, но посчитали ее непригодной. Но во Франции она все же нашла свое применение в виде эталона метра, а затем килограмма. В России металл назвали белым золотом, найдя его в россыпном золоте.
Платина, это один из редчайших металлов, ведь в земной коре ее содержания невелико. Главными месторождениями платины являются: Россия, США (2 крупных рудника: Stillwater, East Bouder), Китай, Зимбабве (9 тонн), ЮАР (Бушвельский комплекс).
В России данный металл МПГ обладает уникальной базой, с огромным количеством месторождений, основной из которых расположен в Зареченске (Мурманской области).
Добыча платины это трудоемкий процесс, двух видов:
- Открытый способ добычи: на вторичных россыпных месторождениях. Там платина концентрируется в результате разрушений первичной породы.
- Закрытый способ добычи: на первичных месторождениях, с постройкой шахт, просверливанием отверстий в породах, закладке взрывчатки и самого взрыва.
Платина это драгоценный металл, который используют в ювелирном деле и промышленности. Свойства платины широки:
- тяжелее, чем золото и серебро;
- не окисляется;
- не вступает в реакции с другими элементами при нагреве;
- пластичный металл;
- обладает хорошей электропроводностью;
- не растворяется под воздействием кислот;
- высокая температура плавления;
- хорошая ковкость.
Область применения платины достаточно широкое и не ограничивается ювелирным производством, ведь она обладает уникальной красотой и благородством. В настоящее время рост на металл растет, так как используют ее и в промышленности. Итак, применения платины:
- ювелирное производство, для изготовления разного вида украшений;
- медицина;
- химическая индустрия;
- судостроение;
- авиастроение;
- космическая сфера;
- стекольная отрасль;
- банковское дело.
Палладий
На сегодня, палладий самый дорогой металл платиновой группы, который используется в промышленности.
В конце 17 века бразильские горнодобывающие рабочие нашли сплав, похожий на содержание золота или платины. Химик У. Волластон проработал взаимодействие неочищенной платиной с соляной и азотной кислотами, и добавкой цианида ртути. После выпал желтый осадок, который он нагрел с серой и бурой. Получив шарики из металла и, назвав металл - палладий.
Название металл получил в честь астероида. Этот металл платиновой группы встречается в природе очень редко в чистом в виде. А чаще в комплексе с другими металлами (золото, серебро, платина).
Добывают металл также двумя способами:
- на коренных (первичных) месторождениях;
- на россыпи, в виде самородка и составляют всего 2% от всей добычи металла.
Главные месторождения палладия:
В России также происходит добыча палладия, сконцентрированная на Урале. Главными свойствами палладия являются:
- низкая плотность;
- химическая инертность;
- внешне напоминает серебро;
- высокая ковкость;
- эластичность, что позволяет использовать в изготовлении украшений;
- температура плавления 1555 градусов;
- поддается обработке;
- непрочный металл при механическом воздействии;
- растворяется при воздействии смеси серной и азотной кислот;
- может образовывать соединения с иными химическими элементами ( бор, хлор, сера, кремний);
- не вступает в реакции;
- не окисляется в природе.
Области применения палладия
- Ювелирная сфера, добавляя металл в сплавы;
- производство катализаторов для автомобилей, для дожигания выхлопных газов по нормам ЕС;
- медицина: изготовление элементов для кардиостимуляторов, инструментов, посуды;
- химическая отрасль: изготавливают колбы и емкости, а также для очищения водорода;
- электронная сфера: военно-аэрокосмическая техника;
- инвестиционная деятельность: покупка слитков.
Родий
Следом за открытием палладия, Волластон открыл еще один металл платиновой группы - родий, путем растворения неочищенной платины в царской водке (смесь соляной и азотной кислот) и нейтрализации избытка кислоты едким натром. Осадив платину хлористым аммонием, палладий - цианистой ртутью. Полученный фильтрат был обработан соляной кислотой (чтобы удалить избыток цианистой ртути) и выпарен до сухого состояния. А осадок, обработанный алкоголем, выглядел как темно-красный порошок двойной натриевородиевой соли соляной кислоты. А уже в свою очередь при прокаливании порошка в токе водорода, получил металл.
Родий получил свое название с греческого языка: роза. Добыча родия производится вместе с платиной/золотом. Основными источниками родия являются золотые месторождения Мексики, залежи родиевого Невьянскита.
Родий представляет собой металл серебристо-белого оттенка и относится к благородным металлам платиновой группы.
Свойства родия
- Растворяется в перекиси водорода, серной кислоте;
- растворяется при кипячении в смеси соляной и азотной кислот;
- высокая химическая устойчивость;
- взаимодействует с неметаллами лишь при температуре красного каления;
- окисление происходит при высокой температуре;
- стойкий металл к коррозийным средам.
Так как родий, это драгоценный и уникальный металл, то и область его применения различна:
- в качестве катализатора (каталитических фильтрах для нейтрализации выхлопных газов);
- является конструкционным материалом, для изготовления зеркал, стекол;
- при сплаве родия с платиной, получается эффективный катализатор при производстве азотной кислоты по средствам окисления аммиака воздухом;
- производство термопаров (при сплаве с иридием или платиной);
- придают износостойкость и устойчивость к коррозии ювелирным изделиям.
Рутений
Рутений был открыт в Казани в 1844 году К. Клаусом. Он анализировал заводские платиновые осадки из Петербургского монетного двора. Он извлек из руды платину и некоторые платиновые металлы, после чего сплавил остатки с селитрой, извлекая растворимую в воде часть. А нерастворимый в воде осадок, взаимодействовал с царской водкой и высушил. К. Клаус обработал сухой остаток после дистилляции кипящей водой, добавил избыток поташа. Отделив осадок гидроокиси железа, он обнаружил элемент неизвестного происхождения темно-пурпурного оттенка раствора осадка в соляной кислоте. Рутений был назван в честь России (Ruthenia - Россия).
Добыча рутения всегда сопровождает добычу платины на россыпных и коренных месторождениях. Присутствует в качестве примесей в составе никелевой руды, медной руды. Также существуют искусственные источники добычи рутения, т.е. отходы ядерной промышленности. Основное месторождение данного металла платиновой группы, это ЮАР, Канада, Россия, Зимбабве.
Основные характеристики рутения:
- серебристо-белый блестящий или матовый цвет;
- обладает твердостью;
- тугоплавок;
- при сильном прокаливании на воздухе переходит в газовую фазу;
- растворяется медленно соляной кислотой при обычной температуре, при высокой температуре - быстро;
- газопоглотительная способность.
Область применения металла
- Производство катализаторов;
- защитные покрытия;
- декоративные покрытия;
- в виде добавок к украшениям;
- добавка в элитные эмали и другое.
Иридий
В начале 19 века химики были заинтересованы неочищенной платиной и всеми возможными элементами содержащиеся в ней. Тогда Дескотиль, Фуркруа и Вокелен стали изучать сырой металл, сплавив его с едким кали, получив частично растворимые в воде соединения неизвестных металлов. Теннант пошел этим же способом, и смог выделит два новых металла: иридий и осмий.
Иридий получил свое название с греческого: радуга, благодаря тому, что соединения данного металла были окрашены в разные цвета. Осмий же в связи с растворение щелочного сплава осмиридия в кислоте (или в воде) сопровождался сильным запахом. С греческого языка, получив название: запах.
Иридий очень редкий металл платиновой группы, который добыть практически невозможно. Добыча его сопровождается попутчиками: платиной или осмием и рутением или палладием. Он встречается в медных и никелевых рудах. Место добывания иридия: Канада (Британская Колумбия), США (Калифорния), ЮАР (Трансвааль), Остров Тасмания, Новая Гвинея, остров Калимантан.
- красивый металл бело-серебристого оттенка;
- твердый и долговечный металл;
- высокая плотность и прочность;
- воздействия осуществляются за счет нагревания металла;
- укрепляет любой состав, делая его износоустойчивым;
- химическая стойкость;
- стойкий к коррозиям;
- стойкость к окислению и всяческому разрушению, даже под воздействием температуры.
- химическая промышленность;
- ювелирное дело;
- вместе с иными металлами является компонентом для автомобильных свечей;
- сплавы с иридием используют в медицине, для производства инструментов;
- в научной деятельности, металл не очень востребован.
Осмий
Чистого осмия в природе нет, он находится в комплексе с родием. Месторождения осмия сконцентрированы в: Африке (юг), Тасмании, Австралии, США, Канаде, Россие, Колумбия, ЮАР (самые большие запасы).
- серебристо-голубые кристаллы;
- резкий запах, при взаимодействии с веществами;
- не растворяется в щелочах и кислотах, смеси соляной и азотной кислот;
- химическая инертность;
- порошковый осмий - сырье для продукции, медленно подвержен к растворению;
- твердый и хрупкий;
- тугоплавкий;
- высокая плотность: самый тяжелый металл.
Область применения
- Медицина: кардиостимуляторы, импланты;
- промышленность: для измерительной техники, часовые механизмы;
- тетра оксид осмия используют в электронной микроскопии.
Металлы платиновой группы, редкие и уникальные металлы, которые не так часто встречаются в природе, но широко и активно применяются в разных сферах жизни, тем самым помогая человечеству.
Металлы платиновой группы: обзор, список, свойства и применение
Металлы платиновой группы – это шесть благородных драгоценных химических элементов, которые расположены рядом в периодической таблице. Все они являются переходными металлами 8–10 групп 5–6 периода.
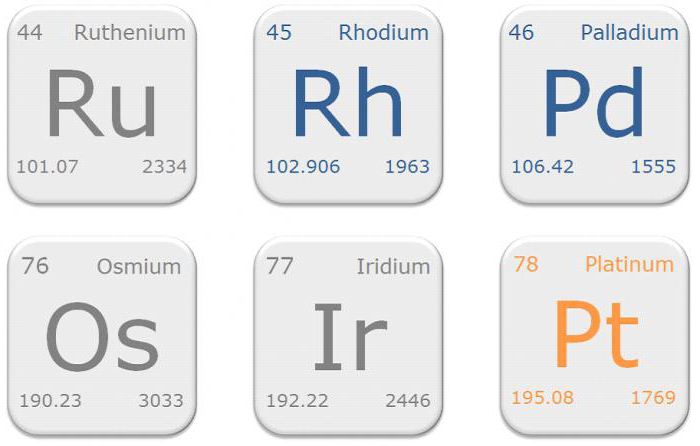
Металлы платиновой группы: список
Группа состоит из следующих шести химических элементов, расположенных в порядке возрастания атомного веса:
- Ru – рутений.
- Rh – родий.
- Pd – палладий.
- Os – осмий.
- Ir – иридий.
- Pt – платина.
Металлы платиновой группы обладают серебристо-белым оттенком, за исключением осмия, цвет которого голубовато-белый. Их химическое поведение парадоксально в том, что они обладают высокой устойчивостью к воздействию большинства реагентов, но используются в качестве катализаторов, легко ускоряющих или контролирующих скорость окисления, восстановления и реакций гидрирования.
Рутений и осмий кристаллизуются в гексагональную плотноупакованную систему, а другие обладают гранецентрированной кубической структурой. Это выражается в большей твердости рутения и осмия.
История открытия
Хотя платиносодержащие золотые артефакты датированы 700 г. до н. э., присутствие этого металла является, скорее, случайностью, чем закономерностью. Иезуиты в XVI веке упоминали серые плотные камешки, связанные с аллювиальными месторождениями золота. Эти камешки нельзя было расплавить, но они образовывали сплав с золотом, при этом слитки становились ломкими, и их уже было невозможно очистить. Камешки стали называть platina del Pinto – гранулы серебристого материала из реки Пинто, впадающей реку Сан-Хуан в Колумбии.
Ковкая платина, которую можно получить только после полной очистки металла, была выделена французским физиком Шабано в 1789 году. Из нее был сделан кубок, преподнесенный папе Пию VI. Об открытии палладия в 1802 году сообщил английский химик Уильям Волластон, который назвал хим. элемент группы платиновых металлов в честь астероида. Волластон впоследствии заявлял об обнаружении еще одного вещества, присутствующего в платиновой руде. Его он назвал родием из-за розового цвета солей металла. Открытия иридия (по имени богини радуги Ириды из-за пестрой окраски его солей) и осмия (от греческого слова «запах» из-за хлорного запаха его летучего окисла) были сделаны английским химиком Смитсоном Теннантом в 1803 году. Французские ученые Ипполит-Виктор Колле-Дескоти, Антуан-Франсуа Фуркруа, и Николя-Луи Воклен выделили два металла одновременно. Рутений, последний изолированный и идентифицированный элемент, получил свое название по латинскому наименованию России от русского химика Карла Карловича Клауса в 1844 году.
В отличие от таких легко выделяемых в относительно чистом состоянии путем простого огневого рафинирования веществ, как золото, серебро, металлы платиновой группы требуют сложной водно-химической обработки. Эти методы не были доступны до конца 19 века, поэтому выявление и изоляция платиновой группы отстала от серебра и золота на тысячи лет. Кроме того, высокая температура плавления этих металлов ограничивала их применение, пока исследователи в Британии, Франции, Германии и России не разработали методы преобразования платины в форму, пригодную для обработки. Как драгоценные металлы платиновой группы начали использоваться в ювелирных изделиях с 1900 года. Хотя такое применение остается актуальным и сегодня, промышленное намного его превзошло. Палладий стал очень востребованным материалом для контактов в телефонных реле и других системах проводной коммуникации, обеспечивая длительный срок службы и высокую надежность, а платина, из-за своей устойчивости к искровой эрозии, во время Второй мировой войны стала применяться в свечах зажигания боевых самолетов.
После войны расширение методов молекулярной конверсии при переработке нефти создало огромный спрос на каталитические свойства, которыми обладают металлы платиновой группы. К 1970-м годам потребление выросло еще больше, когда стандарты автомобильных выбросов в США и других странах привело к использованию данных химических элементов в каталитической конверсии выхлопных газов.
За исключением малых россыпных месторождений платины, палладия и осмистого иридия (сплава иридия и осмия), практически нет руды, в которой бы основным компонентом был химический элемент – металл платиновой группы. Минералы, как правило, содержатся в сульфидных рудах, в частности в пентландите (Ni, Fe)9S8. Наиболее распространены лаурит RuS2, ирарсит, (Ir,Ru,Rh,Pt)AsS, осмиридиум (Ir,Os), куперит, (PtS) и браггит (Pt,Pd)S.
Крупнейшее в мире месторождение металлов платиновой группы – Бушвельдский комплекс в ЮАР. Большие запасы сырья сосредоточены в месторождениях Садбери в Канаде и Норильско-Талнахском в Сибири. В США наибольшие залежи минералов платиновой группы расположены в Стилуотере, Монтана, но здесь они значительно меньше, чем в ЮАР и России. Крупнейшими в мире производителями платины являются Южная Африка, Россия, Зимбабве и Канада.

Добыча и обогащение
Основные южноафриканские и канадские месторождения эксплуатируются шахтным способом. Практически все металлы платиновой группы извлекаются из медных или никелевых сульфидных минералов с помощью флотационной сепарации. Плавка концентрата производит смесь, которая вымывается из меди и сульфидов никеля в автоклаве. Твердый остаток выщелачивания содержит от 15 до 20% металлов платиновой группы.
Иногда до флотации используется гравитационное разделение. В результате получается концентрат, содержащий до 50% платиновых металлов, что избавляет от необходимости выплавки.
Механические свойства
Металлы платиновой группы значительно отличаются механическими свойствами. Платина и палладий довольно мягкие и очень ковкие. С этими металлами и их сплавами можно работать как в горячем, так и в холодном состоянии. Родий сначала обрабатывают горячим, а позже его можно обрабатывать холодным с довольно частым отжигом. Иридий и рутений должны быть нагреты, холодной обработке они не поддаются.
Осмий – самый твердый из группы и имеет наиболее высокую температуру плавления, но его склонность к окислению накладывает свои ограничения. Иридий наиболее коррозионностойкий из платиновых металлов, а родий ценится за сохранение своих свойств при высоких температурах.

Структурные применения
Поскольку дочиста отожженная платина очень мягкая, она восприимчива к царапинам и порче. Для увеличения твердости ее сплавляют со множеством других элементов. Платиновые драгоценности очень популярны в Японии, где ее называется «хаккин» и «белое золото». Сплавы для ювелирных изделий содержат 90% Pt и 10% Pd, который легко обрабатывать и паять. Добавление рутения повышает твердость сплава, сохраняя стойкость к окислению. Сплавы платины, палладия и меди используются в кованых изделиях, так как они тверже платино-палладиевых и менее затратны.
Тигли, используемые для производства монокристаллов в полупроводниковой промышленности, требуют коррозионной устойчивости и стабильности при высоких температурах. Для этого применения лучше всего подходят платина, платина-родий и иридий. Платинородиевые сплавы используются в производстве термопар, которые предназначены для измерения повышенных температур до 1800 °C. Палладий применяют как в чистом, так и в смешанном виде в электрических устройствах (50% потребления), в стоматологических сплавах (30%). Родий, рутений и осмий редко используются в чистом виде – они служат легирующей добавкой для других металлов платиновой группы.

Катализаторы
Около 42% всей платины, произведенной на Западе, используется в качестве катализатора. Из них 90% применяется в автомобильных выхлопных системах, где тугоплавкие гранулы или сотовые конструкции с платиновым покрытием (а также палладиевым и родиевым) содействуют преобразованию несгоревших углеводородов, окиси углерода и окислов азота в воду, углекислый газ и азот.
Сплав платины и 10% родия в виде раскаленной докрасна металлической сетки служит катализатором в реакции между аммиаком и воздухом для получения окислов азота и азотной кислоты. При подаче вместе со смесью аммиака метана можно получить синильную кислоту. При переработке нефти платина на поверхности гранул оксида алюминия в реакторе является катализатором преобразования длинноцепочечных молекул нефти в разветвленные изопарафины, которые желательны в смеси высокооктановых бензинов.

Гальваника
Все металлы платиновой группы можно наносить гальванически. Из-за твердости и блеска получаемого покрытия наиболее часто применяется родий. Хотя его стоимость выше, чем платины, меньшая плотность позволяет использовать меньшую массу материала при сопоставимой толщине.
Палладий – металл платиновой группы, который проще всего использовать для нанесения покрытий. Благодаря этому прочность материала значительно повышается. Рутений нашел применение в инструментах, предназначенных для обработки трением при низком давлении.
Химические соединения
Органические комплексы металлов платиновой группы, такие как комплексы алкилплатины, используются в качестве катализаторов в процессе полимеризации олефинов, производстве полипропилена и полиэтилена, а также при окислении этилена в ацетальдегид.
Соли платины находят все более широкое применение в химиотерапии рака. Например, они входят в состав таких лекарств, как "Карбоплатин" и "Цисплатин". Покрытые оксидом рутения электроды используются в производстве хлора и хлората натрия. Сульфат и фосфат родия применяются в родиевых гальванических ваннах.
Все о платиновых металлах

Практически каждый человек знает о существовании драгоценных металлов. К их числу относят серебро, золото и платину. При этом далеко не каждому известно о существовании платиновой группы. Ее представителей также относят к числу благородных.


Особенности
Платиновые металлы – это группа из 6 элементов, которые расположены рядом друг с другом в периодической химической таблице. Каждый их элементов группы по праву считается благородным. Это связано со следующими химическими и физическими свойствами.
- Специалисты отмечают низкую концентрацию платиновых металлов. Количество месторождений невелико. Данная характеристика также относится к химическим элементам, которые традиционно считаются редкими и дорогостоящими.
- Представители вышеуказанной группы обладают свойствами следующих металлов: родий, осмий, палладий, рутений.
- В процессе изучения платиноидов было отменно сходство в атомном строении с элементами, указными выше.


Ученые, работающие в области химии, поделили все платиновые металлы на две группы, называемые триадами.
Разделение производится по весу.
- Группа №1. Это самые легкие представители. К ним относится палладий, рутений и родий.
- Группа №2. Оставшиеся 6 металлов – иридий, осмий и сама платина. Это уже тяжелые металлы.


Металлы и их свойства
У металлов вышеуказанной группы имеются свои обозначения. Список такой.
- Рутений – Ru.
- Родий – Rh.
- Палладий – Pd.
- Осмий – Os.
- Иридий – Ir.
- Платина – Pt.


Заметка: все обозначения расположены в определенном порядке, согласно атомному весу.
От наименьшего значения к большему. Все платиновые металлы обладают схожими характеристиками.
- Первое сходство заключается во внешнем виде. Практически все элементы, кроме осмия, имеют светлый оттенок (сочетание белого и серебристого цветов). Осмий отличается легким голубоватым тоном.
- Металлы имеют высокую устойчивость по отношению к множеству реагентов. При этом платиноиды являются эффективными катализаторами.
- С их помощью контролируют различные химические процессы, управляют скоростью окисления, а также следят за другими реакциями. Такое поведение металлов считается удивительным и парадоксальным.

Свойства
На поверхности не образуется окисление. Таким образом, наглядно демонстрируется инертность. По мнению специалистов, она особенно заметна у платины. При изучении представителей платиновой группы нельзя было обойти стороной температуру плавления. Самое низкое значение у палладия и составляет 1554 градуса. Самое высокое значение у осмия. Его температура насчитывает 3 тысячи 27 градусов по Цельсию.
Следующее одинаковое свойства – тугоплавкость. Данная характеристика говорит о замечательной износостойкости. Несмотря на внешнее сходство, физические качества отличаются. В зависимости от этих показателей, при обработке используются специальные методики. Рутений и осмий – очень хрупкие металлы и требуют особо бережного отношения.
Высокая пластичность – показатель палладия и платины.


Где добываются?
Месторождения платиновых металлов обычно рассеяны на территории Канады и Южной Африки. В этих регионах получение полезного ископаемого происходит стандартным шахтным способом. Как показывает практика, большинство платиноидов добывается путем извлечения элементов из никелевых сульфидных минералов или же медных руд. В работе используют флотационную сепарацию. В процессе обработки металла выполняется плавка полученного концентрата, в результате этого получается специальная смесь. Объем платиновых металлов – от 15 до 20% от сухого остатка.
В некоторых случаях процесс добычи и обработки может отличаться. Иногда на заводах используется гравитационное разделение. В этом случае количество необходимых химических элементов возрастает до 50%. Такой вариант обработки исключает выплавку. Несмотря на то что богатые залежи МПГ встречаются редко, некоторые месторождения также находятся на территории Канады, Китая, Австралии и Финляндии.
Существуют и другие источники, однако, доля их добычи насчитывает всего 0,3% от общей массы, добываемой на планете.

Где используются?
Платиноиды нашли свое применение в различных сферах. Универсальные свойства металлов данной группы активно используются на сегодняшний день. Чистая платина само по себе очень мягкая и податливая. В таком состоянии она очень восприимчива и различным повреждениям и дефектам. Чтобы повысить твердость и износостойкость драгоценного металла, используются различные элементы. Платину сплавляют с другими химическими элементами.
Ювелирные украшения из платины высоко ценятся и стоят дороже золота. Особую популярность они обрели в Японии. Жители Страны восходящего солнца называют такие изделия «хаккин». Основной ювелирного сплава является платина и составляет 90% от общей массы. Оставшиеся 10% – это палладий. С ним легко работать, включая пайку и другую обработку.


Также для увеличения твердости, драгоценный белый металл соединяют с рутением. Добавление этого элемента увеличивает стойкость к процессу окисления. МПГ нашли свое применение в изготовлении кованых изделий. В этом случае используется сплав, состоящий из меди, платины и палладия. Такой вариант более доступный по цене, по сравнению с составом из двух элементов: платины и палладия.
Специальные сплавы, которые делаются с использованием платиноидов, широко используются при изготовлении термопар. Это специальное устройство с широким спектром применения. Его основное предназначение заключается в изменении высоких температур (максимальное значение – до 1800 градусов по Цельсию выше нуля). Некоторые представители применяются в чистом виде. Как правило, они выступают в качестве добавок к остальным металлам из платиновой группы. Палладий нашел свое применение в сфере производства электрического оборудования, а также в современных стоматологических сплавах.

Катализаторы
Более 40% всей полученной платины, которая изготавливается за границей, используется как катализатор. Это удивительное и полезное свойство было обозначено еще в первой части статьи. Практически весь металл (примерно 90%) нашел свое применение в сфере производства выхлопных систем для автомобилей. Драгоценный материал, а также родий и палладий, выступает в качестве защитного покрытия для сотовых конструкций и других элементов. Слой металла защищает от процессов окисления, сохраняя оборудование целым и невредимым. Вступая в химическую реакцию, агрессивные компоненты преобразовываются в безопасные соединения и вещества.
Химические элементы могут выполнять задачу эффективного катализатора не только в качестве покрытия, но и в виде раскаленной сетки из металла. В этом случае происходит реакция между воздухом и ядовитым веществом – аммиаком. В результате получается азотная кислота и оксид азота. Для получения других веществ добавляют различные компоненты.
Еще одна сфера, которая не обходится без использования МПГ – добыча нефти. Это глобальная отрасль, которая указывает на ценность платиноидов и их важность в промышленности.


Другие варианты использования металлов такие.
- На территории России из палладия изготавливаются инвестиционные монеты. Делать это начали после того, как во времена СССР была выпущена монета из чистого палладия. Номинал – 25 рублей.
- Высоковольтное оборудование также не обходится без использования МПГ. При изготовлении электроники данного типа нужны износостойкие и надежные контакты, которые будут устойчивы к негативному воздействию со стороны. Несмотря на развитие новых технологий, в настоящее время нет действующей альтернативы платиноидам.
- В процессе изготовления инструментов и устройств для работы в сложных условиях также активно используются такие металлы. Чтобы трудиться в агрессивной среде, оборудование должно быть прочным, износостойким и долговечным. Именно эти характеристики оно получает от платиновых металлов.
- Чтобы значительно повысить стойкость титана к коррозии, к нему добавляют немного палладия. Также данный элемент платиновой группы часто подмешивают к стали.
- В области медицины активные соединения также активно используются. Данная практика применялась ранее и сохраняет актуальность на сегодняшний день.
- Не стоит забывать о платиновой фольге. Этот материал используется, чтобы защищать устройство химических реакторов.
- Сплав из серебра и палладия активно применяется в слаботочной электронике.


О том, как ещё используется этот драгоценный металл, смотрите в следующем видео.
Металлы платиновой группы

Металлы платиновой группы (МПГ, Платиновая группа, Платиновые металлы, Платиноиды) — коллективное обозначение шести переходных металлических элементов (рутений, родий, палладий, осмий, иридий, платина), имеющих схожие физические и химические свойства, и, как правило, встречающихся в одних и тех же месторождениях. В связи с этим, имеют схожую историю открытия и изучения, добычу, производство и применение. Металлы платиновой группы являются благородными и драгоценными металлами. В природе, чаще всего встречаются, в полиметаллических (медно-никелевых) рудах, а также в месторождениях золота и платины. Иногда, металлы платиновой группы подразделяют на две триады: рутений, родий и палладий — лёгкие платиновые металлы, а платина, иридий и осмий — тяжёлые платиновые металлы.
Содержание
История
В Старом Свете платина не была известна, однако цивилизации Анд (инки и чибча) добывали и использовали её с незапамятных времён.
В 1803 году английский учёный Уильям Хайд Волластон открыл палладий и родий.
В 1804 году английский учёный С. Теннант открыл иридий и осмий.
В 1808 году русский учёный А. Снядицкий, исследуя платиновую руду, привезённую из Южной Америки, извлёк новый химический элемент, названный им вестием. В 1844 году профессор Казанского университета К. К. Клаус всесторонне изучил этот элемент и назвал его в честь России рутением.
Нахождение в природе
Платина и металлы её группы встречаются в природе в весьма рассеянном состоянии. Геохимически все эти элементы связаны с ультраосновными и основными породами. Известно около полусотни минералов платиновой группы. Платина, иридий, палладий в горных породах и месторождениях развиты как в самородном виде, так и в виде твёрдых растворов и интерметаллических соединений с Fe, Ni, Cu, Sn, реже Au, Os, Pb, Zn, Ag. Наиболее распространёнными являются поликсен (Pt, Fe) где Pt 80 — 88 %, Fe 9 — 11 %, ферроплатина (Pt, Fe) (Fe 16 — 19 %), палладистая платина (Pt, Pd) (Pd 7 — 40 %), станнопалладинит Pd3Sn2Cu (Pd 40 — 45, Pt 15 — 20, Sn 28 — 33 %), гиверсит PtSb2 (Pt 45, Sb 51,5 %), звягинцевит (Pd, Pt)3(Pb, Sn).
Осмий, рутений и родий образуют твёрдые растворы. К ним относятся такие минералы как невьянскит (Ir, Os) (Ir 46,8 — 77,2 % Os 21 — 49,3 %), сысертскит (Os, Ir) (Os 67,9 %, Ir 17 %, Ru 8,9 %, Rh 4,5 %), родиевый невьянскит (Ir, Os, Rh) (Ir 69,9 — 70,4 %, Os 17,2 %, Rh 11,3 %). Кроме того, в природе известны арсениды, сульфоарсениды и сульфиды платины, рутения и палладия, а именно сперрилит PtAs2 (Pt 56,2 %), куперит PtS (Pt 79,2 — 85,9 %), высоцкит (Pd, Ni)5S (Pd 59,5 %, Ni 14,2 %, Pt 4,8 %), холлингвортит (Rh, Pt)AsS (Rh 25 %).
Генетические группы и промышленные типы месторождений
а. хромит-платиновые месторождения (уральский тип)
б. месторождения комплексных платина-хромит-медно-никелевых руд (бушвельдский тип)
в. ликвационные медь-никель-платиновые месторождения (норильский тип)
г. благороднометальные медно-титаномагнетитовые месторождения в интрузиях габбро (волковский тип)
Свойства платиновых металлов [1]
Все платиновые металлы светло-серые и тугоплавкие, платина и палладий пластичны, осмий и рутений хрупкие. Красивый внешний вид благородных металлов обусловлен их инертностью.
Платиновые металлы обладают высокой каталитической активностью в реакциях гидрирования, что обусловлено высокой растворимостью в них водорода. Палладий способен растворить до 800—900 [2] объёмов водорода, платина — до 100 [2] .
Все платиновые металлы химически довольно инертны, особенно платина. Они растворяются лишь в «царской водке» с образованием хлоридных комплексов:
При окислении металлов кислородом воздуха образуются оксиды различного состава:
При нагревании все платиновые металлы реагируют с хлором и фтором:
В растворах платиновые металлы существуют только в виде комплексных соединений. Соединения платины используют в медицине в качестве препаратов, обладающих противоопухолевой активностью [3] .
Производство
Промышленное производство платины первоначально велось в Америке. Лишь в 1819 году платиновые россыпи были впервые обнаружены на Урале близ Екатеринбурга. С тех пор Россия становится ведущим производителем платины, а, с момента открытия, и платиноидов.
В настоящее время, почти 90 % всего объема производства металлов платиновой группы разделено между платиной и палладием, остальные добываются и продаются в небольших количествах. 95 % запасов и 90 % производства МПГ сосредоточены в двух крупных месторождениях — Бушвельдском комплексе, находящемся на территории Южно-Африканской Республики, и в Норильском рудном районе, расположенном в России. В рудах Бушвельда содержание платины втрое выше, чем палладия, в то время как в Норильске наблюдается обратное соотношение. Поэтому, ЮАР является крупнейшим мировым производителем платины, а Россия — палладия [4] .
Запасы
Содержание платиновых металлов в земной коре (кларк) оценивается, как 10 −8 % для платины, 10 −9 % для палладия и 10 −11 % для остальных платиновых металлов [5] .
Общие запасы металлов платиновой группы на начало 2009 года оцениваются в 100 млн кг. Причем распределены они, также неравномерно: ЮАР (63,00 млн кг разведанных запасов при 70,00 млн кг общих), Россия (6,20/6,60), США (0,90/2,00), Канада (0,31/0,39) [6] .
В России почти вся добыча металлов платиновой группы сосредоточена в разработке лицензионных участков «Норильским никелем» (15 % мирового производства платины и 55 % производства палладия) [4] . На металлы платиновой группы в окрестностях Норильска разрабатываются Октябрьское, Талнахское и Норильск-1 сульфидно-медно-никелевые месторождения (более 99% разведанных и более 94% оцененных российских запасов). Кроме того, крупными являются: сульфидно-медно-никелевое месторождение Фёдорова Тундра (участок Большой Ихтегипахк) в Мурманская области, а также россыпи Кондёр в Хабаровском крае, Левтыринываям в Камчатский крае, реки Лобва и Выйско-Исовское в Свердловской области [7] .
Применение
Когда платину стали завозить в Европу, её цена была вдвое ниже серебра. Ювелиры очень быстро обнаружили, что платина хорошо сплавляется с золотом, а так как плотность платины выше чем у золота, то незначительные добавки золота позволили изготавливать подделки, которые невозможно было отличить от золотых изделий. Такого рода подделки получили столь широкое распространение, что испанский король приказал прекратить ввоз платины, а оставшиеся запасы утопить в море. Однако, после отмены этого закона в 1778 году, платина постепенно завоёвывала популярность в ювелирной промышленности. В настоящее время практически все металлы платиновой группы тем или иным образом применяются при изготовлении ювелирных украшений.

Металлы платиновой группы иногда используют для изготовления монет. Например в России с 1828 по 1845 выпускались платиновые монеты номиналом 3, 6 и 12 рублей.
Платина и другие металлы платиновой группы используются частными лицами и компаниями в качестве накоплений.
Фьючерсы и опционы на металлы платиновой группы используются спекулянтами.
С середины 1970-х годов главной сферой применения платины и палладия стала автомобильная промышленность [4] .
В электротехнической промышленности из металлов платиновой группы изготовляют контакты с большой степенью надёжности (стойкость против коррозии, устойчивость к действию образующейся на контактах кратковременной электрической дуги). В технике слабых токов при малых напряжениях в цепях используются контакты из сплавов золота с платиной, золота с серебром и платиной. Для слаботочной и средненагруженной аппаратуры связи широко применяют сплавы палладия с серебром (от 60 до 5 % палладия). Магнитные сплавы металлов платиновой группы с высокой коэрцитивной силой употребляют при изготовлении малогабаритных электроприборов. Сопротивления (потенциометры) для автоматических приборов и тензометров делают из сплавов металлов платиновой группы (главным образом палладия с серебром, реже с другими металлами). У них малый температурный коэффициент электрического сопротивления, малая термоэлектродвижущая сила в паре с медью, высокое сопротивление износу, высокая температура плавления, они не окисляются.
Металлы платиновой группы идут на изготовление деталей, работающих в агрессивных средах — технологические аппараты, реакторы, электрические нагреватели, высокотемпературные печи, аппаратуру для производства оптического стекла и стекловолокна, термопары, эталоны сопротивления и др.
При изготовлении инструментов металлы платиновой группы позволяют получить уникальные свойства по прочности, корозостойкости и долговечности.
Металлы платиновой группы используются в чистом виде, как биметалл и в сплавах (см. Платиновые сплавы). Химические реакторы и их части делают целиком или только покрывают фольгой из металлов платиновой группы. Покрытые платиной аппараты применяют при изготовлении чистых химических препаратов и в пищевой промышленности. Когда химической стойкости и тугоплавкости платины или палладия недостаточно, их заменяют сплавами платины с металлами, повышающими эти свойства: иридием (5—25 %), родием (3—10 %) и рутением (2—10 %). Примером использования металлов платиновой группы в этих областях техники является изготовление котлов и чаш для плавки щелочей или работы с соляной, уксусной и бензойной кислотами; автоклавов, дистилляторов, колб, мешалок и др.
Сплавы иридия с осмием, а также золота с платиной и палладием используют для изготовления компасных игл, напаек «вечных» перьев.
Высокие каталитические свойства некоторых металлов платиновой группы позволяют применять их в качестве катализаторов, например, платину применяют при производстве серной и азотной кислот.
В некоторых странах металлы платиновой группы используются в медицине, в том числе и в качестве небольших добавок к лекарственным препаратам.
Читайте также:

