Муравьиная кислота с металлами
Обновлено: 14.05.2024
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
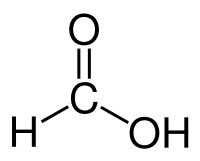
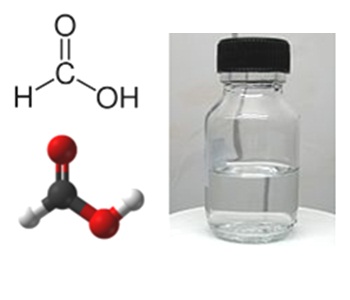
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Муравьиная кислотаХарактеристики и физические свойства муравьиной кислотыМуравьиная кислота – бесцветная жидкость (строение молекулы приведено на рис. 1). Хорошо растворяется в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом.
Рис. 1. Строение молекулы муравьиной кислоты. Таблица 1. Физические свойства муравьиной кислоты. Плотность (20 o С), г/см 3 Температура плавления, o С Температура кипения, o С Получение муравьиной кислотыОсновной способ получения муравьиной кислоты — окисление предельных метана (1), метилового спирта (2), формальдегида (метановый альдегид) (3): CH4 + 3[O] → H-COOH + H2O (t = 150 – 200 o C, p = 30 – 60 atm) (1); H-C(O)H + [O] → HCOOH (3). Химические свойства муравьиной кислотыВ водном растворе муравьиная кислота способна диссоциировать на ионы: Муравьиная кислота обладает химическими свойствами, характерными для растворов неорганических кислот, т.е. взаимодействует с металлами (1), их оксидами (2), гидроксидами (3) и слабыми солями (4): H-COOH + KOH → H-COOK + H2O (3); При нагревании и в присутствии концентрированной серной кислоты муравьиная кислота взаимодействует со спиртами с образованием сложных эфиров: Применение муравьиной кислотыМуравьиная кислота широко применяется для получения сложных эфиров, используемых в парфюмерии, в кожевенном деле (дубление кож), текстильной промышленности (как протрава при крашении), в качестве растворителя и консерванта. Примеры решения задач
Вычислим количество вещества метаналя (молярная масса равна 30 г/моль): n(HCOH) = m(HCOH) / M(HCOH); n(HCOH) = 35 / 30 = 1,2 моль. Согласно уравнению реакции n(HCOH) : n(HCOOH) = 1:1, т.е. n(HCOOH) = n(HCOH) = 1,2 моль. Тогда масса муравьиной кислоты будет равна (молярная масса – 46 г/моль): m(HCOOH) =1,2 × 46 = 55,2 г.
Исходное количество муравьиной кислоты: n(HCOOH) = m(HCOOH)/ M(HCOOH) = 5,4 / 60 = 0,09 моль. Пусть в реакцию димеризации вступило х моль HCOOH, тогда образовалось х/2 моль димера (HCOOH)2и осталось (0,09 — х) моль HCOOH. Общее количество веществ в газовой фазе равно: n = PV / (RT) = 43,7 × 4,50 / (8,31 × 473) = 0,05 = х/2 + (0,09 – х), откуда х = 0,08 моль. Число молекул димера муравьиной кислоты в газовой фазе равно: N[(HCOOH)2] = n × NA = 0,08 / 2 × 6,02×10 23 = 2,408×10 22 . Формула муравьиной кислотыМуравьиная кислота (метановая кислота) – простейшая карбоновая кислота, родоначальник класса карбоновых кислот.
Химическая формула – Молярная масса равна г/моль. Физические свойства – бесцветная жидкость, обладающая резким проникающим запахом при комнатной температуре. Она смешивается с водой и многими полярными органическими растворителями, и в некоторой степени растворяется в углеводородах. В углеводородах в паровой фазе, она состоит из связанных водородными связями димеров. Благодаря тенденции к образованию водородных связей, газообразная муравьиная кислота не подчиняется закону идеального газа. Твердая муравьиная кислота состоит из бесконечной сети связанных водородными связями молекул.
ПрименениеМуравьиная кислота широко используется в лабораторной практике, например, формилирование метиланилина в N-метилформанилин. А также находит применение в медицине для обработки бородавок.
Начальная концентрация муравьиной кислоты моль/л, — убыль кислоты.
Запишем уравнение материального баланса:
— начальная концентрация муравьиной кислоты — текущая концентрация — текущая концентрация иона , равная убыли концентрации Выразим из константы равновесия:
Выразим через :
= моль/л
Исходная концентрация равна , тогда текущие концентрации: — степень диссоциации
Получим выражение для :
Запишем выражение связи изотонического коэффициента и степени диссоциации: AcetylHCOOH + KOH = ? уравнение реакцииСоставьте химическое уравнение по схеме HCOOH + KOH = ? Запишите полное и сокращенное ионное уравнения, если это возможно. Дайте краткую характеристику физических и химических муравьиной кислоты; приведите способы её получения. В результате взаимодействия муравьиной кислоты и гидроксида калия (HCOOH + KOH = ?) происходит образование средней соли – формиата калия и воды (обмен / нейтрализация). Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что вода на ионы не распадается, т.е. не диссоциирует.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Благодаря наличию в воде иона она имеет кислый вкус, способна изменять окраску индикаторов и проводить электрический ток.
Специфическим свойством муравьиной кислоты является её способность взаимодействовать со спиртами: Читайте также:
|


![\[ HCOOH + NaOH = HCOONa + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c66c38874e61297ef8d0497271f2eb27_l3.png)
![\[ HCOOH \rightarrow CO \uparrow + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c1c3c61922b134198fda8c0ee05ec0cf_l3.png)
![\[ 2KMnO_4 + 5HCOOH + 3H_2SO_4 \rightarrow K_2SO_4 + 2MnSO_4 + 5CO_2 \uparrow + 8H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d260a973e28d8e1ab36a727a8762b0e9_l3.png)
![\[ HCOOH \rightleftharpoons HCOO^- + H^+ \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c5da57c1fae37a80bd15774e109b5764_l3.png)
![\[ K = \frac{[HCOO^-] \cdot [H^+]}{[HCOOH]} = \frac{x^2}{C_0 - x} \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b393257617ff5516e55f6cc76e3948bf_l3.png)
![\[ C_0 = [HCOOH] + [HCOO^-] \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e780fe68c9c2d10c115a342bc34d110f_l3.png)
![\[ [HCOO^-] = \frac{K \cdot [HCOOH]}{[H^+]} \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-18548b965447a35703489c7c6bff722c_l3.png)
![\[ C_0 = [HCOOH] + \frac{K \cdot [HCOOH]}{[H^+]} = [HCOOH] \cdot \left (1 + \frac{K}{[H^+]} \right ) \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-eed3cc54c5bde84b59d63899086b31e8_l3.png)
![\[ pH = -\lg [H^+] \Rightarrow [H^+] = 10^{-pH} \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7993b2449fa9841e7e405695dd00c191_l3.png)
![\[ K = \frac{[HCOO^-] \cdot [H^+]}{[HCOOH]} = \frac{x^2}{C_0 - x} = \frac{\alpha ^{2} \cdot C_0^2}{C_0 - \alpha \cdot C_0} = \frac{\alpha ^{2} \cdot C_0}{1 - \alpha } \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-9090413f8926ccdee7118960cde7943e_l3.png)
![\[ K - K \cdot \alpha = \alpha ^{2} \cdot C_0 \Rightarrow \alpha ^{2} \cdot C_0 + K \cdot \alpha - K = 0 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e6a52db0fb6e791deaf1ff67e2d050a2_l3.png)
![\[ \alpha = \frac{-K + \sqrt{K^{2} + 4 \cdot K \cdot C_0}}{2 \cdot C_0} \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b3a4cbe1a1538e404ef9658bd3f96173_l3.png)
![\[ HCOOH + KOH \rightarrow HCOOK + H_2O.\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-607c170a066871dbeec7858302c56ded_l3.png)
![\[ H^{+} + HCOO^{-} + K^{+} + OH^{-} \rightarrow K^{+} + HCOO^{-} + H_2O;\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-908fc3fb86a27880525e9b2f44569389_l3.png)
![\[ HCOOH \rightarrow H^{+} + COO^{-}.\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-aa36613bc43601d2f6b938033453b07a_l3.png)
![\[ 2HCOOH + 2Na \rightarrow 2HCOONa + H_2;\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-64d8f2899874be70ae3763f540c8523d_l3.png)
![\[ 2HCOOH + Na_2O \rightarrow 2HCOONa + H_2O;\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-95841f3cba0e0a4fd9bf784a12cb58ba_l3.png)
![\[ HCOOH + NaOH \rightarrow HCOONa + H_2O;\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-355b260f32b73a4e0de5b0805b379fd0_l3.png)
![\[ 2HCOOH + NaHCO_3 \rightarrow HCOONa + CO_2 + H_2O;\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-343b8f2e5e2825e119c06a43c4683803_l3.png)