Носители свободных электрических зарядов в металлах жидкостях и газах
Обновлено: 05.07.2024
Электрический ток в металлах обусловлен упорядоченным движением свободных электронов (электронов проводимости).
Положительные ионы участия в переносе заряда не принимают.
Электронная природа носителей тока в металлах объясняется следующим образом (рис. 3.24). Кристаллическая решетка металла состоит из положительно заряженных ионов, расположенных в узлах решетки, и электронов, свободно передвигающихся между узлами. Эти электроны — валентные электроны атомов металла, покинувшие свои атомы. Свободные электроны совершают беспорядочное движение по кристаллу, «не помня» уже, какому атому они принадлежали. Их называют также электронным газом. Конечно, при этом сумма всех положительных зарядов ионов решетки равна суммарному отрицательному заряду всех свободных электронов, так что металл остается незаряженным, или электронейтральным.
Не следует думать, что под действием электрического тока все электроны в проводнике устремляются в одном направлении. У них просто появляется преимущественное направление движения (вдоль поля), которое накладывается на хаотическое движение в отсутствие поля (рис. 3.25).


При этом средняя скорость их движения составляет несколько миллиметров в секунду. А вот скорость распространения самого электрического поля — порядка 3 ·108 м/с. С этой же скоростью распространяется электрический ток.
Здесь можно провести аналогию электрического тока с течением воды в водопроводе, а распространение электрического поля — с распространением давления воды. Вода в кране находится под давлением всего столба воды в водонапорной башне. Но из крана течет та вода, которая в нем была, а вода из башни дойдет до крана гораздо позднее, т. к. движение воды происходит с гораздо меньшей скоростью, чем распространение давления.
Существование свободных электронов в металлах было доказано опытами Л. И. Мандельштама и Н. Д. Папалекси (качественно), Б. Стюартом и Р. Томсоном — с получением количественных результатов (1916 г.).
Схема опыта изображена на рис. 3.26. Катушка с большим числом витков тонкой проволоки приводилась в быстрое вращение вокруг своей оси. Концы катушки через специальные контакты замыкались на чувствительный гальванометр. После раскручивания катушки она резко тормозилась специальным приспособлением. При этом гальванометр регистрировал кратковременный ток, направление которого указывало на отрицательный знак носителей заряда. В опыте были использованы инерционные свойства электронов: при резком торможении проводника они продолжали некоторое время двигаться (подобно пассажирам резко тормозящего вагона). Из этих опытов было определено отношение заряда к массе носителя тока, которое совпало с соответствующим значением для электрона (1,8 · 1011 Кл/кг.)

Объяснение многих свойств металлов, в частности, его электрических свойств (закон Ома), дает электронная теория металлов. Классическая электронная теория металлов основывается на представлении об электронах проводимости как об электронном газе, подобном идеальному атомарному газу молекулярной физики. В этой теории считается, что движение электронов подчиняется законам Ньютона, взаимодействием электронов между собой пренебрегают, а взаимодействие с положительными ионами решетки сводят только к соударениям.
Для объяснения закона Ома на основе классической электронной теории металлов необходимо найти выражение для средней скорости и направленного упорядоченного движения электронов в электрическом поле напряженностью Е и подставить в известную формулу для силы тока I:
где qQ = е — заряд электрона, n — концентрация электронов, S — площадь поперечного сечения проводника.
Электроны в металле, участвуя в тепловом движении, постоянно сталкиваются с ионами решетки. Так как масса электрона во много раз меньше массы иона, то после очередного столкновения все направления скорости равновероятны. Это означает, что начальная скорость после очередного столкновения может иметь любое направление и, значит, среднее значение вектора начальной скорости равно нулю, и начальная скорость не оказывает влияния на среднюю скорость направленного движения электронов. Это позволяет считать, что средняя скорость упорядоченного движения электронов v равна произведению ускорения на среднее время движения электрона между двумя соударениями с ионами: . Используя второй закон Ньютона и выражение для напряженности электрического поля, получим:
где F — сила, действующая на электрон со стороны поля, U — напряжение на концах проводника длиной L.
Далее, подставляя полученное уравнение в выражение 1= q0nvS, получим:
Как видно из полученного выражения, сила тока пропорциональна напряжению, как это и следует из закона Ома. Это является следствием того, что средняя скорость направленного движения электронов прямо пропорциональна напряженности электрического поля в металле.
Однако классическая электронная теория не в состоянии объяснить многие экспериментальные зависимости, например, зависимость сопротивления от температуры. Связано это с тем, что движение электронов в металле подчиняется законам квантовой механики, а не классической механики Ньютона.
Электрический ток в газах
Процесс протекания электрического тока через газ называется газовым разрядом.
При комнатных температурах газы практически не проводят электрический ток, так как состоят из нейтральных атомов, т. е. являются диэлектриками.
При нагреве или облучении ультрафиолетовым светом, рентгеновскими лучами либо другим видом излучения атомы газа получают дополнительную энергию, которая может привести к ионизации. Так, например, при нагреве за счет увеличения скорости молекул часть из них при столкновениях друг с другом распадается на положительно заряженные ионы и электроны.
Проводимость газов обеспечивается как электронами, так и положительно заряженными ионами.
Рекомбинация — процесс воссоединения электрона с положительным ионом — наблюдается, если прекратить действие ионизатора. Если внешнее поле отсутствует, то при действии ионизатора устанавливается динамическое равновесие между количеством исчезающих и вновь образующихся пар заряженных частиц.
Несамостоятельный разряд в газе, ионизованном каким-либо ионизатором, возникает в постоянном поле и существует до тех пор, пока существует ионизирующий агент. ВАХ несамостоятельного разряда представляет собой кривую, выходящую на насыщение.
Самостоятельный разряд. При некотором напряжении, зависящем от рода газа, давления и расстояния между электродами, происходит пробой и зажигаетсясамостоятельный разряд, который не нуждается больше во внешнем ионизаторе. Ток через трубку при этом резко возрастает.
Причиной возникновения самостоятельного разряда является ионизация электронным ударом. При соударении атома с электроном, который разгоняется электрическим полем Е до энергии, достаточной для ионизации атома, образуются два электрона, которые при своем движении к аноду также разгоняются и, сталкиваясь на своем пути с другими атомами, ионизуют их, в результате возникает электронная лавина.
Для обеспечения длительного самостоятельного разряда, кроме ионизации электронным ударом, необходима еще эмиссия (испускание) электронов с катода. Такая эмиссия может быть обеспечена либо за счет термоэлектронной эмиссии из катода (испускания электронов из металла при нагреве), либо за счет выбивания электронов из катода положительными ионами с большой кинетической энергией.
Электрический ток в электролитах
Электролиз. Электролитами, или проводниками второго рода, называются вещества, в которых прохождение электрического тока сопровождается электролизом. Электролиз— это выделение на электродах составных частей растворенных веществ или продуктов вторичной реакции.
В электролитах, являющихся водными растворами (или расплавами) кислот, щелочей, солей, перенос заряда осуществляется ионами. Такая проводимость называется ионной.
Закон электролиза установлен опытным путем М. Фарадеем.
Масса вещества, выделившегося на электроде за время Δt при прохождении электрического тока, пропорциональна силе тока и времени:
Величину k называют электрохимическим эквивалентом данного вещества и выражают в кг/Кл. Электрохимический эквивалент численно равен массе вещества, выделившегося на электродах при переносе ионами зарядаМожно показать, что
где е — заряд электрона, NA — число Авогадро, М — молярная (или атомная) масса вещества, n — валентность иона, т. е. k =Таким образом, измеряя величины m и Δq, можно определить электрохимические эквиваленты различных веществ.
Формулы могут быть использованы для определения заряда электрона:
Все входящие в эту формулу величины либо известны (М, n, NA), либо измеряются (m, I, Δt). Именно таким образом в 1874 г. было определено значение е = 1,6 · 10-19 Кл.
Библиотека образовательных материалов для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы из сети Интернет, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Носители свободных электрических зарядов в металлах, жидкостях и газах
Носителями свободных зарядов в металлах являются электроны. Их концентрация велика – порядка 10 28 м -3 . Эти электроны участвуют в беспорядочном тепловом движении. Под действием электрического поля они начинают перемещаться упорядоченно со средней скоростью 10 -4 м/с.
Наличие свободных электронов в металлах было доказано в опытах Л.И.Мандельштама и Н.Д.Папалекси (1913 г.), Б. Стюартом и Р. Толменом (1916 г.).
Опыт проводился следующим образом: на катушку наматывают проволоку, концы которой припаивают к двум металлическим дискам, изолированным друг от друга. К концам дисков при помощи скользящих контактов присоединяют гальванометр.
Катушку приводят в быстрое движение, а затем резко останавливают.
После резкой остановки катушки свободные заряженные частицы некоторое время движутся относительно проводника по инерции, и, следовательно, в катушке возникает электрический ток.
Ток существует незначительное время, так как из-за сопротивления проводника заряженные частицы тормозятся и упорядоченное движение частиц, образующее ток прекращается.
Переносимый при этом заряд пропорционален отношению заряда частиц, создающих ток, к их массе, т. е. q/m. Поэтому, измеряя заряд, проходящий через гальванометр за время существования тока в цепи, удалось определить это отношение. Оно оказалось равным 1,8*10¹¹ Кл/кг.
Электрический ток в металлах это направленное и упорядоченное движение свободных электронов.
Скорость упорядоченного движения электронов прямо пропорциональна напряженности поля в проводнике. (v ~ E)
Электрический ток в металлах это направленное и упорядоченное движение свободных электронов.
Построить удовлетворительную количественную теорию движения электронов в металле на основе законов классической механики невозможно.
Движение электронов в металле подчиняется законам квантовой механики.
Электрический ток в растворах и расплавах электролитов
Жидкости, как и твердые тела, могут быть диэлектриками (дистиллированная вода), проводниками(растворы и расплавы электролитов, щелочей, солей, жидкие металлы) и полупроводниками (расплавленный селен, расплавы сульфидов и т.д.).
Электролиты – вещества, растворы и расплавы которых обладают ионной проводимостью.
Электролиты – водные растворы солей, кислот и щелочей.
В растворах и расплавах электролитов перенос зарядов под действием электрического поля осуществляется положительными и отрицательными ионами, движущимися в противоположных направлениях.
При растворении электролитов под влиянием электрического поля полярных молекул воды происходит распад молекул электролитов на ионы.
Этот процесс называется электролитической диссоциацией.
Электролитическая диссоциация – расщепление молекул электролита на положительные и отрицательные ионы под действием растворителя.
Степень диссоциации – отношение количества молекул, диссоциировавших на ионы, к общему количеству молекул вещества.
Вследствие теплового движения молекул растворимость существенно зависит от температуры.
Степень диссоциации, т.е. доля молекул в растворенном веществе, распавшихся на ионы, зависит от температуры, концентрации раствора и диэлектрической проницаемости растворителя.
С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов.
Носителями заряда в водных растворах или расплавах электролитов являются положительно или отрицательно заряженные ионы.
Поскольку перенос заряда в водных растворах или расплавах электролитов осуществляется ионами, такую проводимость называют ионной.
Жидкости могут обладать и электронной проводимостью. Например, жидкие металлы.
Положительные и отрицательные ионы могут возникать и при плавлении твердых электролитов в результате распада полярных молекул из-за увеличения амплитуды тепловых колебаний.
Ионы разных знаков при встрече могут снова объединится в нейтральные молекулы – рекомбинировать.
Наряду с диссоциацией в растворах электролитов идет и обратный процесс рекомбинации ионов разных знаков в нейтральную молекулу. Когда число молекул, распадающихся на ионы, становится равным числу молекул, возникающих за это же время в результате рекомбинации, устанавливается динамическое равновесие. Степень диссоциации остается постоянной.
В отсутствии внешнего электрического поля ионы вместе в нераспавшимися молекулами находятся в хаотическом тепловом движении.
Электролиз
При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в состав электролита.
Электролизом называют процесс выделения на электроде чистого вещества, связанный с окислительно-восстановительными реакциями.
Электролиз – это выделение веществ из электролита с последующим осаждением на электродах
Электролиз – выделение на электродах веществ, входящих в состав электролита, при протекании через его раствор (или расплав) электрического тока.
При опускании в раствор хлорида меди CuCl2 разноименно заряженных электродов возникает направленное движение ионов. Хлорид меди в водном растворе диссоциирует на ионы меди и хлора:
отрицательному электроду(катоду) притягиваются положительные ионы(катионы) Cu 2+ , к положительному(аноду) – отрицательные ионы(анионы) Cl -
Достигнув катода, ионы меди нейтрализуются избыточными электронами катода:
Образовавшиеся в результате реакции нейтральные атомы меди оседают на катоде.
Ионы хлора Cl - отдают на аноде по одному избыточному электрону, превращаясь в нейтральные атомы хлора Cl, которые соединяясь попарно образуют молекулярный хлор, выделяющийся на аноде в виде пузырьков газа:
Масса вещества, выделившегося на электроде за определенный промежуток времени равна массе всех ионов Ni, осевших на электродах за это время:
mi - масса одного иона
Полный заряд Q всех ионов, прошедших через раствор на электрод, пропорционален заряду каждого иона qi:
Из отношения левых и правых частей равенств получаем:
k – электрохимический эквивалент вещества
Для каждого электролита отношение массы иона к его заряду является постоянной величиной.
Майкл Фарадей в 1833 г.на основании опытов сформулировал два закона электролиза:
1. Масса вещества, выделяющегося из электролита на электродах, оказывается тем большей, чем больший заряд прошел через электролит
Масса вещества, выделившегося на электроде, прямо пропорциональна заряду, прошедшему через раствор (расплав) электролита:
Закон Фарадея можно сформулировать иначе, учитывая, что Q = It:
Масса вещества, выделившегося на электроде, прямо пропорциональна силе тока и времени прохождения тока через раствор (расплав) электролита:
m = k I t I – сила тока
t – время его прохождения через электролит. Из формулы видно, что коэффициент k численно равен массе вещества, выделившегося на электродах, при переносе ионами заряда равного 1 Кл Коэффициент k, превращающий эту пропорциональность в равенство m = kIt, называется электрохимическим эквивалентом вещества.
Единица измерения - кг/Кл
2. Электрохимический эквивалент тем больший, чем больше масса моля вещества и чем меньше его валентность
Масса иона выражается через молярную массу и постоянную Авогадро: mi =
Заряд иона кратен заряду электрона: qi = ne n – валентность химического элемента Тогда получаем соотношение, иногда называемое вторым законом Фарадея: k = . k ~ эта дробь называется химическим эквивалентом вещества Коэффициент, превращающий эту пропорциональность в равенство, назвали постоянной Фарадея F: k = * Постоянная Фарадея равна произведению двух констант – постоянной Авогадро и заряда электрона: F = Na * e = 6,02*10 23 моль -1 *1,6*10 -19 Кл ≈ 9,6*10 4 Кл/моль
Физический смысл электрохимического эквивалента: отношение массы иона к его заряду. = m0i , e n = q0i k = измеряя m и q, можно определить электрохимические эквиваленты различных веществ.
Объединенный закон Фарадея для электролиза: m = kIt (см.п.1), k = * (см.п.2) m = Q =
n – валентность химического элемента
Как следует из объединенного закона Фарадея, если на электроде выделяется моль одновалентного вещества, то m = M, n = 1, F = Q.
Постоянная Фарадея численно равна заряду, который надо пропустить через раствор электролита, чтобы выделить на электроде 1 моль одновалентного вещества.
Электролиз применяется:
Гальванопластика, т.е. копирование рельефных предметов.
Гальваностегия, т.е. нанесение на металлические изделия тонкого слоя другого металла (хром, никель, золото).
Очистка металлов от примесей (рафинирование металлов).
Электрополировка металлических изделий. При этом изделие играет роль анода в специально подобранном электролите. На микронеровностях (выступах) на поверхности изделия повышается электрический потенциал, что способствует их первоочередному растворению в электролите.
Глава 14. Электрический ток в металлах, жидкостях и газах
§ 14.1 Основные положения классической теории электропроводности металлов
Согласно теории Друде-Лоренца носителями тока в металлах являются свободные электроны, что объясняет высокую электропроводность металлов. Ионы в процессе протекания тока через металл участия не принимают. Если бы это было так, то протекание тока через металл сопровождалось переносом вещества. В действительности этого не наблюдается (опыт Рикке).
Основные положения классической электронной теории металлов следующие:
12. Между узлами кристаллической решётки движутся свободные электроны, называемые электронами проводимости.
3. При наличии внешнего электрического поля Е на хаотическое движение свободных электронов накладывается их упорядоченное (направленное) движение – так называемый дрейф электронов в определённом направлении.
4. Электроны проводимости при своём движении сталкиваются с ионами решётки, столкновения между электронами проводимости не учитывается.
5. Внешнее поле не влияет на концентрацию носителей тока и среднее время их свободного пробега.
§ 14.2 Закон Ома и Джоуля-Ленца в классической электронной теории
Согласно закону равномерного распределения энергии по степеням свободы, на один электрон приходится средняя кинетическая энергия теплового движения
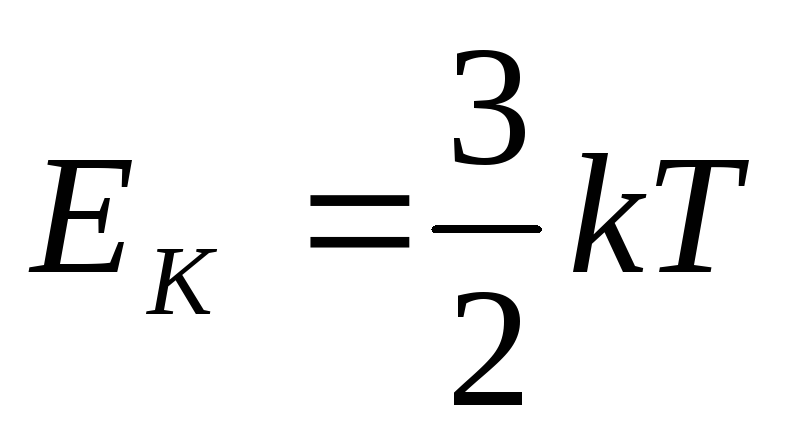

( k - постоянная Больцмана, Т – температура (на каждую степень свободы приходится энергия, равная , электрон рассматривается как материальная точка; следовательно, свободный электрон обладает тремя степенями свободы)).
При тепловом движении электроны испытывают соударения.
Путь, проходимый электронами между двумя последовательными соударениями, называют длиной свободного пробега (рис.14.2).
Если по проводнику течёт постоянный ток, то внутри проводника существует электрическое поле, напряжённостью Е. На каждый электрон со стороны электрического поля действует сила F=eE, где е – заряд электрона. Под действием этой силы электрон приобретает ускорение а, которое можно определить из равенства mea =еЕ, откуда
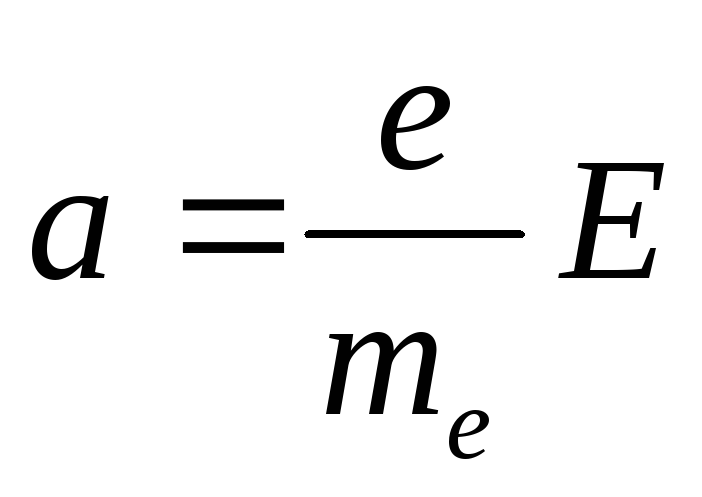
(14.1)
( me - масса электрона).
Если t>– среднее время между двумя последовательными соударениями, то к концу свободного пробега электрон приобретает скорость

(14.2)
Средняя скорость упорядоченного движения электронов
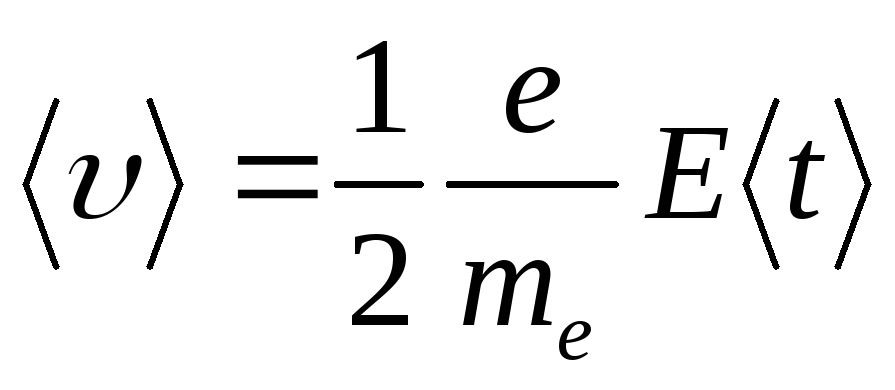
(14.3)
(начальная скорость считается равной нулю, поэтому движение равноускоренное).
Среднее время между двумя последовательными соударениями можно определит, если знать длину свободного пробега и среднюю скорость теплового движения υτ>:
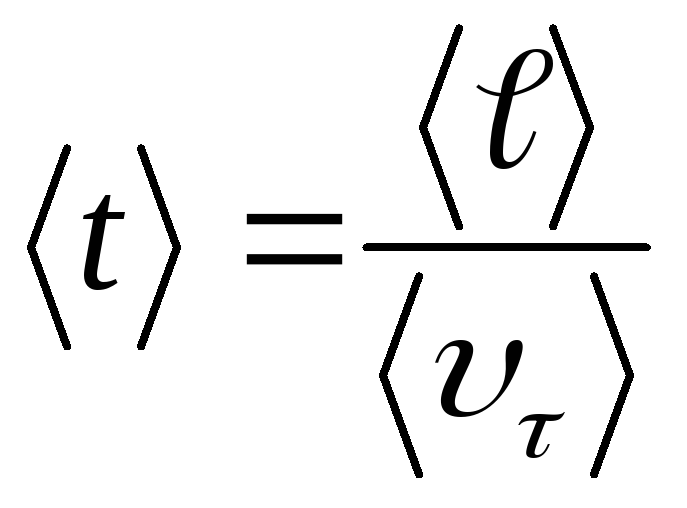
(14.4)
Вообще, , но соотношение (14.4) справедливо, так как уже было показано, что
Подставив из (3.99) в формулу (3.98), получим
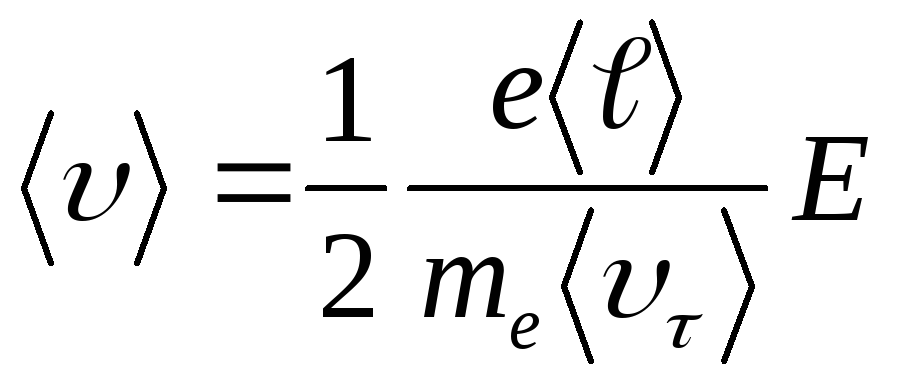
(14.5)
Подставив в формулу j = neυ> (13.37) , получим
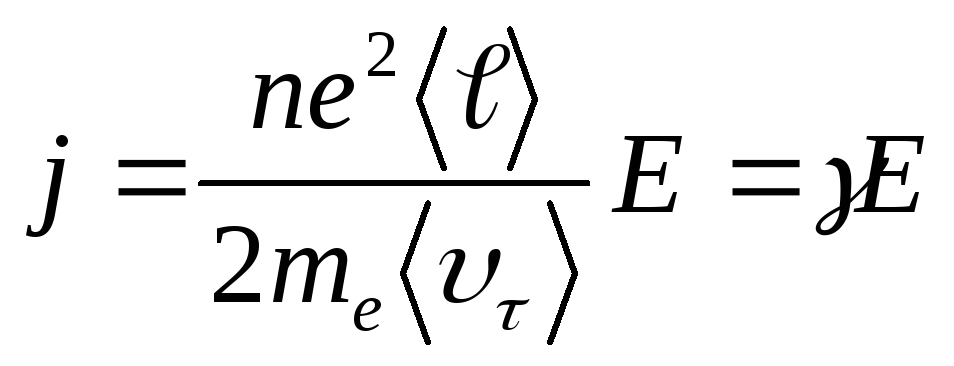
(14.6)

(14. 7)
- удельная проводимость материала проводника (величина, обратная его удельному сопротивлению)).
Единица удельной проводимости – сименс на метр (См/м)
Из выражения (3.101), представляющего закон Ома, следует: плотность тока пропорциональна напряжённости электрического поля, что совпадает с (3.81).
Из формулы (3.101) легко получить закон Ома в виде , для этого её правую и левую части надо умножить наS – площадь поперечного сечения проводника. Учитывая, что , получаем, но, а(поле внутри проводника длиной ℓ считаем однородным); следовательно,

(14.8)










Электрический ток в жидкостях, в полупроводниках, в вакууме, в газах
Напоминаем, что в каждой среде есть свои носители электрических зарядов. В металлах ими служат свободные электроны, в электролитах — положительные и отрицательные ионы, в газах — ионы и электроны, полупроводниках — электроны и дырки, в вакууме — электроны. Электрический ток может течь с переносом и без переноса вещества. Перенос вещества осуществляется только ионами.
Электрический ток в электролитах
Электролиты — жидкости, проводящие электрический ток. К ним относят растворы солей, щелочей и кислот.
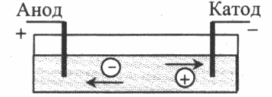
Положительные ионы (катионы) движутся к катоду, а отрицательные (анионы) — к аноду.
Пример №1. Электрическая цепь, изображенная на рисунке, включает в себя сосуд со слабым раствором поваренной соли (NaCl) и опущенными в него двумя электродами. В каком направлении (вправо, влево, вверх, вниз) будут двигаться ионы натрия при замыкании ключа:
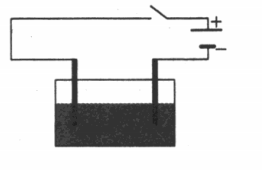
При замыкании ключа в растворе соли начнут образовываться ионы: положительные в виде Na + и отрицательные в виде Cl – . Положительные ионы будут двигаться к отрицательному электроду (катоду), т.е. вправо.
Электрический ток в полупроводниках
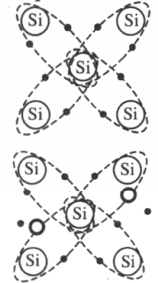
К полупроводникам относят элементы четвертой группы таблицы химических элементов Д.И. Менделеева, которые имеют 4 валентных электрона. Собственная проводимость полупроводников — электронно-дырочная.
При низкой температуре все электроны участвуют в создании ковалентных связей, свободных электронов нет, и полупроводник ведет себя как диэлектрик. При повышении температуры или облучении полупроводников часть ковалентных связей разрушается, и появляются свободные электроны. На месте разрушенной связи возникает электронная вакансия — дырка. Она также перемещается по кристаллу и ведет себя подобно положительной частице.
Зависимость удельного сопротивления полупроводников от температуры и внешнего излучения показана на графике.
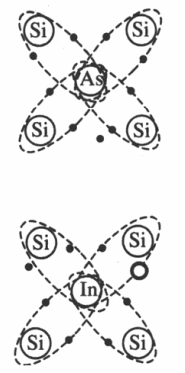
В полупроводниках также может осуществляться примесная проводимость.
Донорные примеси — это элементы пятой группы таблицы химических элементов Д.И. Менделеева. Только 4 из 5 валентных электрона участвуют в создании ковалентных связей. Остальные сразу становятся свободными. Полупроводник, основными носителями в котором являются отрицательные электроны, относятся к полупроводникам n-типа.
Акцепторные примеси — элементы третьей группы таблицы химических элементов Д.И. Менделеева. Три валентных электрона устанавливают ковалентные связи, а не месте четвертой появляется дырка. Полупроводник с положительными носителями относится к полупроводникам p-типа.
Применение полупроводниковых приборов
Термисторы — приборы, сопротивление которых изменяется при нагревании. Они позволяют определять малые изменения температуры.
Фоторезисторы — приборы, аналогичные термисторам, но сопротивление в них изменяется не при изменении температуры, а при изменении освещенности.
Полупроводниковый диод — соединение полупроводников двух типов. Обладает односторонней проводимостью.
Электрический ток в вакууме
Получение основных носителей происходит за счет термоэлектронной эмиссией.
Термоэлектронная эмиссия — процесс испускания электронов при нагревании катода до высокой температуры.
Свойства электронных пучков:
- вызывают нагревание тел;
- при торможении возникает рентгеновское излучение;
- при попадании на некоторые вещества (люминофоры) вызывают их свечение;
- направление электронов может изменять под действием электрического и магнитного полей.
Электрический ток в газах
Электрический ток в газах называют разрядом. Обычно газы состоят из нейтральных молекул, поэтому они являются диэлектриками. Чтобы появились носители электрического заряда, необходима затрата энергии.
Несамостоятельный разряд. При нагреве газа или при облучении его атомов могут отделиться электроны, и атомы превращаются в положительные ионы.
Самостоятельный разряд. В газах при столкновении молекул может освободиться хотя бы один электрон. Если он попадет в электрическое поле, то начнет двигаться с ускорением. Сталкиваясь с нейтральным атомом газа, ускоренный электрон может «выбить» из него другой электрон, превратив сам атом в положительный ион. Электроны будут и дальше ускоряться, разрушая атомы. Ионы создают ток в противоположном направлении. Таким образом, электрический ток в газах создается электронами и ионами.
На рис. 1 изображена зависимость силы тока через светодиод D от приложенного к нему напряжения, а на рис. 2 – схема его включения. Напряжение на светодиоде практически не зависит от силы тока через него в интервале значений 0,05 А
Читайте также:
