Образование окислов на поверхности металла
Обновлено: 04.10.2024
Окисление металлов [oxydation of metals] — процесс взаимодействия твердого или жидкого металла (сплава) с кислородом, сопровождающий образование оксидов. В более широком смысле окисление металлов — реакции, в которых атомы теряют электроны и образуются соединения, например, хлориды, Изделия из металлов и сплавов под воздействием окружающей среды подвергаются постепенному окислению — коррозии. При производстве металлургической продукции окисление металлов приводит к образованию на ней окалины, потери ценных легирующих элементов и железа. Окисление жидкого металла происходит в процессе плавки в открытых печах самопроизвольно вследствие контакта металла с воздухом и окислительнным шлаком. Направление процессов окисления металлов определяется как термодинамическое — изменением свободной энергии при реакции, так и кинетическим фактором — скоростью протекания реакции, которая в значительной степени зависит от природы продуктов окисления и характера их взаимодействия с металлом. Плавка металла в вакуумных печах — радикальный метод защиты его от окисления.
В ряде случаев проводят преднамеренное окисление металлоизделий в защитных или декоративных целях (Смотри Оксидирование).
Энциклопедический словарь по металлургии. — М.: Интермет Инжиниринг . Главный редактор Н.П. Лякишев . 2000 .
Полезное
Смотреть что такое "Окисление металлов" в других словарях:
окисление металлов — Процесс взаимодействия твердого или жидкого металла (сплава) с кислородом, сопровождаемый образованием оксидов. В более широком смысле окисление металлов — реакции, в которых атомы теряют электроны и образуют соединения, например, хлориды,… … Справочник технического переводчика
ОКИСЛЕНИЕ МЕТАЛЛОВ — [oxydation of metals] процесс взаимодействия твердого или жидкого металла (сплава) с кислородом, сопровождаемый образованием оксидов. В более широком смысле окисление металлов реакции, в которых атомы теряют электроны и образуют соединения,… … Металлургический словарь
окисление металлов — ▲ окисление ↑ металл ↓ патина. патинировать. позеленеть. окалина. | оксидирование … Идеографический словарь русского языка
Окисление металлов — реакция соединения металла с кислородом, сопровождающаяся образованием окислов (оксидов). В более широком смысле О. м. реакции, в которых атомы теряют электроны и образуются различные соединения, например хлориды, сульфиды и т.п. В… … Большая советская энциклопедия
Окисление - восстановление — Окисление восстановление, окислительно восстановительные реакции, химические реакции, сопровождающиеся изменением окислительных чисел атомов. Первоначально (со времени введения в химию кислородной теории горения А. Лавуазье, конец 18 в.)… … Большая советская энциклопедия
Окисление-восстановление — окислительно восстановительные реакции, химические реакции, сопровождающиеся изменением окислительных чисел (См. Окислительное число) атомов. Первоначально (со времени введения в химию кислородной теории горения А. Лавуазье, конец 18 в.)… … Большая советская энциклопедия
МЕТАЛЛОВ ОКИСЛЕНИЕ — подразделяется на химическое и электрохимическое. Для хим. окисления используют обычно газообразные реагенты, для электрохим. водные р ры. М. о. газообразными реагентами протекает при газовой коррозии, получении оксидов или галогенидов металлов… … Химическая энциклопедия
окисление-восстановление — [redox] химические реакции, сопровождаемые изменением окислительных чисел атомов. Согласно кислородной теории горения А. Лавуазье (кон. XVIII в.) окисление называл только реакции соединения с кислородом, восстановлением отнятие кислорода. С… … Энциклопедический словарь по металлургии
окисление-восстановление — Химические реакции, сопровождающиеся изменением окислительных чисел атомов. Согласно кислородной теории горения А. Лавуазье (кон. XVIII в.) окислением называются только реакции соединения с кислородом, восстановлением — отнятие кислорода. С … Справочник технического переводчика
Окисление — – процесс образования окислов металлов. [Блюм Э. Э. Словарь основных металловедческих терминов. Екатеринбург, 2002 г.] Рубрика термина: Общие термины Рубрики энциклопедии: Абразивное оборудование, Абразивы, Автодороги … Энциклопедия терминов, определений и пояснений строительных материалов
Оксиды на поверхности металлов, механизм их образования и роста. Сравнительная характеристика физической и химической стойкости оксидов
В атмосферных условиях металлы покрыты оксидными пленками. Первично образующаяся на металле оксидная пленка может иметь аморфную или кристаллическую структуру. Например, в случае окисления алюминия при комнатной температуре образуется аморф-ная пленка толщиной 20¸45Å, которая при нагреве становится кри-сталлической. Первичная пленка на железе меди, цинке с самого на-чала имеет кристаллическое строение. Образование аморфных или кристаллических первичных оксидных пленок зависит не только от физико-химической природы окисляемого металла, но и от условий ее образования, в основном от температуры.
При комнатной температуре в атмосфере воздуха вначале окисление металла идет быстро, но при достижении определенной толщины пленки процесс окисления практически заканчивается. Так, при окислении меди приблизительно через 2 часа толщина пленки достигает 24Å, а затем почти не изменяется. После образования первичной пленки дальнейшее окисление определяется скоростью диффузии через нее металла и кислорода. При диффузии металла зоной роста является внешняя поверхность оксидной пленки. При диффузии кислорода зоной роста является граница металл-оксидная пленка. При соизмеримых скоростях встречной диффузии металла и кислорода зона роста находится внутри оксидной пленки. Схема роста оксидной пленки в этом случае представлена на рис. 1
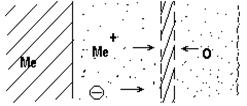 |
Рис. 1 – Схема роста оксидной пленки при соизмеримых скоростях встречной диффузии металла и кислорода
Так как оксидные пленки на металлах имеют кристаллическую структуру, обладающую ионной, а также электронной проводимостью, то при диффузии через пленку перемещаются не непосредственные атомы металла, а ионы и свободные электроны. Это не исключает возможности атомной диффузии, но поскольку радиусы ионов металлов значительно меньше атомов, то можно предположить, что основной диффузионный поток от металла будет состоять из их ионов. Кислород же проникает внутрь оксидной пленки в виде атомов, а не ионов, т.к. размер атомов кислорода в два с лишним раза меньше радиуса иона кислорода.
В процессе образования оксидных пленок закон их роста может быть различным, что в основном определяется соотношением объема оксида Vокк объему металла Vм, из которого он образовался. Например, это отношение для некоторых металлов имеет следующее значение:
Mg – 0,35 Zn – 1,57 Ni – 1,64
Sn – 1,31 Cu – 1,71 W – 3,50
Al – 1,38 Fe – 1,78
= k, (1)
где y – толщина оксидной пленки;
t– время окисления;
k – константа.
После интегрирования зависимости (4.1) получим
y = kt + A(2)
Линейный характер роста пленки устанавливается через некоторое время после начала окисления, когда пленка достигает критической величины. Это наблюдается на щелочных и щелочноземельных металлах, а также на таких металлах как ванадий, молибден, вольфрам, образующих оксиды, легко испаряющиеся при нагреве.
y 2 = kt + A(3)
Для некоторых металлов рост пленки можно описать зависимостью
y n = kt + A (4)
(Частный случай – кубическая парабола при n = 3)
Иногда наблюдается логарифмическая зависимость роста оксидной пленки.
y = ln(kt)(5)
Скорость роста оксидной пленки в процессе окисления зависит от температуры. С повышением температуры скорость увеличивается в соответствии с зависимостью
= Ае – Q / RT ,(6)
где Q – энергия активации процесса;
R – газовая постоянная;
T – абсолютная температура.
Следует отметить, что рассмотренные закономерности роста оксидной пленки соблюдается лишь для чистых металлов. Наличие даже следов примесей может сильно изменить свойства поверхности металла и характер реакций его с кислородом.
Образующиеся на металлах в результате окисления пленки делятся на тонкие, средние и толстые. Тонкими принято считать невидимые пленки от мономолекулярных до 400Å, средними от 400 до 5000Å и толстыми – выше 5000Å (0,5 мкм). В процессе пайки металлов большое значение имеют не только толщины, но и свойства оксидных пленок. Плотные, прочно связанные с металлом оксидные пленки труднее удалить с поверхности металла, что осложняет процесс пайки. Чем менее компактна оксидная пленка, чем слабее ее связь с металлом и, чем менее устойчива она при нагреве, тем меньше затруднений возникает в процессе удаления ее при пайке.
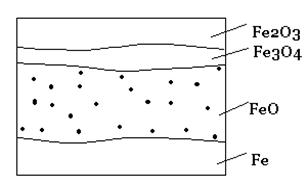
При окислении железа кислородом возможно образование разных соединений в соответствии с диаграммой состояния железо-кислород. Оксидная пленка на железе обычно имеет четко выраженный слоистый характер. На границе с металлом образуется монооксид железа FeO, соответствующая наименьшему содержанию кислорода в оксиде, затем следует промежуточный слой монооксида-оксида железа Fe3O4 и на внешней поверхности пленки – высший оксид Fe2O3. Предполагается, что поверхностный слой металла, находящийся под оксидной пленкой, содержит некоторое количество кислорода в виде твердого раствора с металлом.
Прилегающий к металлу слой монооксида железа FeO (вюстит) имеет кубическую кристаллическую решетку по типу каменной соли. FeO устойчив только при температурах выше 570 0 С. При более низких температурах он не образуется, а при медленном охлаждении распадается с выделением металла по реакции:
4FeO Þ Fe + Fe3O4
При температуре 1377 0 С монооксид железа плавится.
Монооксид-оксид железа Fe3O4 (магнетит) имеет кристалличесую кубическую решетку. Магнетит кристаллографически является самостоятельной фазой, а не молекулярной смесью монооксида и оксида железа. Он устойчив при всех температурах, начиная от комнатной и до точки плавления железа. При нагреве в окислительной среде магнетит переходит в оксид железа a-Fe2O3. Этот переход совершается в две стадии. При нагреве до температуры 220 0 С образуется промежуточная структура оксида g- Fe2O3 с сохранением кубической шпинельной решетки. Двухвалентное железо при этом превращается в трехвалентное:
 |
При дальнейшем нагреве до 400-500 0 С оксид теряет магнитные свойства и образуется решетка оксида железа a- Fe2O3.
Рис. 2 – Микроструктура оксидной пленки на железе (схема)
Оксид железа Fe2O3 (гематит) имеет ромбоэдрическую структуру. Гематит устойчив в широком интервале температур, но при нагреве выше 1100 0 С частично разлагается. При температуре плавления железа гематит полностью диссоциирует на железо и кислород.
При окислении меди образуются три вида оксидов – монооксид меди Cu2O, оксид меди CuO и полуторный оксид меди Cu2O3. Имеются также предположения об образовании в интервале 950-1050 0 С соединения типа недооксида Cu4O. Окисление меди начинается с адсорбции газа на ее поверхности. При комнатной температуре на воздухе происходит образование оксида меди, кристаллизующегося в кубической решетке. Кристаллическая решетка оксида меди ориентирована так, что ребра и грани кубической решетки Cu2O лежат параллельно и граням кубической решетки меди.
Нагрев меди выше 250 0 С вызывает более интенсивное окисление, при этом пленка состоит из смеси оксида и монооксида меди. Рост пленки происходит по диффузионному механизму; предполагают, что при повышенных температурах через пленку диффундируют ионы меди, имеющие малый размер. При 300 0 С и выдержке 5÷10 мин в атмосфере воздуха медь покрывается цветами побежалости.
Наряду с монооксидом меди при окислении также образуется полуторный оксид меди, который, как и монооксид, имеет красный цвет. Кристаллическая решетка его соответствует решетке монооксида меди и отличается от последней только удельной проводимостью. Полуторный оксид меди неустойчив, он начинает разлагаться при 75 0 С. При 400 0 С разложение происходит по уравнению
В интервале 400 – 500 0 С и выдержке 5¸15 мин окисная пленка на меди двухслойная. К металлу примыкает монооксид меди, верхний более тонкий слой состоит из оксида меди, имеющий почти черный цвет. Оксидная пленка в интервале 600 – 800 0 С имеет мелкокристаллическую структуру и плохую связь с металлом. Выше 800 0 С образовавшийся оксид меди разлагается по уравнению
4 CuO Þ 2 Cu2O + O2
В интервале 800 – 950 0 С пленка состоит только из монооксида меди. Этот интервал характерен несколько более прочной связью пленки с основным металлом. При 950¸1050 0 С оксидная пленка приобретает ярко малиновый цвет, что связано, по-видимому, с образованием соединения Cu4O. Оксидная пленка в этом интервале имеет крупнокристаллическую структуру и наиболее прочно держится на металле.
Алюминий при взаимодействии с кислородом при комнатной температуре окисляется с образованием первичной оксидной пленки толщиной 40¸100 мкм. Дальнейшее окисление алюминия тормозится, т.к. образовавшаяся пленка надежно изолирует металл от кислорода. Для оксида алюминия известны модификации a, b, g и др. Наряду с оксидом алюминия известны оксиды состава Al2O – недооксид алю-миния и AlO – субоксид алюминия, существующие при высоких температурах. Первоначально образующийся на поверхности алюми-ния оксидный слой в атмосферных условиях представляет собой аморфное образование. Умеренное нагревание этого слоя до темпе-ратуры выше 200 0 С приводит к возникновению модификации g- Al2O3. В результате взаимодействия с влагой воздуха в оксидной пленке на поверхности алюминия могут образовываться гидрооксиды.
Применяемые в качестве припоев металлы и сплавы также имеют на своей поверхности оксидную пленку. Нагрев под пайку при недостаточной защите может вызывать дальнейшее окисление припоя. Наличие на поверхности припоя в процессе пайки оксидной пленки приводит к ухудшению условий пайки и свойств паяных соединений. Поэтому для получения качественных паяных соединений необходима очистка припоя перед пайкой и надежные условия удаления оксидов в процессе пайки.
В зависимости от состава припои имеют различную окисляемость. Наибольшей стойкостью при высоких температурах отличаются припои на основе никеля.
При легировании основы паяемого металла или припоя легирующие элементы по-разному могут влиять на образование оксидной пленки. Скорость окисления металла может или уменьшаться или увеличиваться. Если легирующие элементы обладают меньшим сродством к кислороду по сравнению с основным металлом, то они обычно остаются под оксидной пленкой в неокисленном состоянии.
На основе анализа состава и строения оксидных пленок можно видеть, что даже при самых благоприятных условиях окисления чистых металлов и сплавов в атмосфере воздуха образующиеся пленки имеют толщину более 20Å. Силы взаимодействия атомов металлов между собой практически исчезают на расстояниях более 10 ангстрем, поэтому обеспечить взаимодействие паяемого металла и расплавленного припоя при наличии на их поверхности оксидных пленок невозможно. Следовательно, металлы необходимо тщательно очищать от оксидных пленок и загрязнений, для чего перед пайкой надо производить механическую зачистку или травление их поверхности в растворах щелочей или кислот. Однако за время между очисткой и пайкой на поверхности металлов вновь образуется тонкая оксидная пленка. Поэтому непосредственно в процессе пайки необходимо удалять оксидную пленку не только с паяемого металла, но и с расплавленного припоя, что достигается применением при пайке флюсов, искусственных газовых сред, вакуума, а также физико-механическими способами разрушения оксидной пленки.
ЛАБОРАТОРНАЯ РАБОТА №3
Цель работы - изучение методов оксидирования стали; получение на стали оксидного покрытия щелочным методом; определение пористости оксидной пленки.
Оборудование, материалы и принадлежности: железная ванна со щелочно-нитритонитратной смесью; электроплитка; образцы; железная подвеска.
1. Теоретическая часть
Одним из наиболее распространенных методов защиты металлов от атмосферной коррозии является их оксидирование.
Оксидную пленку на стали можно получить как электрохимическим окислением металлов в электролитах, так и путем химической обработки стали в кислых и чаще щелочных окислительных средах при повышенных температурах (щелочной метод), а также нагревом в атмосфере водяного пара (паротермический метод).
В процессе щелочного оксидирования в результате взаимодействия железа с окислителем на металле образуется защитная пленка из окислов железа (преимущественно из ). При химическом оксидировании в растворах электролитов, например, в щелочно-нитратных ваннах, отдельные стадии процесса контролируются электрохимическим механизмом. Можно предполагать, что первичной стадией процесса является реакция образования гидрата закиси железа
с последующим более глубоким окислением этого гидрата до окиси по реакции
Основным катодным процессом является восстановление нитратного иона по реакции
Наряду с электрохимическим окислением не исключается также параллельный чисто химический процесс окисления железа с образованием (магнетита) по следующей схеме
При химическом оксидировании в атмосфере водяного пара протекают процессы высокотемпературного окисления стали, причем (гематит) не образуется вследствие более низкого значения парциального давления кислорода в паровой смеси по сравнению с равновесным давлением диссоциации гематита. Если в этих условиях оксидирование стали проводится при температурах не выше 575-600 °С, то оксидная пленка будет состоять из чистого магнетита , так как ниже указанной температуры оксид железа термодинамически неустойчив и не образуется.
Оксидная пленка на стали, полученная щелочным методом, имеет блестящий черный цвет, а полученная паротермическим методом - черный матовый.
При повышении температуры кипения щелочного раствора (вследствие того, что раствор стал более концентрированным) качество пленки ухудшается. На поверхности оксидируемой стали образуется рыхлый бурый налет гидрата окиси железа. То же происходит и при паротермическом оксидировании, если в реактор попадает воздух.
Защитные свойства оксидной пленки невелики, поэтому оксидирование применяют для защиты стали от атмосферной коррозии в легких (комнатных, цеховых) условиях эксплуатации. В случае необходимости сохранения строго калиброванных размеров и красивого внешнего вида детали (одновременно защищая ее от коррозии), применяют щелочное оксидирование. Способ паротермического оксидирования часто применяют для защиты от коррозии режущего инструмента, сверл, разверток и т.д. В этом случае удается, наряду с повышением коррозионной стойкости, значительно повысить износостойкость и, кроме того, совместить процесс оксидирования с высокотемпературным отпуском деталей, выполненных из быстрорежущих сталей.
После оксидирования стальные детали, как правило, смазывают вазелином, либо покрывают лаком. Продолжительность их службы при этом значительно увеличивается.
2. Экспериментальная часть
Работа начинается с подготовки образцов к испытанию. Для этого три стальных образца зачищают наждачной бумагой до появления металлического блеска. Затем образцы обезжиривают ацетоном, протирают с помощью волосяной щетки кашицей из смеси и . После этого образцы помещают на железную подвеску, промывают холодной проточной водой до полного удаления извести. Одновременно железную ванну со щелочно-нитритонитратной смесью для щелочного оксидирования, состоящую из 700 г , 200 г и 50 г на 1 л воды, разогревают на электроплитке до температуры кипения раствора, равной 136-142 °С. Затем образцы декапируют (легко травят), выдерживая их 0,5 мин в холодном 15%-ном растворе , промывают холодной проточной водой, вытирают фильтровальной бумагой и быстро помещают в ванну для оксидирования, отмечая время. (см.рис.7)
Рис. 7 Схема установки
для щелочного оксидирования
1 - железная ванна;
3 - стальные образцы;
В процессе оксидирования стали необходимо поддерживать температуру в ванне для оксидирования в указанных выше пределах, иначе может получиться пленка низкого качества (неравномерная окраска оксидированной поверхности, коричневые или зеленые оттенки оксидного слоя и т.п.)
Оксидирование стальных образцов ведут 30 мин, затем обогрев ванны прекращают, образцы вынимают, тщательно промывают их холодной проточной водой и сушат фильтровальной бумагой. После этого на один образец наносят небольшой слой вазелина, завершая защиту стали оксидированием. Этот образец является контрольным и после окончания работы его сдают преподавателю. Результаты эксперимента записывают в таблицу 7.
| Материал образцов |
| Режим щелочного оксидирования: - состав ванны оксидирования - температура смеси - продолжительность оксидирования |
| Внешний вид оксида |
| Число пор на 1 см 2 |
3. Обработка опытных данных
Пористость оксидной пленки, полученной щелочным оксидированием, определяют наложением на сухую поверхность оксидированного образца фильтровальной бумаги, смоченной раствором, содержащим 10 г и 15 г в 1 л воды. В порах покрытия при этом образуются точки турнбуллевой сини по реакции
Затем бумагу снимают, промывают водой, высушивают в сушильном шкафу при температуре 50-60 °С, подсчитывают среднее число отпечатавшихся на бумаге точек, приходящихся на 1 см 2 поверхности.
Окисление металлов
реакция соединения металла с кислородом, сопровождающаяся образованием окислов (оксидов). В более широком смысле О. м. — реакции, в которых атомы теряют электроны и образуются различные соединения, например хлориды, сульфиды и т.п. В природе металлы находятся почти исключительно в окисленном состоянии (в виде руд), поэтому их производство основано на процессах восстановления различных соединений. Металлы и сплавы, используемые на практике, вследствие воздействия окружающей среды подвергаются постепенному окислению — коррозии (См. Коррозия). Направление процессов О. м. определяется как термодинамическим фактором — изменением свободной энергии при реакции, так и кинетическим — скоростью её протекания, которая в значительной степени зависит от природы продуктов окисления и характера их взаимодействия с металлом. При производстве металлургической продукции О. м. может привести к образованию окалины (См. Окалина), потере ценных легирующих элементов и железа. В ряде же случаев проводят преднамеренное О. м. в защитных или декоративных целях (см. Оксидирование).
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
Окисление металлов — [oxydation of metals] процесс взаимодействия твердого или жидкого металла (сплава) с кислородом, сопровождающий образование оксидов. В более широком смысле окисление металлов реакции, в которых атомы теряют электроны и образуются соединения,… … Энциклопедический словарь по металлургии
Тема 2.1. Химическая коррозия металлов
Определение химической коррозии. Условия возможности протекания процесса. Основные стадии. Условие сплошности пленок. Законы роста пленок во времени в зависимости от их толщины и характера контроля процесса. Состав пленок. Изменение закона роста во времени.
Химическая коррозия металлов является самопроизвольным их разрушением вследствие химического взаимодействия с внешней средой. Характерными особенностями химической коррозии являются протекание процессов окисления металлов и восстановления окислителя в одном акте, отсутствие возникновения электрического тока и образование продуктов коррозии непосредственно в зоне реакции взаимодействия металла с внешней средой.
Химическая коррозия является гетерогенной реакцией взаимодействия жидкой или газовой фазы с металлами и делится на 2 вида:
- коррозия в жидких неэлектролитах.
В нефтеперерабатывающей промышленности газовой коррозии подвергаются трубы печей при воздействии продуктов горения топлива, реактор, реакционные колонны и другая аппаратура под воздействием водорода, сероводорода, окиси углерода, азота, кислорода и других газов при высоких температурах. Обычно термин «газовая коррозия» относят к разрушению металлов, вызываемому действием паров и газов при высоких температурах, хотя по существу его можно применять и к более низким температурам при условии, что на металле не конденсируется пленка жидкости, проводящая электрический ток.
Наибольшее значение в практических условиях имеет газовая коррозия при повышенных температурах на границе металла с газовой фазой. Продуктами газовой коррозии обычно являются оксиды металлов, однако в зависимости от условий эксплуатации могут образовываться и другие соединения, например сернистые металлы.
Термодинамика газовой коррозии
Термодинамическая возможность протекания реакции коррозионного процесса определяется по величине изменения свободной энергии системы при протекании коррозионной реакции. В практических условиях, например в процессе газовой коррозии металлов при различных температурах, подобное суждение наиболее просто и удобно может быть сделано на основании сопоставления упругости диссоциации получаемого продукта реакции окисления и парциального давления кислорода в газовой фазе.
Так, химическая реакция окисления
будет находиться в равновесии, если парциальное давление кислорода ( ) станут равны. При > = 0,21 ат ), металл перестает окисляться и становится вполне благородным по отношению к кислороду. Так, например, серебро при температуре 300К термодинамически еще не устойчиво, а при 400К и при всех более высоких температурах упругость диссоциации Ag2O превышает парциальное давление кислорода в воздухе. При температуре 2000К медь тоже становится неокисляемым металлом, однако для таких металлов, как Fе, Zn, Ni и др., даже при этих температурах упругость диссоциации окислов остается еще достаточно низкой и, следовательно, протекание реакции окисления вероятно.
Необходимо учесть, что температурная зависимость для кинетики процесса окисления совершенно иная, чем для термодинамической вероятности окисления. Поэтому нет никакого противоречия в том, что степень термодинамической вероятности окисления металла с повышением температуры падает, а реальная скорость окисления (при условии, что термодинамически этот процесс остается еще возможным) с повышением температуры возрастает.
Пленки на металлах
В большинстве случаев продукты газовой коррозии образуются и остаются на металле в виде пленки. Пленки продуктов коррозии определяют кинетику процесса и в случае наличия защитных свойств могут привести к замедлению коррозионного процесса. Чтобы пленка продуктов коррозии обладала защитными свойствами, она должна быть сплошной, не разрушаться в агрессивной среде, прочно сцепляться с основным металлом и обладать близким к нему коэффициентом теплового расширения. Если пленка пористая, рыхлая и характеризуется плохим сцеплением с основным металлом, то даже при условии инертности в данной агрессивной среде, она не будет обладать защитными свойствами.
Пленки по толщине делятся на три группы:
- тонкие (невидимые), δ < 4000 нм;
- средние (дающие цвета побежалости), δ = от 4000 до 50000 нм;
- толстые (видимые), δ > 50000 нм.
Толщина пленок, образовавшихся при взаимодействии металла с сухим воздухом, различна и зависит от рода металла, температуры и других факторов. Толщина пленок на меде и железе при комнатной температуре составляет 100 – 300 нм, а на алюминии 1000– 1500 нм. При повышении температуры толщина пленки увеличивается и дает цвета побежалости. Так, при нагреве железа до 400 0 C в течение 1 ч на нем образуется желтая пленка толщиной 4600 нм, через 2 ч – красная пленка толщиной 5800 нм, а через 3 ч – синяя пленка толщиной 7200 нм. Примером толстой видимой пленки является окалина на железе или пленка, полученная на алюминии анодированием, имеющая толщину 10 – 15мкм, а в некоторых случаях – до 200 – 500 мкм. Наличие тонких, невидимых пленок было доказано различными способами:
- если сломать стальной образец (иглу, лезвие) под ртутью, то произойдет амальгамирование поверхности; если излом произвести на воздухе, а затем погрузить образец в ртуть, то амальгамирования не произойдет. Это объясняется образованием тончайшей окисной пленки, препятствующей амальгамированию;
- если железную полированную пластину нагреть с одного конца, то вследствие неравномерности толщины пленки, на поверхности пластины появятся цвета побежалости (желтый, красный, пурпурный, фиолетовый, синий).
При нанесении на различные участки поверхности железа капли азотно-кислой меди, можно определить защитные свойства пленки. В местах, где пленка не обладает защитными свойствами, протекает реакция
и под каплей будет происходить выделение меди.
Наибольшими защитными свойствами пленка обладает не у нагретого конца, т.е. где пленка толще, а в преджелтой зоне, где пленка невидима;
Изоляция пленок от поверхности металла является самым наглядным доказательством их существования. Благодаря оптическим эффектам отражения света эти пленки, невидимые на поверхности металла, становятся видимыми. Если поместить металл в среду, которая хорошо растворяет металл, но не растворяет пленку, и нарушить целостность пленки, то металл растворяется, а пленка остается в изолированном виде.
Условия сплошности пленок
Защитными свойствами могут обладать только сплошные, т.е. покрывающие сплошным слоем всю поверхность металла, пленки. Условие сплошности определяется соотношением объемов образованного окисла и исходного металла.
Если объем продуктов коррозии Vок меньше, чем объем металла Vме, образующего это соединение, пленка будет пористой и обладает слабыми защитными свойствами. Наоборот, если объем продуктов коррозии больше, чем объем окислившегося металла, то можно ожидать образования сплошных пленок с повышенной способностью защищать от коррозии.
Соотношение объемов образованного оксида и исходного металла может быть легко подсчитано. Предположим, что окислится 1 грамм-атом металла. Его объем равен
где А – атомная масса металла;
d – плотность металла.
Объем полученного оксида будет равен
где М – молекулярная масса окcида;
D – плотность оксида;
n – число атомов металла в молекуле оксида.
Соотношение между объемом оксида и объемом металла
Щелочные и щелочноземельные металлы, указанное соотношение у которых меньше 1, образуют рыхлые пленки, со слабыми защитными свойствами и характеризуются высокими скоростями окисления. Металлы с соотношением не следует ожидать высоких защитных свойств пленки. Ориентировочно В табл. 2 приведены данные рассчитанного соотношения объемовЭти данные подтверждают условия сплошности пленок. Так, натрий, кальций, барий, магний при окислении не могут образовать сплошных пленок, так как у этих металлов .
Отношение объемов оксида и металла для некоторых металлов
| Металл | Оксид | |
| натрий кальций барий магний кадмий алюминий свинец цинк никель хром железо молибден вольфрам | Na2O CaO BaO MgO CdO Al2O3 PbO ZnO NiO Cr2O3 Fe2O3 MoO3 WO3 | 0,57 0,64 0,74 0,79 1,21 1,24 1,29 1,57 1,60 2,03 2,16 3,45 3,36 |
Механизм окисления металлов
Для большинства случаев окисления основным направлением диффузии является движение металла через пленку наружу и в меньшей степени - диффузия кислорода в обратном направлении.
Так как оксидные и солевые пленки на металлах имеют ионную кристаллическую структуру, обладающую, как правило, ионной и в некоторой степени электронной проводимостью, то можно ожидать диффузию через пленку не непосредственно атомов металла, а ионов металла и самостоятельно электронов. Можно также предполагать возможность диффузии ионов кислорода в противоположном направлении. Ионизация кислорода при этом происходит на внешней поверхности прошедшими через пленку электронами. Естественно, что допущение ионного характера диффузии не исключает возможности параллельного протекания и атомной диффузии.
Ион металла имеет меньший радиус, чем атом. Наоборот, анионы имеют больший радиус, чем атомы соответствующего металлоида. Следовательно, в общем случае можно предполагать, что от металла сквозь пленку двигаются ионы металла, а с поверхности пленки вглубь - атомы кислорода, ионизация которых происходит уже в самой пленке. Из-за большей подвижности при диффузии металлических ионов преимущественный рост пленки происходит вблизи ее внешней поверхности (рис.3).
Законы роста пленок
Исходя из современной теории роста пленок, образование и их дальнейший рост осуществляется взаимной двусторонней диффузией как окислительного реагента к поверхности металла, так и металла к внешней поверхности пленки.
Скорость роста защитной пленки находится в зависимости от диффузии и скорости химического превращения и определяется уравнением, предложенным Эвансом:
где y– толщина пленки;
τ – время ее образования;
Кd – константа диффузии при данных условиях;
Кс – константа скорости химической реакции образования пленки;
Со – концентрация действующей среды на внешней поверхности пленки.
При достаточно толстой пленке величина y 2 /Kd значительно больше чем 2y/Kc. Принебрегая последней, получаем зависимость роста толщины пленки от процесса диффузии:
Заменяя величины 2КdCo через k1, получаем уравнение параболы
В этом случае (при достаточно большой толщине пленки) скорость роста пленки контролируется диффузией.
На рис.4а приведено графическое изображение параболической зависимости для окисления железа на воздухе при различных температурах.
На рис. 4б показано преобразование парабол в прямые линии в логарифмических координатах, при котором
,
где Δm - увеличение массы, прямо пропорциональное толщине пленки у.
При малой толщине пленки влияние y 2 /Kd будет незначительным по сравнению с 2y/Kc и уравнение примет вид
Обозначая КсСоτ через k2, получаем линейное уравнение зависимости толщины пленки от времени
При малой толщине пленки рост ее контролируется только скоростью химического превращения, т.е. коррозионный процесс подчиняется кинетическому контролю.
При смешанном диффузно-кинетическом контроле окисления металлов нельзя пренебречь ни одним из членов уравнения Эванса. Тогда путем приведения к общему знаменателю и умножения левой и правой части уравнения на С0 получим:
Подставляя вместо КсСo=k2 и вместо 2КdCo=k1, получим
Эта зависимость может быть преобразована в прямую линию построением графика τ/ m), при этом k2 = ctgα; 1/k1 = τ при . График этой зависимости от окисления углеродистой стали на воздухе, насыщенном парами воды при 800 о С, приведен на рис. 5а, а на рис. 5б показано преобразование зависимости в прямую линию.
Рост оксидных пленок при диффузно-кинетическом контроле может быть также выражен степенным законом:
где n - показатель степенного закона; причем 1 < n < 2, kn = const. Этот закон пригоден для описания кривой на рис. а, что подтверждается спрямлением ее в логарифмических координатах lg , при котором
n = ctgα; τ = 0.
Рост оксидной пленки по законам 15 и 16 имеет место, если соизмеримы скорости химической реакции окисления и диффузионных процессов в оксидной пленке.
Для ряда металлов установлена логарифмическая зависимость между толщиной пленки и продолжительностью ее роста:
у = ln(kτ) (17)
Логарифмический закон роста пленки установлен, например, для алюминия и цинка в интервалах температур от 25 до 225 о С, железа – до 375 о С, меди – до 100 о С. При изображении логарифмической зависимости в полулогарифмических координатах у – lgτ получается линейная зависимость.
Кинетические кривые процесса окисления имеют большое практическое значение. Они позволяют без проведения длительных испытаний (полгода и более) оценить окалиностойкость металлов и сплавов путем сопоставления показателей и коэффициентов уравнений. Так, для нижеприведенных сталей было показано понижающее влияние добавки марганца на стойкость к высокотемпературному окислению:
Х18Н11С2ГА Х18Н11С2Г2А Х18Н11С2Г3А
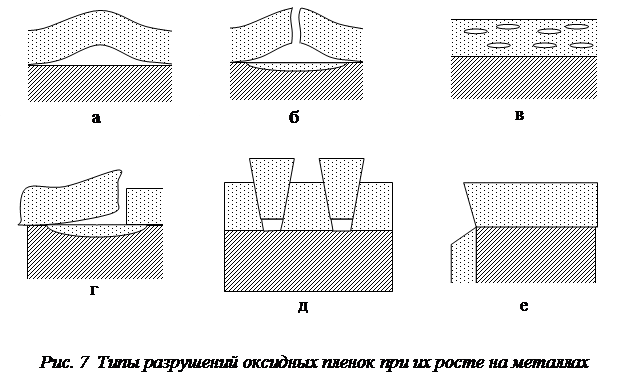 |
Так, внутренние сжимающие напряжения (рис.6,а), появляющиеся при росте толщины пленки, приводят к ее отслаиванию, если прочность пленки на разрыв велика, а ее адгезия к поверхности металла недостаточна (рис. 7,а). Внутренние напряжения сжатия на неровной поверхности (рис. 6,б) способствуют образованию отрывающего усилия. При недостаточной прочности пленки появляются пузыри с разрывом (рис. 7,б). В оксидной пленке возможно возникновение микропузырей (рис. 7,в), которые препятствуют диффузии ионов металла и могут привести к торможению процесса окисления. Разрушение пленок отслаиванием (рис. 7,г) преимущественно происходит на неровностях поверхности, а растрескивание при сдвиге характерно для пленок с меньшей прочностью, чем их адгезия к металлу. Чаще всего начало разрушения оксидной пленки с отслаиванием наблюдается на углах изделий и их крутых изгибах (рис. 7,е).
Разрушение пленок заметно понижает их защитные свойства пленок и может привести к изменению кинетики окисления.
Об изменении защитных свойств пленки свидетельствуют резкие изломы на кинетической кривой окисления (рис.8).
Читайте также:
