Общие понятие о металлах
Обновлено: 04.10.2024
Определение металлов можно дать с позиций химии, физики и техники.
В химии металлы — это химические элементы, находящиеся в левой части периодической системы элементов Д. И. Менделеева, которые обладают особым механизмом взаимодействия валентных электронов (ионов) с ядром как в самих металлах, так и при вступлении в химические реакции с другими элементами, в том числе с металлами.
Физика характеризует металлы как твердые тела, обладающие цветом, блеском, способностью к плавкости (расплавлению) и затвердеванию (кристаллизации), тепло- и электропроводностью, магнитными и другими свойствами.
В технике металлы — это конструкционные материалы, обладающие высокой обрабатываемостью (ковкостью, штампуемостью, обрабатываемостью резанием, паяемостью, свариваемостью и др.), прочностью, твердостью, ударной вязкостью и рядом других ценных свойств, благодаря которым они находят широкое применение.
Русский ученый М. В. Ломоносов (1711 — 1765), исследуя металлы и неметаллы в своем труде «Первые основания металлургии или рудных дел», дал металлам определение: «Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец». Это определение М. В. Ломоносов дал в 1773 г., когда известны были только шесть металлов.
Из металлов, добываемых из недр земли, получают большую группу конструкционных материалов, применяемых в различных отраслях промышленности. В природе одни металлы встречаются в чистом, самородном виде, другие — в виде оксидов (соединений металла с кислородом), нитридов и сульфидов, из которых состоят различные руды этих металлов.
Самыми распространенными металлами, применяемыми в качестве конструкционных материалов, являются железо, алюминий, медь и сплавы на основе этих металлов.
К металлам относятся более 80 элементов периодической системы Менделеева. Все эти металлы подразделяются на две большие группы: черные металлы и цветные металлы.
Характерными признаками черных металлов являются темно-серый цвет, блеск, высокие плотность и температура плавления, твердость, прочность, вязкость и полиморфизм (аллотропия). По физикохимическим свойствам черные металлы подразделяют на пять групп:
- железистые (железо, кобальт, никель, марганец);
- тугоплавкие (вольфрам, рений, тантал, молибден, ниобий, ванадий, хром, титан и др.);
- урановые — актиниды (уран, торий, плутоний и др.);
- редкоземельные — лантаниды (лантан, церий, иттрий, скандий и др.);
- щелочно-земельные (литий, натрий, калий, кальций и др.).
Из этих пяти групп черных металлов особенно широкое применение в промышленном производстве находят железистые и тугоплавкие металлы.
Железистые металлы, кроме марганца, называют еще ферромагнетиками. Ферромагнетики способны намагничиваться и притягивать металлы своей группы.
К тугоплавким относятся металлы, которые имеют температуру плавления выше температуры плавления железа (1 539 °С): титан — 1 667 °С, ванадий — 1 902 °С, хром — 1 903 °С, молибден — 2 615 °С, ниобий — 2 460 °С, тантал — 2 980 °С, вольфрам — 3 410 °С. Тугоплавкие металлы в основном применяются как легирующие элементы в производстве жаропрочных, жаростойких, теплостойких и специальных сплавов, в том числе твердых сплавов и высоколегированных сталей.
2. Строение металлов
Атомно-кристаллическая структура металлов. Как известно, все вещества состоят из атомов, в том числе и металлы. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные друг от друга. В газообразном металле расстояние между атомами велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т. е. в объеме расположено небольшое количество атомов, а не атомы всего объема. При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Если условно провести вертикальные и горизонтальные линии связи через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющиеся элементарные геометрические фигуры — параллелепипеды (рис. 1). Наименьшую геометрическую фигуру называют элементарной ячейкой. Элементарные ячейки, расположенные на горизонтальных и вертикальных кристаллографических плоскостях (рис. 2), образуют пространственную кристаллическую решетку.
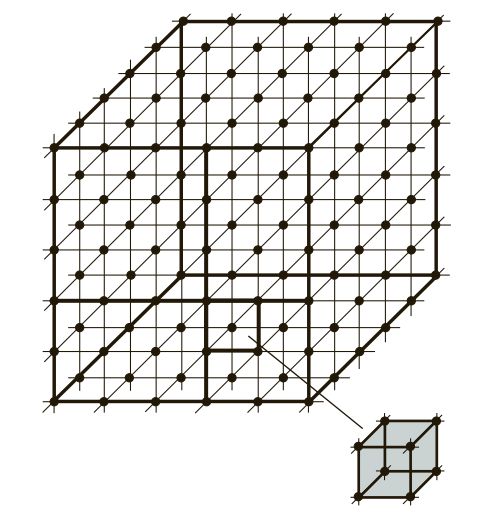
Рис. 1. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
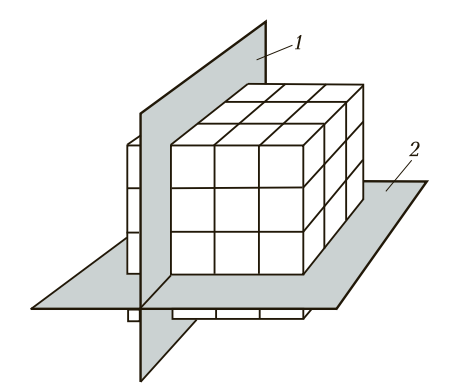
Рис. 2. Расположение кристаллографических плоскостей: 1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Элементарные кристаллические решетки характеризуют следующие основные параметры: расстояние между атомами по осям координат (по линиям связи), углы между линиями связи, координационное число — число атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Таким образом, любой металл можно представить не как однородную цельную массу, а как массу, сложенную из множества элементарных ячеек. Блок элементарных атомных кристаллических ячеек образует атомно-кристаллическую ячейку (решетку). Если выделить эту элементарную ячейку, то в зависимости от металла получим следующие типы кристаллических ячеек (рис. 3): куб (К), объемно-центрированный куб (ОЦК), гранецентрированный куб (ГЦК), гексагональная плотноупакованная ячейка (ГПУ), гексагональная простая ячейка (Г) и др.
Простая кубическая ячейка (рис. 3, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 3, б ) состоит из восьми атомов, которые расположены по одному атому в каждой вершине куба, и одного, находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Fe-α, ванадий, вольфрам, молибден, тантал и хром, т. е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 3, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецентрированную кубическую ячейку имеют алюминий, железо модификации Fe-γ, золото, кобальт, медь, никель, платина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 3, г) состоит из 17 атомов. Форма геометрического тела, которую образуют эти атомы, является шестигранной призмой. При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 3, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
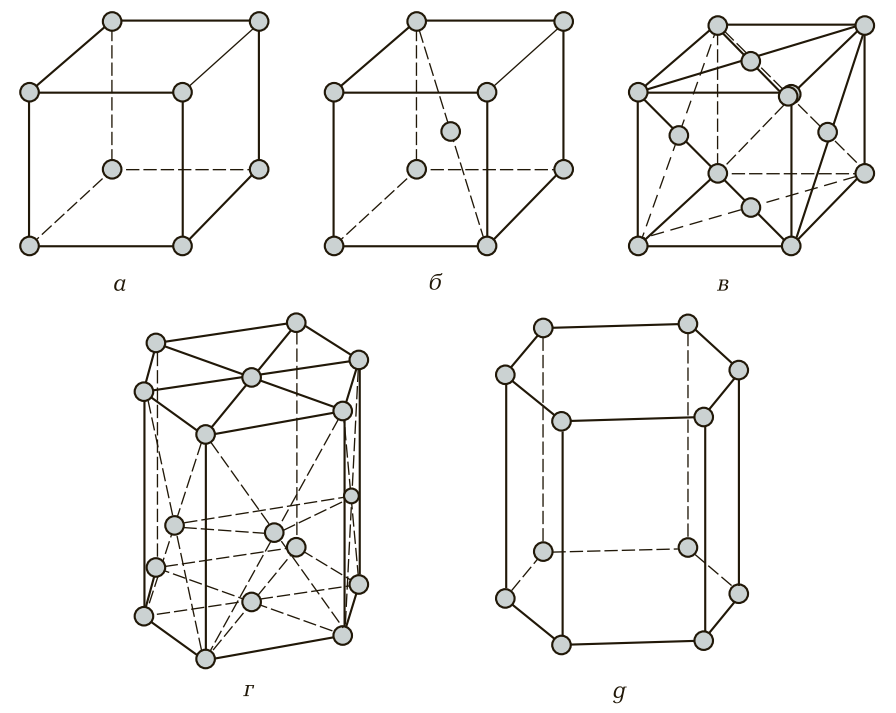
Рис. 3. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая ячейка
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем бо´льшую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Анизотропия металлов. Анизотропия (от гр. anisos — неравный и tropos — направление) — неодинаковость физических свойств среды (тела) в различных направлениях. Анизотропия предполагает зависимость свойств металлов от направления по плоскостям атомно-кристаллических решеток. Чем больше в плоскости атомов, тем выше свойства металлов. В горизонтальных плоскостях в любой форме атомно-кристаллических решеток больше, чем в вертикальных плоскостях. Следовательно, прочность металлов, испытанная в горизонтальном направлении, выше, чем в вертикальном. Анизотропия проявляется в процессе обработки конструкционных материалов давлением (проката, волочения, штамповки и других технологических способов получения заготовок и изделий).
На рис. 2 кристаллографические плоскости совпадают с линиями связи, проходящими через атомы металла. Форма элементарной кристаллической ячейки, расстояние между атомами и прочность металлической связи определяют физические, механические и технологические свойства металлов. Если исследуемый металл рассматривать по трем кристаллографическими плоскостям, по линиям связи между атомами, то можно заметить, что свойства по этим трем измерениям будут различны. Число атомов в этих плоскостях неодинаково. Металлическая связь между горизонтально и вертикально расположенными атомами также неодинакова. Это, в свою очередь, приводит к различной прочности металлов в продольном и поперечном направлениях. Например, предел прочности меди в продольном направлении будет в 2 раза больше, чем в поперечном.
Все металлы анизотропны, так как они состоят из кристаллов. Кристаллическое строение металлов обусловливает пластическую деформацию, т. е. изменение внешней формы и размеров под действием нагрузок без разрушения. Способность металлов и сплавов пластически деформироваться положена в основу их обработки давлением (прокатка, волочение, ковка, штамповка и прессование). При обработке давлением, например прокатке (рис. 4, а), происходит перемещение одного слоя атомных решеток по другому по кристаллографическим плоскостям (рис. 4, б).
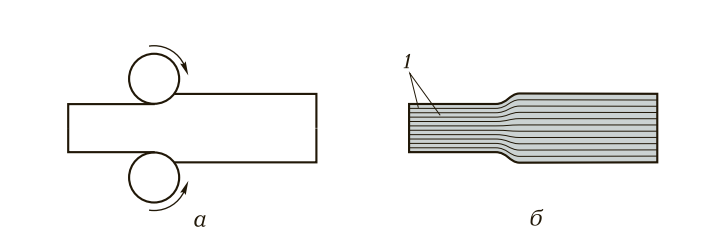
Рис. 4. Схема деформации металлов и сплавов (прокатка): а — деформация; б — скольжение металлов по кристаллографическим плоскостям в процессе деформации; 1 — кристаллографические плоскости
В процессе деформации металла при прокатке происходит не только изменение поперечных и продольных размеров заготовок, но и изменение микроструктуры металла.
Зерна под действием давления прокатных валков искажаются, приобретая продолговатую или пластинчатую форму, а затем преобразуются в волокна. Изменение микроструктуры металла в процессе деформации условно показано на рис. 5.
Процесс кристаллизации. Рассмотрим, как происходит образование кристаллов у чистых металлов. Установлено, что процесс кристаллизации металлов из жидкого состояния в твердое идет в две стадии:
- образование центров кристаллизации;
- рост кристаллов вокруг этих центров (рис. 6).
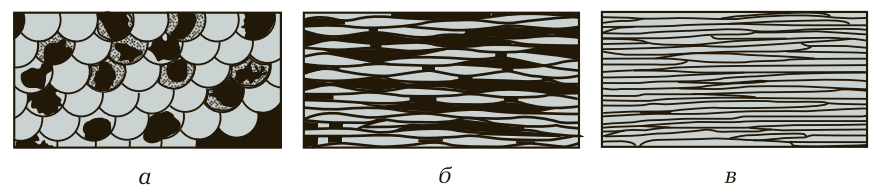
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — микроструктура металла до деформации; б — микроструктура металла после первой операции деформации; в — микроструктура металла после окончательной деформации
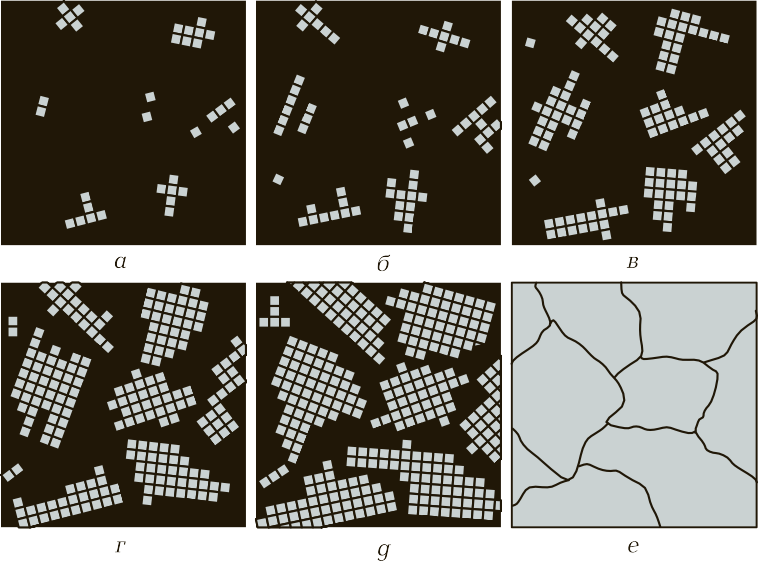
Рис. 6. Процесс кристаллизации металлов и сплавов: а — е — последовательные этапы процесса
Далее вновь появляются новые центры, и происходит рост твердой фазы вокруг первичных и вторичных центров. Процесс происходит до того момента, пока образованные таким образом кристаллы не будут соприкасаться друг с другом и не будет наличия жидкой фазы металла (см. рис. 6, г — е). Когда образование кристалла идет в жидкой фазе (в расплавленном металле), он будет иметь правильную форму, т. е. состоять из определенных геометрических фигур правильной формы. Когда кристаллы начинают соприкасаться друг с другом, а процесс затвердевания еще не закончен, тогда происходят искажения формы зерен. В практике замечено, что когда идет быстрое охлаждение, образуются мелкие зерна — мелкозернистая структура. При медленном охлаждении появление новых центров кристаллизации замедляется, но происходит рост зерна вокруг первичных центров кристаллизации. В этом случае металл будет иметь крупнозернистую структуру.
Процесс образования кристаллов в жидком состоянии и перехода металла в твердое состояние называется первичной кристаллизацией. Величина и форма зерна влияет на механические свойства металлов. Чем зерна мельче и чем правильнее их форма, тем большую твердость и прочность будет иметь металл. Чем зерна больше и чем искаженнее их форма, тем ниже твердость и прочность металла.
Аллотропия металлов. Такие металлы, как железо, кобальт, никель и др., обладают способностью изменять кристаллическую решетку при нагревании в твердом состоянии. Процесс изменения кристаллических решеток в твердом состоянии называется вторичной кристаллизацией, или аллотропией, а состояние вещества (металла) при наличии нескольких кристаллических решеток при изменении параметров (давления, температуры) — аллотропическими модификациями, или полиморфизмом. Такие металлы, как железо, молибден, вольфрам, литий в твердом состоянии при нормальной температуре имеют объемно-центрированную кубическую ячейку; алюминий, медь, серебро в твердом состоянии при нормальной температуре имеют форму гранецентрированной кубической ячейки.
На рис. 7 представлены кривые нагрева и охлаждения металла (на примере марганца). Аллотропные состояния (модификации), имеющие те или иные кубические ячейки, обозначаются греческими буквами. Первоначальное аллотропное состояние при нормальной температуре обозначается буквой α, при дальнейших повышении температуры и перекристаллизации металла — буквами β, γ, δ и т. д. При охлаждении металлов и сплавов процесс аллотропного превращения происходит в обратном порядке, как правило при тех же температурах.
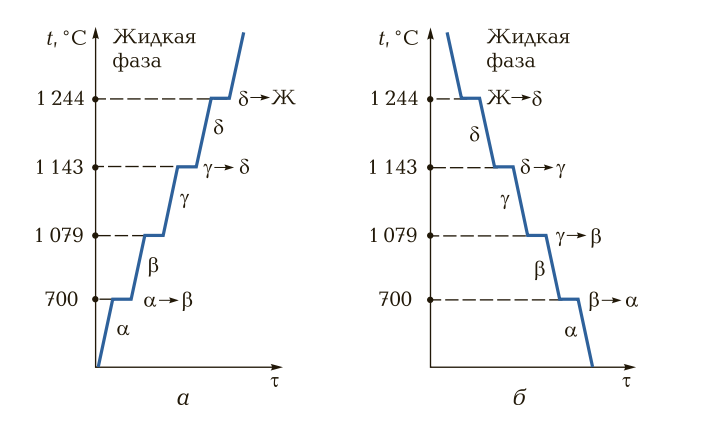
Рис. 7. Кривые нагрева (а) и охлаждения (б) марганца: t — температура; τ — время
Общие сведения о металлах
Дисциплина «Материаловедение и технология конструкционных материалов» состоит из двух основополагающих при подготовке инженера технических дисциплин.
Первая из них – материаловедение. Это наука, изучающая взаимосвязь между составом, строением и свойствами материалов, применяемых в технике.
Цель преподавания материаловедения – дать знания о строении, физических, механических и технологических свойствах металлов и неметаллических материалов, а также о возможности управления свойствами материалов через упрочняющую или разупрочняющую обработку.
Вторая дисциплина – технология конструкционных материалов – дает знания о современных методах обработки материалов, т. е. о том, как получают заготовки и детали машин заданной формы и размеров. Она включает основы металлургии, обработку металлов давлением и резанием, получение заготовок литьем и сваркой, а также формирование поверхностей современными электрофизическими способами.
Взаимосвязь двух этих отраслей знаний очевидна: новые материалы порождают новые технологии и целые новые отрасли.
Главной задачей материаловедения является создание материалов с заранее
рассчитанными свойствами применительно к заданным параметрам и условиям работы.
Большое внимание уделяется изучению металлов в экстремальных условиях (низкие и
высокие температуры и давление).
Важное значение имеет устранение отставания нашей страны в области использования новых материалов взамен традиционных (металлических)-пластмасс, керамики, материалов порошковой металлургии, особенно композиционных материалов, что экономит дефицитные металлы, снижает затраты энергии на производство материалов, уменьшает массу изделий.
Расчетами установлено, что замена ряда металлических деталей легкового автомобиля на углепластики из эпоксидной смолы, армированной углеродными волокнами, позволит уменьшить массу машины на 40%; она станет более прочной; уменьшится расход топлива, резко возрастет стойкость против коррозии.
Знания основ материаловедения необходимы каждому инженеру, работающему в области создания и эксплуатации современных машин. Лишь зная свойства материалов, можно научно обоснованно выбрать их для того или иного использования, правильно спроектировать технологический процесс их обработки с высокими технико-экономическими показателями.
Общие сведения о металлах
Металлы—простые вещества, обладающие высокой тепло- и электропроводностью, ковкостью, металлическим блеском, непрозрачностью и другими свойствами, характерными для металлов. Металлы и сплавы на их основе обладают комплексом механических, физических, химических и технологических свойств, обеспечивающих широкое их применение в различных отраслях техники. Все металлы условно делят на черные (железо и сплавы на его основе — сталь, чугун) и цветные (все остальные).
Металлы – один из классов конструкционных материалов, характеризующийся определенным набором свойств:
Понятие о металлах и сплавах
Из всех известных в настоящее время элементов более половины являются металлами. Металлы — непрозрачные вещества, обладающие специфическим металлическим блеском, пластичностью, высокой теплопроводностью и электропроводностью.
Файлы: 1 файл
Курсовая прокатчика.doc
Понятие о металлах и сплавах.
Из всех известных в настоящее время элементов более половины являются металлами. Металлы — непрозрачные вещества, обладающие специфическим металлическим блеском, пластичностью, высокой теплопроводностью и электропроводностью. По этому признаку металлы легко отличить от других веществ (дерево, стекло и т. д.).
Все металлы и образованные из них сплавы делят на черные (к ним относят железо и сплавы на его основе, на их долю приходится около 95 % производимой в мире металлопродукции) и цветные. В технике принята условная классификация, по которой металлы делят на группы:
- легкие — алюминий (Al),магний (Mg);
- тяжелые — медь (Си), свинец (Рb);
- тугоплавкие — вольфрам (W), молибден (Мо);
- благородные — золото (Аu), платина (Pt);
- рассеянные — гадолиний (Gd), индий (In), таллий (Tl);
- редкоземельные — скандий(Sc), иттрий (Y);
- радиоактивные — радий (Ra), уран (U).
Понятие „чистый металл” весьма условно. Любой чистый металл содержит примеси, а поэтому его следует рассматривать как сплав. Под термином „чистый металл” понимается металл, содержащий 0,010-0,001% примесей. Современная металлургия позволяет получать металлы высокой чистоты (99,999%). Однако примеси даже в малых количествах могут оказывать существенное влияние на свойства металла.
Чистые металлы обладают низкой прочностью и не обеспечивают требуемых физико-механических и технологических свойств. Поэтому их применение в технике в качестве конструкционных материалов ограничено. Наиболее широко применяют сплавы, которые обладают по сравнению с чистыми металлами более высокой прочностью и твердостью.
Сплавы — твердые и жидкие вещества — получают сплавлением или спеканием двух или более металлов или металлов с неметаллами. Элементы, образующие сплав, называют компонентами. Сплавы могут состоять из двух или большего числа компонентов. Строение металлического сплава более сложное по сравнению с чистым металлом.
Для рассмотрения строения, превращений и свойств металлов и сплавов введем понятие „фаза” и „структура”.
Фазой называется однородная часть системы (металла или сплава), имеющая границы раздела, при переходе через которые их свойства резко меняются.
Например, жидкий металл является однофазной системой; смесь жидкого металла и твердых кристалликов — двухфазной системой, так как свойства жидкого металла значительно отличаются от свойств твердых кристалликов. Фазами могут быть отдельные металлы, их химические соединения, а также растворы на основе металлов.
Под структурой понимается строение металла, т.е. взаимное расположение различных фаз, форма и размер составляющих их кристаллов.
Структурными составляющими сплава называются обособленные части сплава, имеющие одинаковое строение с присущими им характерными особенностями. Структурные составляющие могут состоять из одной, двух или более фаз.
Одна из важнейших задач металловедения — определение связи между структурой и свойствами.
Кристаллические решетки.
В кристаллических веществах, к которым относятся все металлы, находящиеся в твердом состоянии, атомы занимают вполне определенное место, образуя пространственную решетку. Элементарная (наименьшая) ячейка этой решетки у каждого кристаллического вещества имеет свое, строго определенное строение и размеры (параметры). По „узору” и числу атомов в элементарной ячейке различают несколько типов атомных решеток.
У металлов чаще всего наблюдаются решетки следующих типов:
- кубическая объемноцентрированная (α-железо, вольфрам, молибден, β-титан и др.),
- кубическая гранецентрированная (γ-железо, алюминий, золото, медь, серебро, свинец и др.),
- гексагональная (бериллий, кадмий, магний, α-титан, цинк, γ-хром и др.).
Элементарная ячейка объемноцентрированной кубической (о.ц.к.) решетки образована девятью атомами, восемь из которых расположены на вершинах воображаемого куба, а девятый — в его центре (рис. 1,а).
Элементарная ячейка гранецентрированной кубической (г.ц.к.) решетки имеет более плотную упаковку и содержит 14 атомов — восемь расположены на вершине куба и шесть на пересечении диагоналей его граней (рис. 1,б).
Элементарная ячейка гексагональной решетки представляет собой гексаэдр (шестигранную призму), в центре основания которого и вершинах углов расположены атомы; кроме того, три атома находятся внутри гексаэдра. Всего ячейка содержит 17 атомов (рис. 1, в).
В элементарной ячейке кристаллической решетки можно выделить ряд характерных, так называемых кристаллографических плоскостей. В зависимости от ориентации плоскость может пересекать большее или меньшее количество атомов. В кубической о.ц.к. решетке наибольшее число атомов пересекает плоскость, проходящую по диагонали куба (рис. 1,г), в кубической г.ц.к. решетке — через диагонали граней и диагональ куба (рис. 1, д) в гексагональной — через его основание. Последняя плоскость называется базисной плоскостью.
В результате повторений элементарной ячейки в трех измерениях образуется тело кристалла с однообразно ориентированной атомной решеткой. Внешняя форма кристалла или, как его часто называют, монокристалла зависит от строения элементарной ячейки и условий кристаллизации, т.е. от образования кристаллов при переходе из жидкого состояния в твердое.
Кристаллы правильной формы встречаются в природе довольно часто. Они наблюдаются у поваренной соли, кварца, льда (снежинок) и других неметаллических веществ. Монокристаллы металла можно вырастить только искусственно в специальных условиях.
Рис. 1. Основные типы элементарных ячеек, образующих кристаллические решетки металлов, и положение кристаллографических плоскостей, наиболее плотно усеянных атомами.
Если измерить в различных направлениях физические свойства монокристалла, то окажется, что они будут сильно зависеть от выбранного направления, т.е. монокристалл обладает ярко выраженной анизотропией свойств. При испытании образцов, вырезанных из кристалла меди, было обнаружено, что в зависимости от направления их вырезки прочность образцов изменялась от 140 до 350 МПа, а относительное удлинение — в пять раз; изменялись также электро- и теплопроводность и другие свойства. Это объясняется тем, что в зависимости от избранного направления вырезки образцы совпадали с той или иной кристаллографической плоскостью, имеющей разную плотность атомов.
Известно, что атомы твердых тел совершают тепловые колебания. С ростом температуры кристаллического тела амплитуда колебаний атомов возрастает и при температуре плавления настолько увеличивается, что разрушается кристаллическая решетка — металл плавится.
Внешний вид металлического изделия не создает впечатления о металле, как о кристаллическом теле, так как металл, затвердевающий в обычных условиях, превращается не в монокристалл, а в массу, состоящую из большого количества отдельных кристалликов, ориентированных по отношению друг к другу по-разному, называемую поликристаллом. Поэтому физические свойства металла в целом одинаковы во всех направлениях.
В металлах всегда присутствует то или иное количество посторонних примесей. При кристаллизации примеси мешают правильному росту кристаллов, и форма их искажается. Такие кристаллы обычно называют кристаллитами или зернами.
Чтобы увидеть внутреннее строение металла, необходимо тщательно отполировать срез небольшого металлического образца, затем полированную поверхность протравить, т.е. обработать специально подобранными для данного металла химическими растворами. Растворы — смеси кислот или щелочей, взаимодействуя либо с самими кристаллами, либо с межкристаллитным веществом, выявляют структуру металла (рис. 2, а).
Рис. 2. Структура чистого металла и сплавов.
Значительно более сложное строение имеют кристаллиты сплавов двух или нескольких металлов. Температура плавления отдельных металлов неодинакова, поэтому температура плавления смеси зависит от соотношения массы компонентов. При кристаллизации сплавов первыми начинают выпадать из расплава самые тугоплавкие частицы, в состав которых в большинстве своем входят металлы, имеющие наиболее высокую температуру плавления. На первичных частицах нарастают вторичные, менее тугоплавкие и т.д. Кристаллит развивается, как дерево — сначала ствол, затем ветви — все тоньше и тоньше. Поэтому такие кристаллиты называют дендритами (от латинского названия дерева). По мере кристаллизации в твердом состоянии оказывается все больше тугоплавких составляющих сплава, а жидкость, окружающая кристаллиты (межкристаллитное вещество), становится все более легкоплавкой, поэтому она твердеет в последнюю очередь. На (рис. 2, б), представлена микрофотография структуры сплава. Следовательно, межкристаллитное вещество, обволакивающее каждый кристаллит и спаивающее их все в одно целое, кристаллизуется в самую последнюю очередь. При нагревании, наоборот, межкристаллитное вещество плавится в первую очередь, затем, при повышении температуры, начинают переходить в жидкое состояние части кристаллитов в порядке, обратном кристаллизации, т.е., если чистые металлы плавятся при строго определенной температуре, сплавы плавятся в интервале температур.
При сплавлении двух металлов могут быть три характерных случая:
1. Оба металла неограниченно растворяются друг в друге при любых температурах, например медь и никель, золото и серебро. Такие сплавы обладают высокой пластичностью и хорошо обрабатываются давлением в горячем и даже холодном состоянии, но плохо обрабатываются резанием — под резцом образуется длинная вьющаяся стружка, возникают налипы.
2. Металлы растворяются друг в друге в твердом состоянии ограниченно, причем наиболее часто степень растворимости очень сильно зависит от температуры. Например, при постепенном добавлении к меди цинка он сначала целиком растворяется, а по достижении содержания цинка более 40 % образуются совершенно новые кристаллы — с другой решеткой, возникает новая фаза, т.е. сплав становится двухфазным (рис. 2, в). Физико-химические свойства фаз, как правило, весьма различны, имеют разную твердость, пластичность и т.д. У двухфазных сплавов обычно более низкие пластические свойства, чем у однофазных, они хуже обрабатываются давлением, но лучше резанием.
3. Металлы, кроме растворов, образуют химические соединения. Например, в сплаве меди с оловом Cu3Sn химическое соединение выступает как самостоятельный компонент сплава, а его количество зависит от соотношения основных металлов.
Химические соединения, имеют очень высокую твердость, превосходящую твердость основных компонентов в десятки раз. Известны химические соединения, например карбиды вольфрама, молибдена или титана, твердость которых приближается к твердости алмаза. Технологические свойства подобных сплавов зависят от количества интерметаллических включений, а главное — от их формы. Например, включения в виде игл и пластинок способствуют разрушению кристалла при деформации.
Реальная кристаллическая решетка металла не является неподвижной конструкцией. Все составляющие ее частицы находятся в непрерывном движении: движутся оторванные от атомов электроны, обеспечивая межатомную металлическую связь и электрическую проводимость, около своих средних положений совершают колебательные движения атомы; время от времени тот или иной атом при превышении определенного энергетического уровня начинает перемещаться по кристаллу, нарушая правильность кристаллической решетки. Такие нарушения вызывают и "чужеродные" атомы — атомы примесей, которые внедряются в решетку при кристаллизации. Мельчайшие пузырьки газа, трещинки, включения неметаллических примесей ослабляют кристаллическую решетку, делают ее несовершенной, тем самым, изменяя и свойства металлов и сплавов.
1. Общая характеристика элементов металлов
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.


В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
В атомах металлов главных подгрупп валентные электроны располагаются на внешнем энергетическом уровне, а у металлов побочных подгрупп — ещё и на предвнешнем энергетическом уровне.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны.
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .
Читайте также:
