Опорный конспект щелочноземельные металлы
Обновлено: 20.09.2024
Единственный путь, ведущий к знанию, – это деятельность.
ХОД УРОКА
1. Игровая пятиминутка (для активизации мыслительной деятельности учащихся).
- Этот металл используют для металлотермии – восстановления редких металлов из их руд.
- Сульфат данного элемента, известный под названием горькой, или английской, соли, используется в медицине в качестве слабительного средства.
- Морская соль имеет горький вкус из-за наличия в ней катионов данного металла.
- Сжигание данного металла сопровождается ослепительной вспышкой, поэтому его раньше применяли при фотографировании.
- В его атоме на внешнем уровне два электрона, все электроны размещены на трёх энергетических уровнях.
- Вследствие высокой химической активности этот металл не пригоден для изготовления изделий.
- В организме взрослого человека содержится более 1 кг данного элемента в виде фосфата.
- Этот металл был впервые получен Г. Дэви в 1808 г.
- Соединения этого элемента широко используется, например, в строительстве. Мел, мрамор, известняк- это его карбонат.
- В его атоме на внешнем уровне два электрона, все электроны размещены на четырёх энергетических уровнях.
3. Проверка знаний и умений учащихся.
| 1. Кальций отличается по физическим свойствам от щелочных металлов. | а) Цветом; б) Плотностью; в) Твёрдостью; г) Температурой плавления. |
| 2. С кальцием реагирует. | а) CI2, P, Si; б) C, CI2,S; в) O2, H2, Fe. |
| 3. Водород можно получить при взаимодействии кальция с. | а) HCI б) CO2; в) H2O г) NaOH; д) H2SO4. |
| 4. У кальция электроны распределены по энергетическим уровням. | а) 2,8.8,3; б) 2,8,8,1; в) 2,8,8,2. |
| 5. Кальций проявляет свойства. | а) Окислительные; б) Восстановительные; в) Окислительные и восстановительные. |
Докажите это, составив уравнения соответствующих реакций (самостоятельная работа 5 минут).
Письменная работа проверяется на доске.
4. Изучение нового материала
Цель: обобщить и систематизировать знания о свойствах оксидов и гидроксидов металлов главной подгруппы II группы.
Учитель. Известно, что металлам соответствуют основные оксиды.
- Докажите, что оксид кальция – основный оксид, составив уравнения соответствующих реакций.
Самостоятельная работа (5 минут).
САМОПРОВЕРКА (на доске появляется слайд).
CaO + H2O = Ca(OH)2
CaO + CO2 = CaCO3
CaO + H2SO4 = CaSO4 + H2O
CaO – негашёная известь.
Учитель. Известно, что металлу соответствует основный оксид и основание.
Докажите, что гидроксид кальция – основание. Составьте уравнения соответствующих реакций.
Самостоятельная работа (5 минут)
Самопроверка (слайд на доске)
Ca(OH )2 + CO2 = CaCO 3 + H2O
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Ca(OH)2 + CuSO4 = Cu(OH) 2 + CaSO4
Ca(OH)2 – гашёная известь.
Учитель. В каком же виде встречаются щелочноземельные металлы в природе?
Презентация “Соединения щелочноземельных металлов в природе”. (Составляет ученик к уроку заранее).
5. Кодированный диктант.
- Оксиды проявляют основные свойства, кроме бериллия. (1)
- Все оксиды главной подгруппы II группы активны в реакции с водой. (0)
- Оксиды кальция в технике называют негашёной известью. (1)
- Для обнаружения углекислого газа используют раствор гидроксида кальция – известковую воду. (1)
- Карбонат бария – основная часть минералов: мела, мрамора, известняка.(0)
Учащиеся проводят взаимопроверку работ.
- У меня вызвало затруднение на уроке .
- Мне удалось .
- Я узнал(а), что .
Опорный конспект щелочноземельные металлы
Ключевые слова конспекта: щелочноземельные металлы, элементы IIA-группы, земли, получение щелочноземельных металлов.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ IIA ГРУППЫ
К щёлочноземельным металлам относят кальций Са, стронций Sr, барий Ва, радий Ra – металлы IIА-группы. Название «щёлочноземельные» обусловлено тем, что гидроксиды этих металлов относятся к щелочам – растворимым в воде основаниям, а оксиды этих металлов с древних времён называли землями. Бериллий и магний к щёлочноземельным металлам не относятся.
Важнейшие параметры элементов IIA группы приведены в таблице:
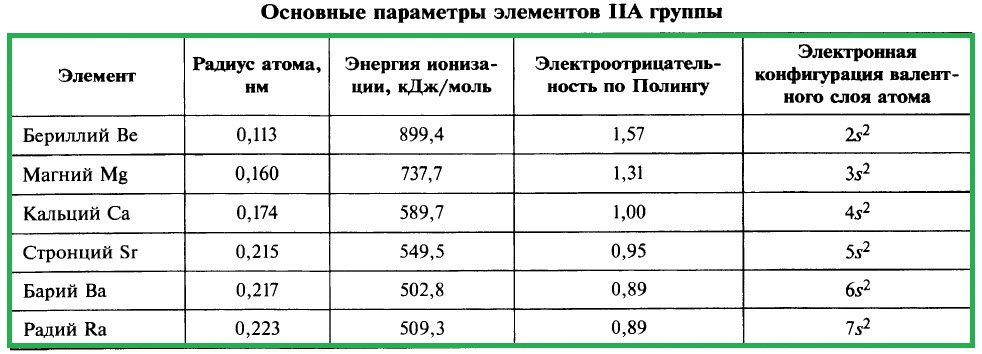
Электронная конфигурация валентного слоя атомов щёлочноземельных металлов в стационарном состоянии ns 2 . Щёлочноземельные металлы являются s-элементами. Во всех своих соединениях они имеют степень окисления +2.
Высшие оксиды щёлочноземельных металлов имеют состав МеО и проявляют основный характер. Высшие гидроксиды этих элементов Ме(ОН)2 являются типичными основаниями, их относят к щелочам, хотя их растворимость намного ниже, чем гидроксидов щелочных металлов. Водородные соединения щёлочноземельных металлов представляют собой твёрдые гидриды состава МеH2.
ЩЁЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА
При обычных условиях щёлочноземельные металлы – твёрдые вещества, имеют металлический блеск на свежем срезе (быстро покрываются желтоватой плёнкой на воздухе), лёгкие (кроме радия), при этом более твёрдые, чем щелочные металлы. Кальций не режется ножом, он довольно твёрдый, стронций и барий мягче. Барий похож по твёрдости на свинец, но в отличие от него при разрезании крошится на отдельные кристаллы.
При внесении щёлочноземельных металлов или их соединений в бесцветное пламя появляется его характерная окраска:
Щёлочноземельные металлы являются активными восстановителями. Реакции с галогенами протекают легко даже при обычных условиях: При сгорании щёлочноземельных металлов на воздухе или в кислороде образуются оксиды:При нагревании на воздухе или в кислороде кальций загорается, пламя при этом имеет красноватый цвет.
Щёлочноземельные металлы взаимодействуют с серой при нагревании. Образуются сульфиды: При нагревании щёлочноземельные металлы реагируют с азотом с образованием нитридов (Са – при температуре красного каления): При нагревании щёлочноземельные металлы взаимодействуют с водородом с образованием твёрдых гидридов: Щёлочноземельные металлы легко взаимодействуют с водой с образованием щёлочи и водорода:Кальций с холодной водой реагирует сравнительно медленно, но с горячей водой реакция идёт бурно.
Щёлочноземельные металлы активно взаимодействуют с растворами солей, но происходит, как и в случае щелочных металлов, не замещение металла, входящего в состав соли, а реакция щёлочноземельных металлов с водой раствора.
Кальций и стронций получают электролизом расплавов хлоридов:Конспект урока по химии «Щелочноземельные металлы. Элементы IIA-группы». Выберите дальнейшее действие:
Урок 24. Щелочноземельные металлы. Важнейшие соединения щелочноземельных металлов их применение.
Конспект
К щелочноземельным металлам относят кальций, стронций, барий, радий.
Происхождение этого названия связано с тем, что их оксиды по терминологии алхимиков «земли», взаимодействуя с водой образуют щелочи.
Щелочноземельные металлы вместе с бериллием и магнием образуют II группу главную подгруппу в периодической системе химических элементов им. Д.И. Менделеева. На внешнем энергетическом уровне в атомах щелочноземельных металлов, как и у бериллия и магния, два s- электрона. Степень окисления в соединениях у всех металлов второй группы +2.
Щелочноземельные металлы серебристо-белого цвета, твердость значительно выше, чем у щелочных металлов. Радий – радиоактивный металл. Во влажном воздухе щелочноземельные металлы быстро покрываются налетом, состоящим из оксидов, карбонатов, нитридов. Поэтому/, как и щелочные металлы, в лаборатории хранят под слоем керосина или в запаянных ампулах.
Щелочноземельные металлы сильные восстановители и взаимодействуют с простыми и сложными веществами. Щелочноземельные металлы и их соединения окрашивают пламя: кальций – в коричнево-красный, стронций – в ярко-красный, барий – в желто-зеленый цвета.
Оксиды щелочноземельных металлов – твердые белые вещества. По химическим свойствам - типичные основные оксиды. Взаимодействуют с водой; с кислотными оксидами; с кислотами.
Гидроксиды щелочноземельных металлов твердые вещества белого цвета - типичные растворимые основания.
Познакомимся с гидроксидом кальция – широко используемым в народном хозяйстве. Гидроксид кальция называют по-разному в зависимости от способа получения.
Гашеную известь получают взаимодействием негашеной извести - оксида кальция – с водой. Добавив к гашеной извести воду и хорошо перемешав, получим известковое молоко. После отстаивания и фильтрования известкового молока получают прозрачный раствор известковой воды. Известковая вода – сильный электролит.
Сильно щелочная среда известкового молока обладает обеззараживающим действием. Это свойство используют для обработки стен хранилищ, стволов деревьев.
Взаимодействие с кислотным оксидом – углекислым газом лежит в основе приготовления строительных смесей на основе гашеной извести. Являясь типичным основанием гидроксид кальция взаимодействует с кислотами. Это свойство используют для понижения кислотности почв используют гидроксид кальция.
Для растворимых оснований характерно взаимодействие с хлором. Это свойство используется для получения хлорной извести.
Среди солей щелочноземельных металлов абсолютный лидер в применении - карбонат кальция.В природе он встречается в виде известняка, мела и мрамора. Являясь солью слабой угольной кислоты карбоната кальция используют в медицине, например, для снижения повышенной кислотности желудка. Мраморные скульптуры являются достоянием многих музеев и парков. Мрамор как отделочный материал используется в строительстве. Среди солей кальция широкое применение находит гипс. Различают: природный гипс, жженый гипс, безводный, алебастр, который получают нагреванием природного гипса. Используют гипс в строительстве, медицине, при изготовлении художественных изделий. Широкое применение находят соединения стронция и бария. Соединения стронция используют:в радиоэлектронике, металлургии, при изготовлении эмалей,в пиротехнике для получения красных огней.Соединения бария используют в сельском хозяйстве в качестве инсектицида, в пиротехнике, рентгенотехнике .и других областях.
Разработка урока по химии в 9 классе: "Щелочные и щелочноземельные металлы"

Тема урока: Щелочные и щелочно-земельные металлы, их соединения.
Цели и задачи урока:
Обучающая: Дать общую характеристику щелочных и щелочноземельных металлов;
Разобрать физические и химические свойства их соединений: оксидов, гидроксидов, солей;
Развивающая:
Повторить свойства основных оксидов и щелочей.
Воспитательная: формировать понимание роли химии в историческом развитии мира;
Здоровьесберегающие технологии: следить за осанкой учащихся; проводить упражнения для снятия напряжения глаз; проветривание помещения.
Оборудование: Периодическая система, видеосюжеты
Организационный момент.
Проверка д/з:
2. Классификация коррозии.
3. Способы защиты от коррозии.
4. Радец. Стр 82 задачи 7,8
Основная часть.
Строение атомов щелочных металлов.
№3 Li - литий
3Li К L
Литий +3 ) ) 1s 2 2s 1 2р 0 2s 2р
№ 11 Nа - натрий
11Nа К L М 3s 3р
Натрий +11 ) ) ) 1s 2 2s 2 2р 6 3s 1 3р 0 3d 0 2s 2р
в группе сверху вниз восстановительные свойства усиливаются
У элементов II группы главной подгруппы на внешней орбитали по 2 ē.

№4 Be - бериллий
4Be К L 2р
Бериллий +4 ) ) 1s 2 2s 2 2р 0 2s
Физические свойства.
Щелочные металлы – серебристо-белые мягкие вещества, с металлическим блеском, легкие, легкоплавкие, плотность возрастают от Li к Cr, t пл уменьшается.
Be, Mg, Ca, Sr, Ba – серебристо-белые металлы, тверже, чем щелочные металлы, покрываются оксидной пленкой.
Химические свойства:
2Na 0 + Н2 0 = 2Na +1 H -1
2ē гидрид натрия
2Na 0 + Cl2 0 = 2Na +1 Cl -1
2ē хлорид натрия
2Na 0 + S 0 = Na2 + 1 S - 2
2ē сульфид натрия
с кислородом
2ē пероксид натрия
2ē пероксид калия
4Li 0 + O2 0 = 2Li2 +1 O -2
с водой - опыт
2Na 0 + 2Н +1 OH= 2Na +1 OH + H2 0 ↑
2ē гидроксид натрия
Соединения щелочных металлов: Ме2О; МеОН; соли
а) Оксиды – основные, взаимодействуют с
3) с кислотами Na2O + 2HCl = 2NaCl +H2O
б) Гидроксиды – щелочи, взаимодействуют с
1) с кислотными оксидами
2) с кислотами – реакция нейтрализации
NaOH + HCl = NaCl +H2O
3) с солями (если ↓ или ↑)
4) с амфотерными оксидами, гидроксидами
Na2CO3 – карбонат натрия (сода)
Na2CO3 ∙ 10 H2O – кристаллическая сода
NaHCO3 - пищевая сода
NaCl - поваренная соль
Химические свойства щ-з металлов: такие же как у щелочных металлов
с кислородом Сa, Mg имеют способность восстанавливать редкие
с хлором металлы из их оксидов:
с серой 3Mg 0 + Mo +6 O3 = 3Mg +2 O + Mo 0
с азотом 6ē
Соединения щелочно-земельных металлов: соли
а) Оксиды – Ме +2 О – твердые, тугоплавкие, проявляют основные свойства.
Получают обжигом карбонатов: CaCO3 = CaO + CO2↑
б) Гидроксиды – Ме +2 (ОН)2 – от Ca(ОН)2 до Вa(ОН)2 растворимость повышается, их относят к щелочам.
Получают взаимодействием оксидов с водой: CaO + H2O = Ca(ОН)2
CaCO3 – мел, мрамор, известняк
MgSO4 – английская соль
CaO – негашеная известь
MgO – жженая магнезия
Ca(ОН)2 – гашенная известь (известковая вода, известковое молоко)
Закрепление: ЦОРы
Д/з: §14,15 упр 1,2,5 стр 94-96, упр 3,5 стр 106-107
Список использованной литературы
1. О.С.Габриелян «Химия 9 класс – изд. «Дрофа». 2014 г.
Щелочноземельные металлы (9-й класс)
Тип урока: изучение нового материала.
Вид урока: комбинированный урок
Задачи урока:
Обучающие: формирование знаний учащихся о щелочноземельных элементах как типичных металлах, понятия о взаимосвязи строения атомов со свойствами (физическими и химическими).
Развивающие: развитие умений исследовательской деятельности, умения добывать информацию из различных источников, сравнивать, обобщать, делать выводы.
Воспитывающие: воспитание устойчивого интереса к предмету, воспитание таких нравственных качеств как аккуратность, дисциплина, самостоятельность, ответственное отношение к порученному делу.
Методы: проблемные, поисковые, лабораторная работа, самостоятельная работа учащихся.
Оснащение: компьютер, таблица по технике безопасности, диск “Виртуальная лаборатория по химии”, презентация.
Ход урока
1. Организационный момент.
2. Вводное слово учителя.
Мы изучаем раздел, металлы, и вы знаете, что металлы имеют большое значение в жизни современного человека. На предыдущих уроках мы познакомились с элементами I группы главной подгруппы – щелочными металлами. Сегодня приступаем к изучению металлов II группы главной подгруппы - щелочноземельных металлов. Для того чтобы усвоить материал урока, нам необходимо вспомнить наиболее важные вопросы, которые рассматривали на предыдущих уроках.
3. Актуализация знаний.
- Где находятся щелочные металлы в периодической системе Д.И. Менделеева?
- В периодической системе щелочные металлы расположены в I группе главной подгруппе, на внешнем уровне 1 электрон, который щелочные металлы легко отдают, поэтому во всех соединениях они проявляют степень окисления +1. С увеличением размеров атомов от лития к францию энергия ионизации атомов уменьшается и, как правило, возрастает их химическая активность.
- Физические свойства щелочных металлов?
- Все щелочные металлы серебристо-белого цвета с незначительными оттенками, лёгкие, мягкие и легкоплавкие. Их твёрдость и температура плавления закономерно снижаются от лития к цезию.
- Знания Химических свойств щелочных металлов проверим в виде небольшой проверочной работы по вариантам:
- Iвариант: Напишите уравнения реакции взаимодействия натрия с кислородом, хлором, водородом, водой. Укажите окислитель и восстановитель.
- I I вариант: Напишите уравнения реакции взаимодействия лития с кислородом, хлором, водородом, водой. Укажите окислитель и восстановитель.
- I I I вариант: Напишите уравнения реакции взаимодействия калия с кислородом, хлором, водородом, водой. Укажите окислитель и восстановитель.
Учитель: Тема нашего урока “Щелочноземельные металлы”
Задачи урока: Дать общую характеристику щелочноземельным металлам.
Рассмотреть их электронное строение, сравнить физические и химические свойства.
Узнать о важнейших соединениях этих металлов.
Определить области применения этих соединений.
- Наш план урока написан на доске, будем работать соответственно плана, просмотрим презентацию.
- Положение металлов в периодической системе Д.И. Менделеева.
- Строение атома щелочных металлов.
- Физические свойства.
- Химические свойства.
- Применение щелочноземельных металлов.
Исходя, из полученных ранее знаний ответим на следующие вопросы: Для ответа воспользуемся периодической системой химических элементов Д.И. Менделеева .
1. Перечислите щелочноземельные металлы
- Это магний, кальций, стронций, барий, радий.
2. Почему данные металлы назвали щелочноземельными?
Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название "земли"
3. Расположение щелочноземельные металлы в ПСХЭ Д.И. Менделеева.
- II группа главная подгруппа. У металлов II группы главной подгруппы на внешнем энергетическом уровне содержится по 2 электрона, находящихся на меньшем удалении от ядра, чем у щелочных металлов. Поэтому их восстановительные свойства хотя и велики, но все же менее, чем у элементов I группы. Усиление восстановительных свойств также наблюдается при переходе от Mg к Ba, что связано с увеличением радиусов их атомов, во всех соединениях проявляют степень окисления +2.
Учитель: Физические свойства щелочноземельных металлов?
- Металлы II группы главной подгруппы - это серебристо-белые вещества, хорошо проводящие тепло и электрический ток. Плотность их возрастает от Be к Ba, а температура плавления, наоборот, уменьшается. Они значительно тверже щелочных металлов. Все, кроме бериллия, обладают способностью окрашивать пламя в разные цвета.
Проблема: В каком виде щелочноземельные металлы встречаются в природе?
Почему в природе щелочноземельные металлы в основном существуют в виде соединений?
Ответ: В природе щелочноземельные металлы находятся в виде соединений, потому что обладают высокой химической активностью, которая в свою очередь, зависит от особенностей электронного строения атомов (наличие двух неспаренных электронов на внешнем энергетическом уровне)
Физкультминутка – отдых глазам.
- Зная общие физические свойства, активность металлов, предположите химические свойства щелочноземельных металлов. С какими веществами взаимодействуют щелочные металлы?
- Щелочноземельные металлы взаимодействуют как с простыми веществами, и сложными. Активно взаимодействуют почти со всеми неметаллами ( с галогенами, водородом, образуя гидриды). Из сложных веществ с водой – образуя растворимые в воде основания – щелочи и с кислотами.
- А теперь на опытах убедимся, в правильности наших предположениях о химических свойствах щелочноземельных металлов.
4. Лабораторная работа по виртуальной лаборатории.
Цель: провести реакции, подтверждающие химические свойства щелочноземельных металлов.
Повторяем правила техники безопасности для работы со щелочноземельными металлами.
Читайте также:
