Определение эквивалентной массы металла
Обновлено: 19.05.2024
Цель работы: определить эквивалент и молярную массу неизвестного металла.
Оборудование и реактивы: бюретка, двурогая пробирка, уравнительный цилиндр, соединительные резиновые трубки, термометр, барометр, аналитические весы, стеклянные стаканы, неизвестный металл, неизвестная кислота неизвестной концентрации.
Теоретическая часть:
Для определения эквивалента металла собирают прибор из двурогой пробирки, бюретки и уравнительного цилиндра (Рис 1).
Практическая часть:
1) Собрали установку (рис.1);
2) Заполнили бюретку водой так, чтобы при выравнивании менисков воды в бюретке и цилиндре уровень воды в бюретке был на нулевом делении;
3) Перед каждым измерением проверяли прибор на герметичность;
4) Затем в одно из колен двурогой пробирки поместили кусочек неизвестного металла, известной массы. А в другое колено залили неизвестную кислоту, неизвестной концентрации;
5) Прилили кислоту к металлу. Для увеличения скорости реакции нагревали колено, в котором происходила реакция; (В это время выделяющийся водород вытеснял воду из бюретки);
6) Охлаждали прибор до комнатной температуры;
7) Опыт проводили 3 раза, с соблюдением всех правил;
8) Результаты занесли в таблицу:
| № опыта | m, г. | T, K | P, атм. | V(Н2)выд., мл. | Mэк, гр./экв. |
| 0,027 | 295,5 | 0,975 | 10,2 | 32,86 | |
| 0,027 | 295,5 | 0,975 | 10,4 | 32,26 | |
| 0,027 | 295,5 | 0,975 | 10,3 | 32,42 |
Если Ме одновалентный:
Me + HА МеА + 1/2Н2
Если же металл двухвалентный, то значение молярного эквивалента необходимо умножить на 2;
9) Оценим погрешность измерений:
x3= 32,42. n – число опытов, тогда n=3.
Х=σ ∙ τ, где τ2; 0,95 = 4, 3020
∆Х = 0,19,113 ∙ 4, 3020 = 0,82224
Mэк = ± ∆Х = (32,523±0,82224) (гр./экв.)
10) Получили в препараторской кусочек неизвестного металла и взвесили его на аналитических весах по принятой технологии. Масса металла равна массе гирек, лежавших на правой чаше весов: 100+20+20+5+2+1+2∙0,2 = 148,4 (грамма);
11) Поставили стакан с дистиллированной водой на песчаную баню, для того, чтобы вода нагрелась;
12) После того, как вода в стакане закипела, мы погрузили в неё кусочек металла так, чтобы он не касался стенок сосуда (подвесили на деревянную палочку), и кипятили в течении 30 минут;
13) В то время, как металл находился в кипящей воде, мы собрали калориметр – в толстостенный сосуд из нетеплопроводного материала поставили стеклянный стакан, и налили в него 300 мл. дистиллированной воды, а так как плотность воды составляет 1 гр./см 3 ., то масса воды равна 300 грамм. По показаниям термометра температура воды составила 25ºС, что равно 298K.
14) По истечению 30 минут металл из кипящей воды был помещён в калориметр так, чтобы металл не касался стенок сосуда. При этом за температуру металла мы приняли температуру кипящей воды, которая по показаниям термометра составила 98ºС или 371К.
15) Помешивая воду в калориметре мы наблюдали за показанием термометра, опущенного в стакан с металлом. Максимальная температура воды оказалась равна 26,5 ºС или 299,5К.
16) Измерили теплоёмкость металла:
М – масса воды в калориметре = 300 грамм = 0,3 кг.;
Т – начальная температура воды в калориметре = 298К;
T1 – температура воды в калориметре после погружения в неё горячего металла = 299,5K;
m – масса металла = 148,4 грамма = 0,1484 кг.;
T2 – температура горячего металла = 371K
Следовательно по закону Дюлонга – Пти, молярная масса равна 26/0,414 = 63 (г./моль).
Мы определили молярную массу металла двумя способами. С помощью закона эквивалентов мы получили значение молярного эквивалента металла, которое с учётом погрешностей составило 32,523±0,82224 (гр./экв.), а с помощью калориметра значение молярной массы металла 63 (г./моль). Примерное значение молярной массы металла приблизительно в два раза больше молярного эквивалента этого же металла, следовательно металл – двухвалентный. Тем самым, мы можем принять удвоенный молярный эквивалент металла за молярную массу металла: 65,046±1,64448 гр./моль. Два полученных значения приблизительно равны между собой. В периодической системе элементов Д.И. Менделеева находятся два элемента, молярные массы которых находятся в допустимых пределах нашего определения – это медь и цинк. Но в ряду активности металлов медь находиться правее водорода, следовательно реакция взаимодействия меди и кислоты невозможна. Таким образом, искомый металл – цинк, молярная масса которого 65 гр./моль. Как мы видим, наиболее точный результат даёт метод, связанный с определением эквивалента металла.
В препараторской мы убедились, что исследуемый металл – это действительно цинк.
Основные направления социальной политики: В Конституции Российской Федерации (ст. 7) характеризуется как.
Определение эквивалентной массы металла
Закон эквивалентов открыт в конце 18 века: вещества взаимодействуют между собой в количествах, пропорциональных их химическим эквивалентам. Для решения задач удобно пользоваться другой формулировкой: массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам)
- количество эквивалентов - количество эквивалентов
Химическим эквивалентом элемента (молярной массой эквивалента) называется такое его количество (моль), которое соответствует 1 моль атомов водорода (соединятся с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях). Химический эквивалент не является постоянной величиной, он зависит от валентности (степени окисления) элемента.
Молярная масса эквивалента (м э ) – это масса одного эквивалента (грамм/моль*экв, килограмм/моль*экв). Молярная масса эквивалента равна частному от деления молярной массы его атомов (А) на валентность (степень окисления) элемента (В) в данном соединении:
Например, молярная масса эквивалента серы в SO2 и SO3 соответственно равны 32/4 = 8 г/моль и 32/6 = 5.33 г/моль.
Эквивалентным объемом (л/моль, м 3 /моль) называется объем, занимаемый при данных условиях (Р, Т) 1 эквивалентов вещества. Значения эквивалентного объема вещества, находящегося в газообразном состоянии, можно найти, зная, что в молярном объеме любого газа, состоящего из одноатомных молекул, содержится 2 моля атомов и т.д. Так в 22.4 л Н2 содержится при нормальных условиях (Р0=760 мм рт.ст.=101325 Па; Т0 = 273 К) 2 моля атомов водорода. Поскольку эквивалент водорода равен 1 моль, то в 22.4 л Н2 содержится 2 эквивалента водорода; значит, эквивалентный объем водорода равен
22.4/2 = 11.2 л/моль = 11.2 * 10 -3 м 3 /моль.
Пример № 1.Определить эквивалента и эквивалентные массы элементов в соединениях HF, H2O, NH3, CH4.
Решение. В указанных соединениях с 1 моль атомов водорода соединяется 1 моль атомов фтора, 1/2 моль атомов кислорода, 1/3 моль атомов азота, 1/4 моль атомов углерода.
Следовательно, фактор эквивалентности фтора, кислорода, азота и углерода соответственно равны 1 моль, 1/2 моль, 1/3 моль, 1/4 моль. Исходя из молярных масс атомов этих элементов, определяем, молярную масса эквивалента фтора равна 19 г/моль, кислорода – 16 * 1/2 = 8 г/моль, азота – 14 * 1/3=4.67 г/моль, углерода – 12 * 1/4=3 г/моль.
Для определения молярной массы эквивалента не обязательно исходить из его соединения с водородом. Молярную массу эквивалента можно вычислить по составу соединения данного элемента с любым другим, молярная масса эквивалента которого известна.
Пример № 2.Вычислить молярную массу эквивалента металла, зная, что его хлорид содержит 79.78% хлора. Молярная масса эквивалента хлора равна 35.45 г/моль•экв.
Решение. Содержание металла в этом соединении составляет: 100 – 79.78=20.22%. Согласно закону эквивалентов: количество эквивалентов металла равно количеству эквивалентов хлора mме/ М э ме = mСl/ М э Сl, т.е.
20.22/ М э ме = 79,78/35.45 => М э ме=20.22•35.45/79.78=8.98 г/моль. Молярная масса эквивалента металла равена 8.99 г/моль.
Молярные массы эквивалентов химических соединений так же как молярные массы эквивалентов элементов могут иметь переменные значения. Это определяется характером превращения веществ.
Молярные массы эквивалентов оксидов в реакциях обмена:
где Моксида – молярная масса оксида; n – число атомов элемента;
В – валентность (степень окисления) элемента.
Пример № 3.Определить эквивалентные массы оксидов железа.
Решение. Железо образует три оксида FeO, Fe2O3, FeO3.
Молярные массы эквивалентов кислот в реакциях обмена:
где Мкислоты – молярная масса кислоты; nн – число атомов водорода, содержащихся в молекуле кислоты, способных замещаться на металл.
Пример№4.Определить молярную массу эквивалента и фактор эквивалентности H3PO4 в следующих реакциях:
Решение. Молярная масса H3PO4 равна 98 г/моль.
В реакции (1) количество nн атомов водорода, заместившихся на металл, равно 3, следовательно эквивалент Н3Р04 равен 1/3 моль, а эквивалентная масса ЭН3Р04 = 98/3 = 32.7 (г/моль).
В реакции (2) пн-2, следовательно, эквивалент Н3Р04 равен 1/2 моль, а эквивалентная масса Э = 98/2 = 49 (г/моль).
В реакции (3) пн= 1, следовательно, эквивалент Н3Р04 равен 1 моль, а эквивалентная масса Э = 98/1 = 98 (г/моль).
Молярные массы эквивалентов оснований в реакциях обмена:
где Mоснования – молярная масса основания; nон – валентность металла ли число гидроксильных групп в молекуле основания, способных заместиться на кислотный остаток.
Пример № 5.Определить молярную массу эквивалента и фактор эквивалентности Сu(ОН)2 в следующих реакциях:
Решение. Молярная масса Сu(ОН)2 равна 97.5 г/моль. В реакции (1) количество гидроксильных групп nон, заместившихся на кислотный остаток, равно 2, следовательно фактор эквивалентности Сu(ОН)2 равен 1/2 моль, а молярная масса эквивалента М э Сu(ОН)2 = 97.5/2 = 48.75 (г/моль).
В реакции (2) количество гидроксильных групп nон, заместившихся на кислотный остаток, равно 1, следовательно эквивалент Сu(ОН)2 равен 1 моль, а эквивалентная масса ЭСu(ОН)2 = 97.5/1 = 97.5(г/моль).
Эквиваленты солей в реакциях обмена:
где Мсоли – молярная масса соли; –число атомов металла; –валентность (степень окисления) металла.
Пример № 6.Определить молярную массу эквивалента сульфата алюминия.
Решение. Молярная масса сульфата алюминия Al(SO4)3 равна 342 г/моль. Следовательно, М э Al2(SO4)3 = 342/(2•3) = 57 г/моль.
Окислительно-восстановительные эквиваленты определяются путём деления молярной массы на число электронов, идущих на восстановление или окисление
где Мо(в) – молярная масса окислителя (восстановителя); nе – число электронов, идущих на окисление (восстановление).
Пример № 7.Чему равна молярная масса эквивалентна перманганата калия как окислителя, если это вещество в процессе реакции восстанавливается: 1) до сульфата марганца; 2) до диоксида марганца; 3) манганата калия?
Выполнение работы
Определение эквивалентной массы металла
Задание: Определить экспериментально эквивалентную массу металла (магния, цинка – по заданию преподавателя) по количеству выделившегося водорода в реакции взаимодействия металла с соляной кислотой
Вычислить ее теоретическое значение и относительную ошибку эксперимента.
Приборы и реактивы.Прибор для определения эквивалента металла (рис.1.1.). Аналитические весы. Термометр. Барометр. Мерный цилиндр на 25-50 мл. Стаканчик химический. Фильтровальная бумага. Навеска металла (химически чистого) около 0.04 – 0.05 г. Соляная кислота (10мас.% раствор).
Ход определения.
1. Налить через воронку в бюретку воду до нулевого деления. Плотно закрыть отверстие бюретки пробкой со стеклянной трубкой. В одну часть сосуда Ландольта поместить навеску цинка. Другую часть сосуда через воронку наполнить на две трети объема разбавленной (10мас.%) соляной кислотой. Присоединить сосуд к свободному концу трубки, соединенной с бюреткой.
2. Проверить герметичность прибора. Для этого опустить или поднять воронку вместе с кольцом на 10-15 см. Если уровень воды в бюретке не меняется, то прибор герметичен и можно приступать к опыту. Если уровень воды в бюретке меняется, то необходимо плотнее закрыть пробками бюретку и сосуд, снова проверить и т.д. Уровень воды V1 в бюретке до начала опыта записать с точностью до 0.1 мл.
3. Привести в контакт кислоту и металл, осторожно наклоняя сосуд Ландольта. После полного растворения металла выждать 5-7мин., чтобы содержимое сосуда охладилось. Затем установить на одной высоте уровень воды в бюретке и воронке. При этом внутри прибора создается давление, равное давлению наружного воздуха. Записать уровень воды V2 в бюретке после опыта.
4. Результаты эксперимента внести в журнал по форме:
Уровень воды в бюретке:
Объем водорода при нормальных условиях (н.у.) V0, мл………………
Температура опыта T = 273+t, K…………………………………………
Барометрическое давление P, мм рт.ст…………………………………..
Давление насыщенного водяного пара h, мм рт.ст. при температуре опыта……………………………………………………
Экспериментальная эквивалентная масса металла М э эксп, г/моль……….
Теоретическая эквивалентная масса металла М э теор, г/моль……………..
Относительная ошибка e, %.
Рис. 1.1.Прибор для определения эквивалента металла:
1) Бюретка для измерения объёма выделившегося водорода;
2) Сосуд Ландольта для проведения реакции;
3) Каучуковая трубка;
1. Подсчитать VН2, вытесненного водорода по разности уровней в бюретке:
2. Привести это объем к нормальным условиям:
Величину h посмотреть в справочнике. Поправку h вводят вследствие того, что общее давление на воду является суммой пропорциональных давлений водорода и воды.
3. Вычислить экспериментальную массу металла:
где - эквивалентный объем водорода, равный 11200 мл/моль.
4. Сравнить найденную экспериментальную эквивалентную массу металла с теоретически посчитанным Этеор = А/В, вычислив в процентах ошибку опыта:
3. Контрольные вопросы и задачи
1. Вычислить молярные массы эквивалентов следующих элементов:
а) магния, если известно, что при нагревании одного моль его в токе кислорода, масса увеличилась на 66.7%. Ответ: 11.9 г/моль;
б) олова, если при нагревании 0.9185 г его в токе кислорода образуется 1.166 г оксида олова. Ответ: 29.68 г/моль.
2. Определить молярную массу эквивалента элемента, если при восстановлении 1.3 г оксида этого элемента алюминием получилось 1.02г оксида алюминия, содержащего 47% кислорода. Ответ: 13.66г/моль.
3. Написать формулу соединения сурьмы с серой, если известно, что молярная масса атомов сурьмы равна 121.8 г/моль, эквивалентная масса ее - 40.6 г/моль, молярная масса атомов серы равна 32 г/моль, эквивалентная масса - 16 г/моль.
4. Определить молярные массы эквивалентов и факторы эквивалентности кислот и оснований в следующих реакциях:
5. Вычислить молярную массу эквивалента и фактор эквивалентности хромата калия К2СrO4 как окислителя, если К2СrO4 восстанавливается до КСrO2.
6. Определить молярную массу эквивалента металла, если 0.34*10 -3 кг его вытесняют из кислоты 56.94*10 -6 м 3 водорода при температуре 0°С и давлении 94643 Па. Ответ: 67.8 г/моль.
7. Определить молярную массу эквивалента металла в следующих соединениях:
8. Чему равен эквивалентный объем кислорода?
История государства Древнего Египта: Одним из основных аспектов изучения истории государств и права этих стран является.
Эталон единицы силы электрического тока: Эталон – это средство измерения, обеспечивающее воспроизведение и хранение.
Основные признаки растений: В современном мире насчитывают более 550 тыс. видов растений. Они составляют около.
Поиск по сайту
Отчёт по лабораторной работе № 1
Усвоить одно из основных химических понятий – понятие об эквиваленте – и научиться определять его количественное значение.
1. Наполнить водой кристаллизатор и бюретку (стеклянную трубку с делениями и краном для выпуска жидкости внизу). Проверить, плотно ли закрыт кран бюретки.
2. Закрыв верхнее отверстие пальцем, перевернуть бюретку и опустить ее в кристаллизатор с водой. Палец убрать под водой, при этом вода из бюретки не вытечет.
3. Закрепить бюретку в штативе. Уровень воды в ней не должен быть выше крайнего деления шкалы.
4. В колбу Вюрца (круглодонная колбас боковым отводом) при помощи мерного цилиндра отобрать 15-20мл соляной кислоты.
5. Вытереть насухо горло колбы фильтром.
6. Расположив колбу горизонтально, поместить в ее горло навеску металла и плотно закрыть колбу пробкой.
7. Стеклянную трубку бокового отвода колбы Вюрца соединить с расположенной под водой частью бюретки.
8. Отметить уровень жидкости в бюретке. Показания следует снимать по положению нижнего края вогнутого мениска жидкости при нахождении его на уровне глаз. Цифры на шкале бюретки – объем в миллилитрах, при снятии показаний необходимо учитывать, что бюретка со шкалой перевернута.
9. Перевести колбу в вертикальное положение, сбрасывая навеску металла в кислоту. В результате реакции выделяется водород, который вытесняет воду из бюретки. Во время протекания реакции не следует держать колбу в руках во избежание ее нагрева и искажения результатов теплового расширения.
10. Когда выделение пузырьков водорода прекратиться, отметить конечный уровень воды в бюретке.
11. При помощи полоски миллиметровой бумаги измерить высоту столба воды в бюретке от нижнего края мениска до уровня воды в кристаллизаторе.
12. По показания барометра и термометра определить атмосферное давление и температуру в лаборатории.
Экспериментальные данные:
Масса навески металла – mМе=0,0096 г
Объем соляной кислоты - VНCl=15 мл
Объем воды в бюретке в начале эксперимента – V1=13,3 мл
Объем воды в бюретке по окончании эксперимента – V2=4,3 мл
Объем выделившегося водорода – Vизм.=V1-V2=9 мл
Высота столба воды в бюретке h=170 мм
Атмосферное давление в лаборатории Pатм= 770 мм рт.ст
Температура в лаборатории Т=20 о С
Обработка экспериментальных данных:
1. Водород находиться в бюретке под давлением ниже атмосферного на величину давления водяного пара, а также разрежения, создаваемого за счет давления столба жидкости в бюретке. Поэтому давление водорода вычисляется по формуле:
где Р1 – давление столба воды в бюретке, Па, Р1=9,8hdaq, 9,8 – переводной коэффициент из мм вод.ст. в Па; daq плотность воды, daq=1 г/см 3 ; Р2-давление насыщенного водяного пара.
Pатм=770 мм рт.ст.=102410 Па
Р=102410-1666-2332,7=98411,3 Па.
2. .Массу выделившегося водорода mН вычисляют по уравнению Клапейрона-Менделеева:
где МН2 – молярная масса водорода, МН2=2г/моль; V – объем водорода, м 3 ; R – универсальная газовая постоянная, R=8,314 Дж/(моль·К).
V=9 мл=9·10 -6 м 3
Т=20 о С=293 К
3. Вычислить эквивалент металла по закону эквивалентов:
где ЭМ(Н) – эквивалентная масса водорода, ЭМ(Н)=1 г/экв.
4. Зная степень окисления,найти молярную массу металла и определить что это за металл:
где Z– степень окисления металла, Z=2
Данный металл – Магний.
5. Вычислить точное значение эквивалентной массы и металла и найти относительную погрешность эксперимента:

В данной лабораторной работе мной определена эквивалентная масса Магния. Погрешность измерений 2,27%,что говорит о том, что опыт проведен верно.
Основные идеи славянофильства: Славянофилы в своей трактовке русской истории исходили из православия как начала.
Лаба №1Определение эквивалентной массы металла
Цель работы: определение эквивалентной массы металла, которая находится методом вытеснения водорода из раствора кислоты.
Основные теоретические положения: эквивалентом вещества называется такое его количество, которое соединяется с одним молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Эквивалентной массой называется масса одного эквивалента вещества.
Формулы для вычисления, перечень символов: Согласно закону эквивалентов массы, вступающие в реакцию веществ, пропорциональны эквивалентам этих веществ:

, где М1 и М2 – массы реагирующих веществ, кг; Э1 и Э2 – их эквиваленты.
Эквивалентная масса элемента:
Э = А/n , где А – масса одного моля атомов элемента;
n – его валентность.
Методика эксперимента
Получили навеску опилок металла у преподавателя.
Перед началом опыта проверили сосуд на герметичность.
Подготовили эвдиометр для собирания водорода. Заполнили его до краев водой (с помощью стакана), зажали открытый конец пальцем и, перевернув, погрузили в чашку с водой.
С помощью мерного цилиндра отмерили 5 мл раствора соляной кислоты HCl (в объемном соотношении I:I), влили ее через воронку в пробирку так, чтобы не замочить стенки изнутри. Держа пробирку в слегка наклонном положении, поместили внутрь на сухую стенку навеску опилок металла в папирусной бумаге, закрыли пробирку пробкой и конец газоотводной трубки подвели под водой внутрь эвдиометра.
Атмосферное давление записали по показаниям барометра:
1 мм рт. ст. = 1, 333 · 10 2 Па
763 мм рт. ст. = 1001707,9 Па
Комнатную температуру зафиксировали ртутным термометром:
22 ºС + 273 = 295 К
Значение парциального давления водяных паров h при температуре комнаты нашли по таблице:
Объем полученного водорода Vt = 31 · 10 -6 привели к нормальным условиям:
;
V0 – объем выделившегося водорода при нормальных условиях (Т0 = 273 К, Р0 = 101325 Па), м 3
РН2 – парциальное давление водорода, Па;
Т – температура опыта.
Используя закон эквивалентов, рассчитали эквивалентную массу металла:
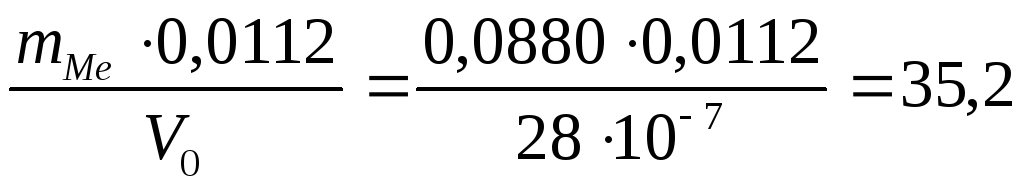
ЭМе = м 3 /моль
ЭМе – эквивалентная масса металла, кг/моль;
mMe – навеска металла, кг;
0,0112 – эквивалентный объем водорода при нормальных условиях, м 3 /моль.
11. Вычислим по соотношению Э = А/n теоретическую эквивалентную массу металла Эт
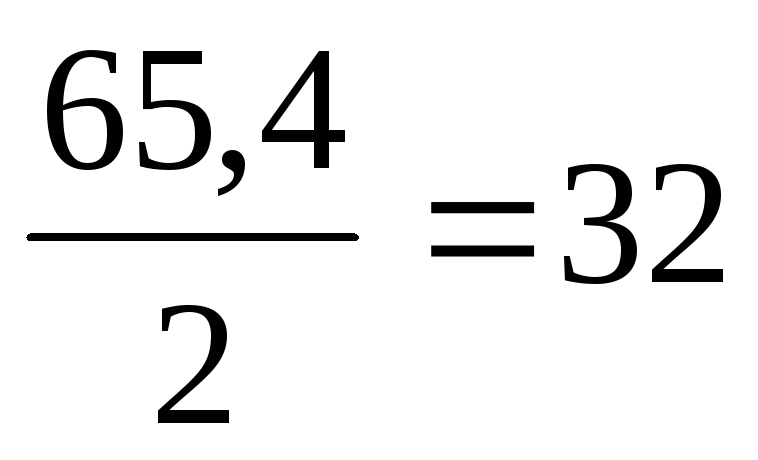
Эт (Zn) = м 3 /моль
12. Вычислим абсолютную и относительную погрешности в определении эквивалентной массы металла в процентах:
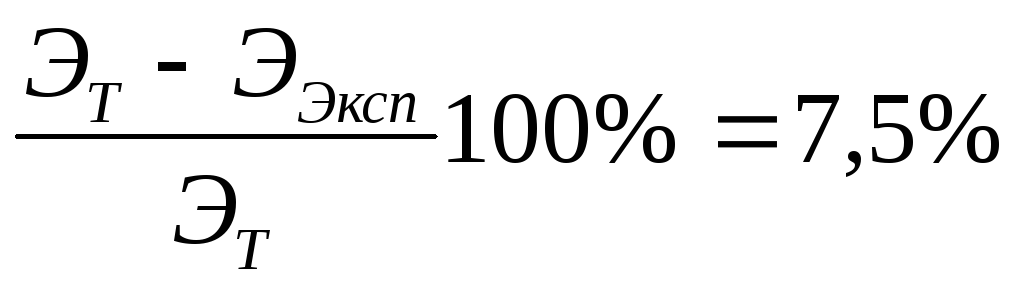
Уравнение химической реакции в молекулярном и ионном виде:
2 2 + H2
2Схема установки:
Рис 1. Схема установки: 1 – штатив; 2 – чашка с водой; 3 – эвдиометр; 4 – пробирка с газоотводной трубкой; 5 – деревянный штатив.
Читайте также:
