Получение металлов высокой чистоты
Обновлено: 04.10.2024
В ряде отраслей техники требуется получение металлов высокой степени чистоты. Например, для ядерных реакторов нужен химически чистый цирконий без примеси гафния. Для электронной промышленности необходим германий, в котором не должно быть более одного атома фосфора, мышьяка или сурьмы на миллион атомов германия. Исследование металлов в чистом состоянии показало, что некогда существовавшие представления об их свойствах являются ошибочными. Так, например, чистые титан, хром оказались настолько пластичными, что их можно ковать, прокатывать в тонкие листы и пр. Алюминий высокой чистоты мягок, как свинец, а его электропроводимость значительно выше.
Чистые металлы можно получить электролизом, но степень их чистоты недостаточно высокая, поэтому для получения металлов ОСЧ – особой чистоты, используют специальные методы:
- переплавка в вакууме (получают ОСЧ литий, щелочно-земельные металлы, хром, марганец, бериллий);
- разложение летучих соединений на раскаленной поверхности (получают ОСЧ титан, цирконий, хром, тантал, ниобий, кремний и др.);
- использование так называемой «зонной плавки» (получают германий, кремний, олово, алюминий, висмут и галлий).
Зонная плавка основана на различной растворимости примесей в твердой и жидкой фазах очищаемого металла. Лодочку или тигель специальной формы со слитком металла передвигают с очень медленной скоростью (несколько мм в час) через печь При этом происходит расплавление небольшого участка (зоны) металла. По мере продвижения тигля зона жидкого металла перемещается от одного конца слитка к другому. Примеси, содержащиеся в металле, собираются в зоне плавления, перемещаются вместе с ней и после окончания плавки оказываются в конце слитка. Многократное повторение операции дает возможность получить металл высокой степени чистоты.
Дополнения к теме «Физико-хмический анализ»
Многочисленные работы Ник. Семен. Курнакова по выяснению природы металлических сплавов внесли ясность в понимание процессов, происходящих при затвердевании сплавов. В частности, при изучении сплавов были открыты химические соединения, состав которых может меняться в широких пределах. Эти соединения, состав которых может меняться в широких пределах, Курнаков назвал бертоллидами, по имени французского химика Бертолле, допустившего их существование. Тогда как соединения постоянного состава (подчиняющиеся закону постоянства состава), были названы дальтониды. Стехиометрическое соотношение компонентов, образующих химическое соединение постоянного состава соблюдается только в парообразном состоянии, в молекулярных кристаллах и жидкостях. Исходя из вышесказанного, можно дать более развернутое определение, что такое химическое соединение. Химическое соединение – это вещество постоянного или переменного состава, образованное из атомов одного или нескольких химических элементов, с качественно своеобразным химическим и кристаллохимическим строением.
При сплавлении металлов может образоваться твердый раствор или химическое соединение переменного состава. В отличие от твердых растворов (общее между растворами и хим. соединениями – однородность и наличие теплового эффекта при образовании), соединение переменного состава характеризуется только ему присущим кристаллохимическим строением, отличающимся от строения исходных компонентов.
Металлы и сплавы
Большинство металлов не растворяются в воде, органических растворителях, но в расплавленном состоянии они могут взаимно растворяться или смешиваться с друг другом, образуя сплавы – продукты сплавления или спекания двух и более компонентов, обладающих свойствами как исходных веществ, так и новыми свойствами. Компонентами сплавов могут быть металлы, металлы и неметаллы, а также только неметаллы. Поэтому различают металлические и неметаллические сплавы (например, керамические материалы – сплавы различных оксидов и солей и стеклообразные). Для металлических сплавов характерен металлический тип химической связи; в неметаллических – связь ковалентная, а также смешанного типа – ионно-ковалентная. Сплавы могут быть стехиометрическими (дальтониды) и нестихиометрическими соединениями (бертоллиды). Следует помнить следующее. Стехиометрическое соотношение компонентов, образующих химическое соединение постоянного состава соблюдается только в парообразном состоянии, в молекулярных кристаллах и жидкостях. Химические соединения, состав которых может меняться в широких пределах называются соединениями переменного состава – бертоллидами, в честь французкого химика Бертолле. Бертоллиды – это кристаллические вещества. Например, известно, что формула оксида железа (II) не FeO, а Fe0,95O. Исходя из вышесказанного, существует развернутое определение, что такое химическое соединение. Химическое соединение – это вещество постоянного или переменного состава, образованное из атомов одного или нескольких химических элементов, с качественно своеобразным химическим и кристаллохимическим строением.
Примеры широко распространенных металлических сплавов:
- дюраль 95%алюминия+4%меди +по 0,5% магния и марганца;
- силумин – алюминий с добавками кремния;
- нейзельбер («немецкое серебро») Ni-Zn-Cu (1:1:2);
- бронза – сплав меди с добавками олова, но могут быть и другие компоненты, и соответствующие названия (бериллиевая бронза – бериллия с медью, никелевая бронза – сплав никеля с медью);
- нихром – сплав никеля с хромом, мельхиор (+медь?);
- сплавы на основе железа - чугун 93%железа +5%углерода, а также кремний, марганец, сера; сталь – менее 0,3% углерода (твердые стали -0,3-2%С).
Есть понятие легирование металла - введение добавок для улучшения свойств металла. Чаще всего легируют сталь. Легированная сталь – это сталь, в которую для улучшения ее механических свойств и коррозионной устойчивости вводят другие металлы. Если количество добавленных металлов не превышает 3%, то такую сталь называют низколегированной. Стали, содержащие от 1-4% никеля и 0,5-2% хрома (высоколегированные) применяются для производства артиллерийских орудий, брони, бронебойных снарядов, оболочек для пуль и пр.
При сплавлении металлов может образоваться твердый раствор – простое растворение одного металла в другом или, что чаще всего происходит, металлы вступают друг с другом во взаимодействие, образуя химическое соединение переменного состава. Твердый раствор – это твердая однородная смесь кристаллических или аморфных (стеклообразных) веществ переменного состава.
В отличие от твердых растворов (общее между растворами и хим. соединениями – однородность и наличие теплового эффекта при образовании), химическое соединение переменного состава характеризуется только ему присущим кристаллохимическим строением, отличающимся от строения исходных компонентов. Химические соединения металлов друг с другом называют интерметаллическими сплавами: Cu5Zn8, MgCuAl2, Al6Mn. Многие металлы образуют несколько различных соединений друг с другом в составе одного сплава, например: AuZn, Au3Zn5, AuZn3, Na4Sn, NaSn, NaSn2. Интерметаллические соединения способны растворяться в жидком аммиаке, образуя проводящие ток растворы. При электролизе таких растворов один металл выделяется на аноде (свинец - в сплавах свинец-натрий), а на катоде – натрий. В растворах интерметаллические соединения могут вступать в реакции обмена, замещения с солями: Ca(NO3)2 + K4Pb = Ca2Pb + 4KNO3.
Таким образом, сплавы представляют собой смеси свободных металлов и их химических соединений, образование которых сопровождается значительным тепловым эффектом. Например, алюминий в расплаве меди раскаляется добела. Свойства сплавов во многом отличаются от свойств металлов, образующих сплавы, не являясь их среднеарифметическим, т.к. идет образование твердых растворов или химических соединений. Температура плавления сплава бываетдаже ниже температуры плавления наиболее легкоплавкого металла. Наоборот, твердость сплавов часто больше с=твердости составляющих их металлов.
Большинство сплавов смешиваются друг с другом в любых пропорциях. Но некоторые металлы растворяются в другом до известного предела. Например, цинк со свинцом при остывании смеси образуют два слоя: нижний свинец, в котором растворено немного цинка и верхний – цинк, в котором растворено немного свинца.
ВВЕДЕНИЕ
Аналитическая химия – это раздел химии, изучающий свойства и процессы превращения веществ с целью установления их химического состава. Установление химического состава веществ (химическая идентификация) – это ответ на вопрос о том, какие элементы или их соединения и в каких количественных соотношениях содержаться в анализируемом образце. Аналитическая химия развивает теоретические основы химического анализа веществ и материалов, разрабатывает методы идентификации, обнаружения, разделения и определения химических элементов и их соединений, а также методы установления строения вещества. Обнаружение или, как говорят, открытие элементов или ионов, входящих в состав исследуемого вещества, составляют предмет качественного анализа.Определение концентраций или количества химических веществ, входящих в состав анализируемых объектов, составляет задачу количественного анализа. Качественный анализ обычно предшествует количественному анализу, так как для выполнения количественного анализа требуется знать качественный состав анализируемого образца. Когда состав изучаемого объекта известен заранее, качественный анализ проводят по мере необходимости.
МЕТОДЫ АНАЛИТИЧЕСКОЙ ХИМИИ
Для обнаружения какого-либо компонента обычно используют так называемый аналитический сигнал. Аналитический сигнал –этовидимые изменения в самом объекте исследования (образование осадка, изменение окраски и т.д.) или изменение параметров измерительных приборов (отклонение стрелки прибора, изменение цифрового отсчета, появление линии в спектре и пр.). Для получения аналитического сигнала используют химические реакции разных типов (ионообменные, комплексообразования, окислительно-восстановительные), различные процессы (например, осаждение, выделение газов), а также разнообразные химические, физические и биологические свойства самих веществ и продуктов их реакций. Поэтому аналитическая химия располагает различными методами для решения своих задач.
Химические методы (химический анализ) основаны на проведении химической реакции между изучаемым образцом и специально подобранными реактивами. В химических методах аналитический сигнал, возникающий в результате химической реакции, наблюдают, главным образом, визуально.
В физико-химических методах анализа используются определенные свойства химических веществ и происходящие с ними химические реакции. но аналитическим сигналом служит какое-нибудь физическое свойство (электрический потенциал, сила тока, сопротивление) или параметр (температура фазовых превращений, твердость, плотность, вязкость, давление насыщенного пара, скорость абсорбции и др.).
Физико-химические методыанализа часто основаны на количественном изучении зависимости состав – физическое свойство объекта. Аналитический сигнал – какое-либо физическое свойство (температура фазовых превращений, твердость, плотность, вязкость, давление насыщенного пара и т.п.), связан определенной функциональной зависимостью с составом и концентрацией объекта исследования. Физико-химические методы исследования обычно требуют применения высокочувствительной аппаратуры. Достоинствами этих методов являются их объективность, возможность автоматизации и быстрота получения результатов. Примером физико-химического метода анализа является потенциометрическое определение рН раствора с помощью измерительных приборов - потенциометров. Этот метод позволяет не только измерять, но и непрерывно следить за изменением рН при протекании в растворах каких-либо процессов.
В физических методах анализааналитический сигнал, как правило, получают и регистрируют с помощью специальной аппаратуры. К физическим методам, прежде всего, относятся оптические спектроскопические методы анализа, основанные на способности атомов и молекул испускать, поглощать и рассеивать электромагнитное излучение. Регистрируя испускание, поглощение или рассеяние электромагнитных волн анализируемым образцом, получают совокупность сигналов, характеризующих ее качественный и количественный состав.
Между всеми тремя методами нет резкой границы, поэтому это деление несколько условно. Например, в химических методах пробу подвергают сначала действию какого-либо реагента, т.е. проводят определенную химическую реакцию, и только после этого наблюдают и измеряют физическое свойство. При анализе физическими методами наблюдение и измерение выполняют непосредственно с анализируемым материалом, используя специальную аппаратуру, причем химические реакции, если они проводятся, играют вспомогательную роль. В соответствии с этим в химических методах анализа главное внимание уделяют правильному выполнению химической реакции, в то время как в физико-химических и физических методах основной упор делается на соответствующее аппаратурное обеспечение измерения – определение физического свойства.
Получение металлов высокой чистоты
Развитие в последние годы ряда новых отраслей техники ставит перед промышленностью задачу получения металлов значительно более высокой степени чистоты, чем допускалось ранее. Так, например, для надежной работы ядерного реактора необходимо, чтобы в расщепляющихся материалах такие «опасные» примеси, как бор, кадмий и другие, содержались в количестве, не превышающем миллионных долей процента. Чистый цирконий, являющийся одним из лучших конструкционных материалов для атомных реакторов, становится совершенно непригодным для этой цели, если в нем содержится даже незначительная примесь гафния. В используемом в качестве полупроводника германии допускается содержание не более 1 атома фосфора, мышьяка или сурьмы на 10 миллионов атомов металла. В жаропрочных сплавах, широко применяемых в современной авиации, совершенно недопустима даже ничтожная примесь свинца или серы.
Исследование металлов, полученных в весьма чистом состоянии, показало, что прежние представления об их свойствах являются в ряде случаев ошибочными. Многие металлы, считавшиеся хрупкими, непластичными, обладают в чистом виде высокой пластичностью. Так, например, титан оказался настолько пластичным, что его можно ковать, прокатывать в тонкие листы, ленты и т. д. Весьма пластичным является и чистый хром. Алюминий высокой степени чистоты так же мягок, как и свинец; электропроводность же его значительно выше, чем у обычного алюминия.
Чистые металлы могут быть получены электролизом, восста-новлением из различных химических соединений водородом, кальцием, магнием или алюминием и другими способами, однако степень чистоты получаемых по этим способам металлов недостаточна для современной техники. Поэтому в последние годы разработаны специальные методы очистки металлов. Из этих методов наиболее перспективными являются: 1) очистка металлов путем их переплавки в вакууме; 2) так называемая «зонная» плавка металлов и 3) разложение летучих соединений металлов на раскаленной поверхности.
Очистка металлов путем их переплавки в вакууме основана на различии температур кипения очищаемого металла и имеющихся в нем примесей. При работе по этому методу отгоняют либо примеси от металла, либо очищаемый металл от примесей. Метод используется для получения весьма чистых лития, кальция, стронция и бария. Он может быть также применен для получения хрома, марганца и бериллия.
«Зонная» плавка основана на различии в растворимости примесей в твердой и жидкой фазах очищаемого металла. При «зонной» плавке лодочку или тигель специальной формы со слитком (стержнем) очищаемого металла передвигают с весьма малой скоростью (несколько миллиметров в час) через печь. При этом происходит расплавление небольшого участка (зоны) металла, находящегося в данный момент в печи. По мере продвижения лодочки (тигля) зона жидкого металла перемещается от одного конца слитка к другому. Примеси, содержащиеся в металле, собираются в зоне плавления, перемещаются вместе с ней и, после окончания плавки, оказываются в конце слитка. Многократное,повторение операций дает возможность получить металл весьма высокой степени чистоты.
Путем «зонной» плавки очищают от примесей германий, кремний, олово, алюминий, висмут и галлий.
Разложение летучих соединений металлов на нагретой поверхности. Титан, цирконий, хром, тан тал, ниобий, кремний и ванадий легко образуют химические соединения, летучие при сравнительно невысоких температурах.
При соприкосновении таких соединений с раскаленной поверхностью они разлагаются, образуя слой весьма чистого металла.
Получение изделий из тугоплавких металлов
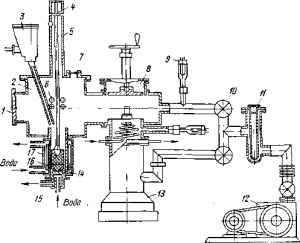
Высокие температуры плавления и способность поглощать газы заставляют применять особые методы для получения из порошков тугоплавких металлов слитков, сплавов, заготовок для обработки давлением и керметов.
Плавка с расходуемым электродом
Этот процесс, проводимый в электродуговых печах в вакууме или среде аргона, служит для получения слитков из многих тугоплавких металлов и их сплавов, в частности титана и молибдена.
Рис. . Дуговая печь для плавки с расходуемым электродом:
1 — вакуумная камера; 2 — загрузочная течка; 3 — бункер для добавок; 4 — расходуемый электрод; 5 — кожух электрода; 6 — подающие ролики; 7 — смотровое окно; 8 — вентиль; 9 — электронный измеритель вакуума; 10 — вакуумные краны; 11 — ловушка; 12 — форвакуумний насос; 13 —пароструйный насос; 14 — поддон; 15 — подвижное дно кристаллизатора; 16 — соленоид; 17 — медный кристаллизатор с водяным охлаждением
В герметичной вакуумной камере помещают медный охлаждаемый водой кристаллизатор, содержимое которого служит од ним полюсом электрической дуги, автоматически опускаемый расходуемый электрод — другой ее полюс (рис.). Электрод прессуют из порошка металлов и их смесей под давлением 197,1—588,3 МН/м 2 , конец его опущен в кристаллизатор, на стен ках которого затвердевает слой расплава гарниссаж. Кристаллизатор по ходу плавки автоматически опускается вытягивая слиток; для зажигания дуги на дно его кладут диск из металла. Длина шнура плазмы 25—30 мм поддерживается и направляется полем соленоида, который предупреждает переброс дуги на стенки кристаллизатора и вызывает циркуляцию расплава. Фор-вакуумный и пароструйный насосы поддерживают остаточное] давление порядка 133,4•10 -3 —133,4• 10 -4 Н/м 2 и откачивают газы, отходящие при плавке. Для получения больших слитков диаметром до 350 мм применяют электрод, наращиваемый аргоно-дуговой сваркой из блоков длиной по 500 мм. Дуга работает при напряжении постоянного тока 30 В и силе его до 100 кА. Так плавят молибден и выплавляют слитки титана массой до 10 т с поперечником около 1 м.
Сплавы делают так же; добавки вводят в электрод в виде богатых лигатур (порошков или стружки), а малые — в кристаллизатор. Недостаточно однородные сплавы переплавляют, применяя их в качестве расходуемого электрода.
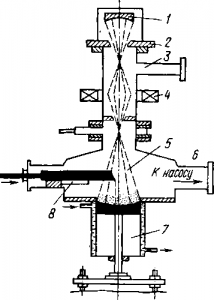
Электроннолучевая плавка тугоплавких металлов
Электроннолучевая плавка позволяет долго выдерживать жидкий металл в глубоком вакууме и избавиться при этом от многих летучих примесей. Принцип ее нетрудно понять, рассматривая схему рис. 2 . Поток электронов, испускаемый катодом из вольфрама или тантала, которому сообщен высокий отрицательный потенциал, проникает через отверстие заземленного анода, он фокусируется электромагнитной катушкой подобно тому, как свет фокусируется линзами, и направляется на конец заготовки. Высокая кинетическая энергия электронов при ударе превращается в теплоту, которая нагревает и плавит металл. Система для разгона и фокусировки электронного пучка — электронная пушка— работает в высоком вакууме — порядка 133,3•10 -4 — 133,3•10 -5 Н/м 2 . Наилучшее использование энергии достигается при напряжении 30—35 кВ, когда доля побочно возникающего рентгеновского излучения минимальна, а коэффициент полезного
Добывание металлов из руд
Огромное большинство металлов находится в природе в виде соединений с другими элементами.
Только немногие металлы встречаются в свободном состоянии, и тогда они называются самородными. Золото и платина встречаются почти исключительно в самородном виде, серебро и медь — отчасти в самородном виде; иногда попадаются также самородные ртуть, олово и некоторые другие металлы.
Добывание золота и платины производится или посредством механического отделения их от той породы, в которой они заключены, например промывкой водой, или путем извлечения их из породы различными реагентами с последующим выделением металла из раствора. Все остальные металлы добываются химической переработкой их природных соединений.
Минералы и горные породы, содержащие соединения металлов и пригодные для получения этих металлов заводским путем, носят название руд . Главными рудами являются окислы, сульфиды и карбонаты металлов.
Получение металлов из руд составляет задачу металлургии — одной из наиболее древних отраслей химической промышленности.
Важнейший способ получения металлов из руд основан на восстановлении их окислов углем.
Если, например, смешать красную медную руду (куприт); Сu2О с углем и подвергнуть сильному накаливанию, то уголь, восстанавливая медь, превращается в окись углерода, а медь выделяется в расплавленном состоянии:
Сu2О + C = 2Cu + CO
Подобным же образом производится выплавка чугуна из железных руд, получение олова из оловянного камня SnO2 и восстановление других металлов из окислов.
При переработке сернистых руд сперва переводят сернистые соединения в кислородные путем обжигания в особых печах, а затем уже восстанавливают полученные окислы углем. Например:
В тех случаях, когда руда представляет собой соль угольной кислоты, ее можно непосредственно восстанавливать углем, как и окислы, так как при нагревании карбонаты распадаются на окись металла и углекислый газ. Например:
Обычно руды, кроме химического соединения данного металла, содержат еще много примесей в виде песка, глины, известняка, которые очень трудно плавятся. Чтобы облегчить выплавку металла, к руде примешивают различные вещества, образующие с примесями легкоплавкие соединения — шлаки. Такие вещества называются флюсами. Если примесь состоит из известняка, то в качестве флюса употребляют песок, образующий с известняком силикат кальция. Наоборот, в случае большого количества песка флюсом служит известняк.
Во многих рудах количество примесей (пустой породы) так велико, что непосредственная выплавка металлов из этих руд является экономически невыгодной. Такие руды предварительно «обогащают», т. е. удаляют из них часть примесей. Особенно широким распространением пользуется флотационный способ обогащения руд (флотация), основанный на различной адсорбционной способности чистой руды и пустой породы.
Техника флотационного способа очень проста и в основном сводится к следующему. Руду, состоящую, например, из сернистого металла и силикатной пустой породы, тонко измельчают и заливают в больших чанах водой. К воде прибавляют какое-нибудь малополярное органическое вещество, например сосновое масло, способствующее образованию устойчивой пены при взбалтывании воды, и небольшое количество специального реагента, так называемого «коллектора» , который хорошо адсорбируется поверхностью флотируемого минерала и делает ее неспособной смачиваться водой. После этого через смесь снизу пропускают сильную струю воздуха, перемешивающую руду с водой и прибавленными веществами, причем пузырьки воздуха окружаются тонкими масляными пленками и образуют пену. В процессе перемешивания частицы флотируемого минерала покрываются слоем адсорбированных молекул коллектора, прилипают к пузырькам продуваемого воздуха, поднимаются вместе с ними кверху и остаются в пене; частицы же пустой породы, смачивающейся водой, оседают на дно. Пену собирают, отжимают из нее масло и получают руду с значительно большим процентным содержанием металла.
Для восстановления некоторых металлов из их окислов применяют вместо угля водород, кремний, алюминий, магний и другие элементы.
Процесс восстановления металла из его окисла с помощью другого металла называется металлотермией. Если, в частности, в качестве восстановителя применяется алюминий, то процесс носит название алюминотермии.
Применение алюминия основано на том, что при его горении выделяется гораздо больше тепла, чем при сжигании многих других металлов. Так, например, при образовании 1 граммолекулы Al2O3 выделяется 393 ккал, тогда как при образовании 1 граммолекулы Fе 2O3 — только 195 ккал.Но мы уже говорили в свое время, что для разложения какого-либо соединения нужно затратить столько же энергии, сколько выделилось при его образовании. Поэтому, если поджечь смесь окиси железа с алюминием, то не только происходит восстановление железа, но и остается большой избыток тепла, составляющий 393— 195= 198 ккал на ка-ждую граммолекулу образующейся окиси алюминия. Происходящая реакция выражается уравнением
Реакцию обычно проводят в ограниченном пространстве и очень быстро, при этом температура смеси достигает 3500°. При такой температуре железо выплавляется, а окись алюминия в виде шлака всплывает на поверхность жидкого железа.
Смесь магнитной окиси железа Fe3O4 с алюминием, известная под названием термита, применяется на практике для сваривания железных предметов, например трамвайных рельсов. Для этого место стыка рельсов окружают кожухом из огнеупорного материала по форме рельса, куда вливают получаемое из термита расплавленное железо. Под действием высокой температуры концы рельсов размягчаются и свариваются или спаиваются жидким железом.
Металлургические процессы, протекающие при высоких температурах, называют пирометаллургическими. Пиро-металлургическим путем получают железо, 85— 90% меди и т. д. Руды, которые содержат небольшое количество металла и не могут быть обогащены флотацией, перерабатывают г и д р о м е-таллургическим путем. Для этого мелкоизмельченную руду обрабатывают различными химическими реагентами (растворы кислот, щелочей и др.). При такой обработке металл переходит в раствор, откуда его затем осаждают в чистом виде или в виде соединений, которые подвергают дальнейшей переработке. Гидрометаллургическим путем перерабатывают, в частности, окисленные медные руды, содержащие до 0,5% металла.
Редкие металлы обычно содержатся в рудах в очень незначительных количествах (сотые и тысячные доли процента). Для извлечения этих металлов руды сначала обогащают. Получаемый при этом концентрат подвергают затем химической переработке с целью выделить соединения металла в чистом виде. Последней стадией является выделение металла в свободном состоянии.
Очень важным способом получения металлов является также электролиз. Некоторые наиболее активные металлы получаются исключительно путем электролиза, так как все другие средства оказываются недостаточно энергичными для восстановления их ионов.
Вы читаете, статья на тему Добывание металлов из руд
Похожие страницы:
Получение металлов высокой чистоты Развитие в последние годы ряда новых отраслей техники ставит перед промышленностью задачу получения металлов значительно более.
Уран (Uranium) Aт. вес 238,07. Уран распространен в природе меньше, чем металлы подгруппы хрома; его содержание в земной коре равняется.
Агломерация платиновых металлов Азотнокислое серебро Амальгамация золотых руд Аффинаж золота и серебра Аффинаж платиновых металлов Аффинаж серебра Вторичное серебро и.
Соединения восьми валентных элементов платиновой группы Из металлов платиновой группы только для осмия и рутения характерны соединения, в которых эти элементы.
Палладий (Palladium) Aт. вес 106,4. Иридий (Iridium); ат. вес 192,2. Палладий — серебристо-белый металл уд. веса, 11,9, плавящийся при 1552°.
Соединения серы с галогенами При пропускании хлора в расплавленную серу образуется однохлористая сера, представляющая собой оранжевую жидкость, кипящую при 138°.
193. Получение металлов высокой чистоты.
На протяжении последних десятилетий в связи с развитей новых отраслей техники потребовались металлы, обладающие очень высокой чистотой. Например, для надежной работы ядерного реактора необходимо, чтобы в расщепляющихся материалах такие «опасные» примеси, как бор, кадмий и другие, содержались в количествах, не превышающих миллионных долей процента. Чистый цирконий — один из лучших конструкционных материалов для атомных реакторов — становится совершенно непригодным для этой цели, если в нем содержится даже незначительная примесь гафния. В используемом в качестве полупроводника германии допускается содержание не более одного атома фосфора, мышьяка или сурьмы на десять миллионов атомов металла. В жаропрочных сплавах, широко применяемых, например, в ракетостроении, совершенно недопустима даже ничтожная примесь свинца или серы.
В связи с потребностями промышленности разработаны новые методы очистки веществ. Рассмотрим наиболее важные из них.
Перегонка в вакууме. Этот метод основан на различии летучестей очищаемого металла и имеющихся в нем примесей. Исходный металл загружается в специальный сосуд, соединенный с вакуум-насосом, после чего нижняя часть сосуда нагревается. В ходе перегонки на холодных частях сосуда осаждаются либо примеси (если они более летучи, чем основной металл), либо очищенный металл (если примеси меиее летучи). Процесс ведется при непрерывной откачке воздуха, так как присутствие даже небольших количеств кислорода приводило бы к окислению поверхности расплавленного металла и тем самым к торможению процесса испарения.
Зонная плавка заключается в медленном протягивании бруска очищаемого металла через кольцевую печь. Тот участок (зона) бруска, который находится в данный момент в печи, плавится. По мере продвижения бруска жидкая зона перемещается от начала бруска к его концу.
Зонной плавке подвергают металл, прошедший предварительную очистку. Содержание примесей в нем уже невелико, так что основной металл и примеси образуют гомогенный твердый раствор. При движении бруска через кольцевую печь происходит плавление металла у передней границы зоны и кристаллизация его у задней границы. При этом состав образующихся кристаллов, находящихся в равновесии с расплавом, отличается от состава расплава (см. стр. 530).
Примеси одних металлов концентрируются в расплавленной зоне и перемещаются вместе с ней к концу бруска; примеси других металлов концентрируются в образующихся кристаллах, остаются за движущейся зоной и при неоднократном повторении процесса перемещаются к началу бруска. В результате средняя часть бруска получается наиболее чистой; ее вырезают и используют.
Зонную плавку применяют для очистки не только металлов, но и других веществ.
Термическое разложение летучих соединений металла. Карбонильный процесс. Этот метод применяется для получения высокочистых никеля и железа. Подлежащий очистке никель нагревают в атмосфере оксида углерода (II), находящегося под давлением около 20 МПа. При этом никель взаимодействует с СО, образуя летучий тетракарбонил никеля Ni(CO)4(темп. кип. 42°C ); содержащиеся в исходном металле примеси в такого рода реакцию не вступают. Образовавшийся Ni(CO)4 отгоняют, а затем нагревают до более высокой температуры. В результате карбонил разрушается с выделением высокочистого металла.
При очистке железа аналогичным образом осуществляется процесс синтеза и последующего разложения пентакарбонила железа Fe(CO)5(темп. кип. 105°C).
Иодидный способ дает возможность получать титан, цирконий и некоторые другие металлы значительной чистоты. Рассмотрим этот процесс на примере титана. Исходный металл в виде порошка нагревается до 100-200°C с небольшим количеством иода в герметическом аппарате. В аппарате натянуты титановые нити, нагреваемые электрическим током до 1300-1500°C. Титан (но не примеси) образует с иодом летучий иодид TiI4, который разлагается на раскаленных нитях. Выделяющийся чистый титан осаждается на них, а иод образует с исходным металлом новые порции иодида; процесс идет непрерывно до переноса всего металла на титановые нити.
Читайте также:
