Порошок металлического цинка растворили в подкисленном серной кислотой растворе
Обновлено: 19.05.2024
Цинковое сырье, содержащее цинк и окись цинка, размалывают в шаровой мельнице, а затем растворяют в 18—25%-ной серной кислоте46. Растворение производят в резервуарах, футерованных кислотоупорным материалом и снабженных мешалками. Тепло, выделяющееся при предварительном разбавлении серной кислоты до указанной концентрации, а также тепло экзотермических реакций
ZnO + H2S04 = ZnS04 + Н20 (Ж.) + 25,1 Ккал Zn + H2S04 = ZnS04 + Н2 + 40,0 Ккал
Обеспечивает повышение температуры реакционной массы до 80— 100° без дополнительного подогрева. При содержании в сырье значительного количества металлического цинка процесс сопровождается интенсивным пенообразованием вследствие выделения водорода. Реакционные резервуары должны быть сообщены с сильной вытяжной вентиляцией, предотвращающей накопление-водорода в атмосфере цеха.
Для ускорения нейтрализации серной кислоты, которая замедляется к концу процесса, р реактор загружают избыток цинкового сырья. Образующиеся при этом основные соли цинка разрушаются впоследствии добавкой серной кислоты после удаления раствора. По окончании реакции, когда содержание свободной серной кислоты в растворе понизится до 1—2 г/л, раствору дают отстояться и фильтруют его через барабанный вакуум-фильтр, а в реактор с остатком сырья заливают новую порцию серной кислоты и добавляют цинковое сырье. При содержании в сырье значительных количеств свинца и олова, не переходящих при сернокислотной
переработке в раствор, твердый остаток после промывки направляют на переработку для извлечения этих металлов.
При содержании в сырье олова образуются плохо фильтрующие осадки. Поэтому считают целесообразным46 при переработке отходов, содержащих олово, отделять нерастворившийся остаток не фильтрацией, а отстаиванием. При разбавлении суспензии до плотности 1,2—1,21 г/см3, что соответствует содержанию в растворе 200—250 г/л ZnSCU, отстаивание идет с достаточной скоростью (рис. 198). Полное отстаивание достигается только в нейтральной среде. При отстаивании кислых растворов в сливе содержится муть. При продолжительности отстаивания 10— 15 ч получается пульпа с отношением Т : Ж, в пределах от 1 : 1,2 До 1 : 1,5.
Профильтрованный раствор содержит 400—420 г/л ZnSC>4 и примеси FeS04, CUSO4, CdS04, NiSCU, количества которых зависят от содержания соответствующих металлов в сырье. Очистку раствора цинкового купороса от этих примесей производят В несколько приемов. Вначале очищают раствор от железа, добавляя окислитель для перевода Fe2+ в Fe3+. В качестве окислителя обычно применяют раствор гипохлорита натрия. После окис - . ления железо осаждают известью в виде основных солей окиси железа. Избыток извести вреден, так как он осаждает также основные соли цинка. Произведения растворимости: Zn(OH)2 (1,80-Ю-14) и Fe(OH)2(l,64 • 10*14) почти равны; произведение растворимости Fe(OH)3 значительно меньше (1,1- Ю-36).
После выделения в осадок соединений железа раствор кипятят Для разрушения небольшого избытка гипохлорита натрия и отфильтровывают от осадка. Осадок этой второй фильтрации, как и осадок от предыдущей, первой фильтрации, промывают на фильтре водой для извлечения из него ZnS04-, промывные воды используют Для разбавления серной кислоты в реакторе.
После очистки от железа раствор поступает на очистку от Си2+, Ni2+, Cd2+. Эту очистку производят путем интенсивного перемешивания раствора с добавленной к нему цинковой пылью в течение 4—6 ч. Потенциал у Zn более электроотрицательный, чем у Си, Ni
И Cd. Поэтому металлический цинк вытесняет эти металлы из растворов их солей по реакциям: .
Zn + CuS04 =■ Си + ZnSO« + 49,9 ккал Zn + NiSO« - Ni + ZnSO« + 20,9 » Zn + CdSO« - Cd + ZnSO« + 12,5 »
Наиболее полно и быстро протекает цементация меди. Выделение из раствора никеля и кадмия сопряжено со значительными трудностями вследствие того, что они близко стоят к цинку в ряду напряжений. При повышенной температуре и интенсивном перемешивании быстро протекает обратный процесс — окисления и растворения кадмия. В то же время для достижения полноты цементации никеля требуются большой избыток цинковой пыли и высокая температура47.
Применяемую для цементации цинковую пыль обрабатывают предварительно небольшим количеством слабой серной кислоты для удаления с поверхности металла тонкого слоя окиси. Выпавшие в виде тонкого шлама металлы отделяют от раствора на фильтре, после чего раствор подвергают вторичной очистке от железа, которое в небольших количествах содержится в цинковой пыли. Профильтрованный после вторичной очистки раствор содержит 300—350 г/л ZnS04 и до 10 г/л С1~.
Полученный раствор цинкового купороса содержит некоторое количество основных солей сульфата цинка. Для их разрушения В очищенный раствор цинкового купороса добавляют немного серной кислоты. После этого раствор направляют на кристаллизацию цинкового купороса или используют для производства литопона и других продуктов48. Сушку цинкового купороса можно вести во взвешенном слое. На изготовление 1 т цинкового купороса расходуют: 0,47 т цинка (в пересчете на металл) и 0,72 т серной кислоты (100%).
Из твердого остатка, получающегося при растворении цинка в серной кислоте, извлекают свинец и олово 49.
Наибольшее количество сульфата цинка изготовляют сейчас из маломедистой пыли, получаемой при вторичной переработке цветных металлов, содержащей 65—70% цинка, 1—6% олова, 7—10% свинца и ■— 0,6% меди. Суспензию пыли в оборотном растворе подвергают «нейтральному» выщелачиванию — обработке серной кислотой при 90° и при продувке барботирующим воздухом. Количество добавляемой кислоты недостаточно для извлечения из сырья всей окиси цинка и в раствор переходит ~90% ZnO. Избыток окиси цинка и окисление Fe2+ в Fe3+ кислородом воздуха обеспечивают хорошую очистку раствора от железа. Величину рН регулируют так, чтобы избежать осаждения меди, перешедшей в раствор из сырья.
После «нейтрального» выщелачивания пульпа сгущается в отстойниках, и сгущенная пульпа поступает на «кислое» выщелачивание, а слив проходит контрольную фильтрацию через фильтр - пресс и очищается от меди цементацией цинковой пылью при 60—70° в аппарате с мешалкой. После отделения цементной меди на фильтрпрессе полученный раствор содержит 130—140 г/л цинка в виде ZnS04 и направляется на выпарку в двухкорпусную выпарную батарею, работающую под давлением. Давление в I и II корпусах составляет соответственно 3 и 1,5 ат, и температуры кипения раствора в них 140 и 120°. Из II корпуса выводится смесь насыщенного раствора и взвешенных в ней кристаллов ZnS04 • Н20, причем общая концентрация соответствует отношению ZnS04 : Н20, равному 1 : 5—6. Суспензию охлаждают до полного отверждения на поверхности барабана, внутри которого циркулирует вода, в получают чешуйчатый продукт, состоящий из ZnS04 • 7Н20 с примесью ZnSC>4 • Н20.
«Кислое» выщелачивание пульпы, сгущенной после «нейтрального» выщелачивания, осуществляют серной кислотой также при нагреве до 90° и с продувкой — перемешиванием воздухом. Прв этом окись цинка практически полностью переходит в раствор, содержащий — 100 г/л Zn и 1 г/л H2S04. После фильтрации на фильтрпрессе этот оборотный раствор используют для приготовления суспензии исходной пыли. Отделенные на фильтре евинцово - оловянные кеки направляют на дальнейшую переработку.
Получение цинкового купороса из медистой окиси цинка
К неиспользуемым отходам в производстве вторичной меди принадлежит так называемая медистая окись цинка, содержащая 35—45% ZnO, до 10% закисной и окисной меди, до 20% Si02. Ее не используют для выплавки меди из-за образования вязких шла - .ков и настылей, а для выработки цинкового купороса — из-за высокого содержания меди.
Получение цинкового купороса из медистой окиси цинка возможно следующим способом 50, основанным на переводе большей части окиси цинка в раствор, а окиси меди в осадок в результате реакции:
CuS04 + ZnO - ZnS04 + CuO
Очевидно, реакция протекает через стадию гидратации окиси цинка с образованием гидроокиси меди.
Процесс осуществляют в две стадии, проводимые в разных реакторах. В первом реакторе происходит образование конечного Раствора, содержащего 45—47% ZnS04, направляемого на кристаллизацию. В этот реактор поступает содержащий медь нейтральный 37% раствор из второго реактора, цинковое сырье и
40—80% от общего количества серной кислоты, необходимого для Сульфатизации ZnO, РЬО и СаО (без учета расхода H2S04 на взаимодействие с CuO, FeO, Fe203, которые остаются в кекеввиде окислов). Твердый остаток (промежуточный кек) из первого реактора обрабатывают серной кислотой во втором реакторе, где из него извлекается остаток окиси цинка и растворяется некоторое количество окиси меди. Оптимальная температура во втором реакторе 70°. Основная масса меди, поступающей в сырье выводится из второго реактора с конечным кеком, который промывают водой
0,5 1,0 US 2,0 2,5 3,0 Время, ч
Рис. 200. Содержание меди в кристаллах ZnS04 В зависимости от длительности первого выщелачивания при 50, 60 н 70°.
Время, ч
Рнс. 199. Влияние длительности процесса на очистку растворов ZnS04 От меди при 50 и 70°.
Для уменьшения потерь растворимого сульфата цинка. Промывную воду возвращают во второй реактор. Содержание цинка в остаточном кеке колеблется в пределах 6—8%, выход кека —-55% от веса сухой исходной пыли. Степень извлечения ZnO составляет 90—92,5 %.
Взаимодействие окиси цинка с сульфатом меди замедляется с увеличением концентрации Z11SO4 в исходном растворе. Так, при повышении концентрации с 31 до 36% ZnS04 продолжительность процесса увеличивается в 2 раза. Таким способом можно получить раствор ZnS04, содержащий всего 0,05 г/л меди, без затраты металлического цинка на очистку раствора (рис. 199 и 200).
Удаление железа из раствора основано на предварительном окислении Fe2+ в Fe3+ и взаимодействии сульфата окиси железа С окисью цинка:
Fe2(S04)3 + 3ZnO + 3H20 = 2Fe(OH)3 + 3ZnS04
Окисление. можно производить барботирующим через раствор воздухом; кислород воздуха в нейтральной среде энергично окисляет Fe2+. На рис. 201 показана зависимость содержания железа в кристаллах цинкового купороса от содержания его в исходном растворе. Кристаллы, полученные из растворов с одинаковым содержанием железа и меди, загрязнены железом приблизительно в 10 раз больше, чем медью. Это обусловливает необходимость хорошей очистки растворов цинкового купороса от железа для получения продукта высокого качества.
Общие характеристики цинка, его реакции с разбавленной и концентрированной серной кислотой

[Deposit Photos]
Общая характеристика элемента
Цинк располагается во второй группе, побочной подгруппе периодической системы Менделеева и является переходным металлом. Порядковый номер элемента — 30, масса — 65,37. Электронная конфигурация внешнего слоя атома — 4s2. Единственная и постоянная степень окисления равна «+2». Для переходных металлов характерно образование комплексных соединений, в которых они выступают в качестве комплексообразователя с разными координационными числами. Это относится и к цинку. Существует 5 устойчивых в природе изотопов с массовыми числами от 64 до 70. При этом изотоп 65Zn является радиоактивным, период его полураспада составляет 244 дня.

[Wikimedia]
Цинк — это серебристо-голубой металл, который на воздухе быстро покрывается защитной оксидной пленкой, скрывающей его блеск. При удалении оксидной пленки цинк проявляет свойства металлов — сияние и характерный яркий блеск. В природе цинк содержится в составе многих минералов и руд. Самые распространенные: клейофан, цинковая обманка (сфалерит), вюрцит, марматит, каламин, смитсонит, виллемит, цинкит, франклинит.

Смитсонит [Wikimedia]
В составе смешанных руд цинк встречается со своими постоянными спутниками: таллием, германием, индием, галлием, кадмием. В земной коре содержится 0,0076% цинка, а 0,07 мг/л этого металла содержится в морской воде в виде солей. Формула цинка как простого вещества — Zn, химическая связь — металлическая. У цинка гексагональная плотная кристаллическая решетка.
Физические и химические свойства цинка
Температура плавления цинка — 420 °С. При нормальных условиях это хрупкий металл. При нагревании до 100-150 °С ковкость и пластичность цинка повышается, возможно изготовление из металла проволоки и прокатка фольги. Температура кипения цинка — 906 °С. Этот металл — отличный проводник. Начиная от 200 °С, цинк легко растирается в серый порошок и теряет пластичность. У металла хорошая теплопроводность и теплоемкость. Описанные физические параметры позволяют использовать цинк в соединениях с другими элементами. Латунь — наиболее известный сплав цинка.

Духовые инструменты из латуни [Deposit Photos]
При обычных условиях поверхность цинка мгновенно покрывается оксидом в виде серо-белого тусклого налета. Он образуется из-за того, что кислород воздуха окисляет чистое вещество. Цинк как простое вещество реагирует с халькогенами, галогенами, кислородом, фосфором, щелочами, кислотами, аммонием (его солями), аммиаком. Цинк не взаимодействует с азотом, водородом, бором, углеродом и кремнием. Химически чистый цинк не реагирует с растворами кислот и щелочей. Цинк — металл амфотерный, и при реакциях со щелочами образует комплексные соединения — гидроксоцинкаты. Нажмите здесь, чтобы узнать, какие опыты на изучение свойств цинка можно провести дома.
Реакция серной кислоты с цинком и получение водорода
Взаимодействие разбавленной серной кислоты с цинком — основной лабораторный способ получения водорода. Для этого используется чистый зерненый (гранулированный) цинк либо технический цинк в виде обрезков и стружек.
Если взяты очень чистые цинк и серная кислота, то водород выделяется медленно, особенно в начале реакции. Поэтому к остывшему после разбавления раствору иногда добавляют немного раствора медного купороса. Осевшая на поверхности цинка металлическая медь ускоряет реакцию. Оптимальный способ разбавить кислоту для получения водорода — разбавить водой концентрированную серную кислоту плотностью 1,19 в соотношении 1:1.
Реакция концентрированной серной кислоты с цинком

В концентрированной серной кислоте окислителем является не катион водорода, а более сильный окислитель — сульфат-ион. Он не проявляет себя как окислитель в разбавленной серной кислоте из-за сильной гидратации, и, как следствие, малоподвижности.
То, как концентрированная серная кислота будет реагировать с цинком, зависит от температуры и концентрации. Уравнения реакций:
Zn + 2H₂SO₄ = ZnSO₄ + SO₂ + 2H₂O
3Zn + 4H₂SO₄ = 3ZnSO₄ + S + 4H₂O
4Zn + 5H₂SO₄ = 4ZnSO₄ + H₂S + 4H₂O
Концентрированная серная кислота является сильным окислителем благодаря степени окисления серы (S⁺⁶). Она взаимодействует даже с малоактивными металлами, то есть с металлами до и после водорода, и, в отличие от разбавленной кислоты, никогда не выделяет водород при этих реакциях. В реакциях концентрированной серной кислоты с металлами всегда образуются три продукта: соль, вода и продукт восстановления серы. Концентрированная серная кислота — это такой сильный окислитель, что окисляет даже некоторые неметаллы (уголь, серу, фосфор).
Химичим с цинком и ржавчиной.

Результат применения этого дела на кузове ОКИ
Давно хотел попробовать гальванику. Электролизом осаждать цинк на черных металлах. В быту пригодится, да и изучить стойкость к коррозии. Есть наборы для оцинковки в продаже, но они дорогие, за таких мелких 2 пузырька и пары причендалов отдавать деньги. искать еще где продается. Пробуем составить это дело самим:
На авторынке купил электролит для аккумуляторов. Это серная кислота с дистиллированной водой. Концентрация довольно велика.
Далее взял кучку севших но не потекших солевых батареек. Это самые дешевые батарейки. Достал из них цинк, нарезал тонкими полосками и опустил в серную кислоту. Поставил в водяную баню. Пошла реакция (фото). Растворял пока пузырьки шли, потом кислота выработалась, по идее насытившись растворенным цинком.

Но, как оказалось полученный раствор сульфата цинка непроканал. Забиваем на это. Засыпаем содой и сливаем в банку с шлаком.
Покупаем в магазине радиодеталей паяльную кислоту, с содержанием цинка. Состав- хлорид цинка. Цинк растворенный уже в соляной кислоте. Там цинка завались. Стоит в местном магазине литр — 400 руб. Литра хватит на оч много.
Сразу, там же покупаю ортофосфорную кислоту. Тоже является паяльной кислотой. 50 мл. достаточно.
Делаем 2 электрода.

Первым будем чистить от ржи, и его в идеале делать из нержавейки. Нержавейки в моем барахле не оказалось. Отрезал пластинку от корпуса комп. CDпривода. Припаял к этой пластинке медную проволоку, в кач-ве ручки. На пластинку закрепил материал. Лучше всего войлок (шинели, валенки и пр.) он жестче и не продавливается (иначе КЗ).

Второй электрод делаем для нанесения цинка. Пластинку берем от цинкового днища ранее набранных солевых батареек (снять оболочку у батарейки и вкруговую отпилить дно, очистить от солей и порошка.) Так же припаиваем к ней медный штырь. и закрепляем войлок.
Нужен будет источник питания. Тут главное условие — возможность регулировки силы тока. У меня есть самопальный источник от 0 до 24 вольт и стабилизацией тока 0 до 10 ампер. Ниже приведу пару вариантов и схему простейшего регулятора тока, если источника под рукой нету.

Начинаем чистить от ржавчины. Тут специально вырастил немного ржавчины, что б потом смыть. Таким методом можно выжирать и куда более злую ржу.
К электроду которым чисти подключаем + источника. К очищаемому объекту -.
Ставим напряжение 12-15 вольт и отсечку тока в 1.5-2 ампера. Пропитываем войлок электрода ортофосфорной кислотой. И начинаем водить по ржавчине. Начинает шипеть, БП показывает что ток пошел (1.5-2 А). Выделение водорода и активность кислоты- отколупывает и растворяет ржу, которая засела в порах и ржа остается на войлоке. Электрод нужно часто полоскать в воде, и снова пропитывать в свежей ортофосфорной кислоте, т.к то что в руке начинает растворяться, и осаждаться на маховике. а это нам пока не надо.

Вот ржа вычистилась. Голый, чистый металл, на котором видны мелкие неровные коросты, что захавала ржавчина. Все, очистили.

Капал воду, вода так и осталась каплями. По голой стали она растекается, а тут как бы собирается, как будто жирная поверхность.
Вот еще пара примеров оцинкованных железяк.



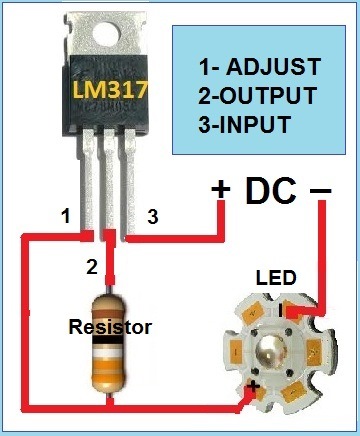
Вот пример схемы стабилизатора тока. Тут cxem.net/calc/lm317_calc.php можно рассчитать сопротивление резистора. Для "зачистного" тока нам будет нужен резистор 0.8 Ом. Можно 1 Ом на мощность 2 ватта. А для наносимого покрытия уже резистор на 1.6 Ома тож 2 ватта. Будут греться, но выдержат. 317ю нужно прикрутить на радиатор.
Если совсем просто- можно взять лампу от поворотника или стопа и подключить электрод через лампу, а в кач-ве источника- аккумулятор от машины. Если взять несколько ламп — можно подбором кол-ва в параллель менять ток.
Комментарии 39
Войдите или зарегистрируйтесь, чтобы писать комментарии, задавать вопросы и участвовать в обсуждении.

Пожалуйста, раз ты такой химк, помоги, я тут решил под капотом преобразователем ржавчины с цинком, убрать ражавчину, с болтов гаек, поехал на мойку смыть все это и произошла какая-то реакция, мыли химией, аксамд LF. Те места где я чистил и рядом все в белых точках, и ничем не берет ни содой ни ксилитом ни растворителями, что делать у меня паника, как можно убрать якобы какую-то накипь


Раствор соды в каких пропорциях готовится?

А если растворить предварительно цинк в ортофосфорной кислоте, а не соляной, будет тот же эффект?


подскажите?может ли паяльная кислота(с цинком которая) разъедать лак автомобиля?

Здравствуйте. Подскажите а как лампу от поворотника приколхозить, не могу сообразить к каким проводам подключать её. Ведь минусовая клема на корпусе остается? Спасибо

Лампочку в разрыв плюсового провода к которому подключен электрод. Т.е. последовательно.

Респект, за отчет, только вопрос не лучьше сначала малым током, а после повысить и поверхность будет матовая, и грунт ляжет на него.
В принципе идея кстати. Надо будет попробовать.
Да ты там осторожней с испарениями, используй вытяжку и противогаз, т.к. при реакции соляной кислоты ицинка образ сорнистый ангидрид пдк 0,5 надышишся и отеклегких заработать можно!) ну не дай божЕ.

откуда сернистый ангидрид в соединении соляной кислоты? вы б еще сказали чистый хлор выделяется.)) он же не сернистую кислоту использовал. и не фульфит, и даже не гидросульфит цинка, и не медь. сернистого газа и в реакции серной кислоты нет. валентность не та))) единственное чего стоит бояться это водород.
О, видимо вы в химии понимаете. Вот дело было. Лет 10 — 15 назад хотел сделать гравировку на блинах от винча (алюминий с зеркальным покрытием оксида железа, я честно сам не знаю что за покоытие точно, так пишут.)
Взял раствор поваренной соли и начал электродом травить надпись на этом диске. Резко завоняло хлоркой, аж в нос дало (как в школьном толчке, который был усыпан хлоркой, только в несколько раз сильней). Я резко выключил это дело и больше так не делал, боялся что траванусь. Вот интересно, неужели так интенсивно хлор выделяться начал или не только хлорка так воняет? Хлор он же ядовит. И что интересно, ни от чего больше такого запаха небыло, очень много металлов так гравировал. Интересно какие металлы с поваренной солью при электролизе дают образование хлора?
вот вам вводная лекция по травлению металлов))) надеюсь кому пригодится. главное будьте осторожны и смотрите не только с чем работаете, а что еще будет во время работы с реагентами))) а то так можно по незнанию и инвалидом остаться или того хуже…

Подскажите, паяльной кислотой на основе цинка, возможно защитить металл от коррозии?
Порошок металлического цинка растворили в подкисленном серной кислотой растворе
Тип 34 № 10104При нагревании образца карбоната кальция часть вещества разложилась. При этом выделилось 4,48 л (н. у.) углекислого газа. Масса твёрдого остатка составила 41,2 г. Этот остаток добавили к 465,5 г раствора соляной кислоты, взятой в избытке. Определите массовую долю соли в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Записаны уравнения реакций:
Рассчитано количество вещества соединений в твёрдом остатке:
n() = = 4,48 / 22,4 = 0,2 моль;
m() = n · M = 0,2 · 56 = 11,2 г;
m( остаток) = 41,2 – 11,2 = 30 г;
n( остаток) = m / M = 30 / 100 = 0,3 моль.
Вычислена масса соли в полученном растворе:
n() = n() + n() = 0,5 моль;
m() = n · M = 0,5 · 111 = 55,5 г;
n() = n( остаток) = 0,3 моль;
m() = n · M = 0,3 · 44 = 13,2 г.
Вычислена массовая доля хлорида кальция в растворе:
m (р-ра) = 41,2 + 465,5 – 13,2= 493,5 г.
ω() = m() / m (р-ра) = 55,5 / 493,5 = 0,112, или 11,2%.
Источник: Демонстрационная версия ЕГЭ—2018 по химии, Демонстрационная версия ЕГЭ—2020 по химии, Демонстрационная версия ЕГЭ−2019 по химии
Тип 34 № 10410Навеску гидрокарбоната натрия прокаливали в течение непродолжительного времени и получили твёрдый остаток массой 44,4 г. При растворении этого остатка в 400 г раствора азотной кислоты, взятой в избытке, выделилось 10,08 л (н. у.) газа. Найдите массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления с указанием единиц измерения искомых физических величин.
Запишем уравнения реакций:
Рассчитаем количество вещества соединений в твёрдом остатке:
Пусть тогда масса остатка
Общее количество вещества углекислого газа, выделившегося во второй и третьей реакциях равно:
Из (⁎) и (⁎⁎) находим, что
Рассчитаем массу нитрата натрия в растворе:
Рассчитаем массовую доля нитрата натрия в растворе:
Тип 34 № 10449Навеску основного карбоната меди прокаливали в течение непродолжительного времени и получили твёрдый остаток массой 98,6 г. При растворении этого остатка в 800 г раствора серной кислоты, взятой в избытке, выделилось 6,72 л (н. у.) газа. Найдите массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления с указанием единиц измерения искомых физических величин. Относительную атомную массу меди примите равной 64.
1)Записаны уравнения реакций:
2)Рассчитано количество вещества соединений в твёрдом остатке:
m() = 98,6 - 66,6 = 32 г
3) Рассчитана масса сульфата меди в растворе:
n() = 2n() + n() = 2⋅0,3 + 0,4 = 1,0 моль
m() = 1,0⋅160 = 160 г
4) Рассчитана массовая доля сульфата меди в растворе:
m(р-ра) = m(р-ра ) + m(тв.ост.) – m() = 800 + 98,6 – 0,3⋅44 =
ω() = 160 / 885,4 ⋅ 100% = 18,1%
Тип 34 № 10680Навеску технического карбоната кальция массой 8,00 г растворили в избытке соляной кислоты. К полученному раствору добавили избыток оксалата аммония, выпавший осадок отфильтровали и прокалили при температуре
до постоянной массы. Полученный порошок взвесили, его масса составила 4,03 г. Определите массовую долю карбоната кальция в техническом образце и объём газа (н. у.), выделившегося при его растворении в соляной кислоте. Примите, что технический образец содержит только некарбонатные примеси. Напишите уравнения всех проведённых реакций.
Читайте также:
