При контакте с каким из металлов
Обновлено: 17.05.2024
Коррозия при контакте марганца со свинцом или железом
Задача 123.
Контактируют 2 пары металлов Mn/Sn; Mn/Fe. В каком случае идет интенсивнее коррозия и какой металл корродирует? Почему? Составить электронные уравнения анодного и катодного процессов коррозии в атмосфере влажного газа и в растворе кислоты (H2SO4). Каков состав продуктов коррозии?
Решение:
Электродная пара металлов Mn/Sn (Fe = -0,44 В)
Стандартные электродные потенциалы марганца и олова равны соответственно -1,180 В и -0,136 В. Окисляться, т.е. подвергаться коррозии, будет марганец.Марганец имеет более электроотрицательный стандартный электродный потенциал (-1,180 В), чем олово (-0,180 В), поэтому он является анодом, олово – катодом.
а) Коррозия пары металлов Mn/Sn в атмосфере влажного газа
Анод Mn – 2 = Mn 2+
Катод 1/2O2 + H2O + 2 = 2ОН –
Mn + 1/2O2 + H2O = Mn(OH)2
Так как ионы Mn 2+ с гидроксид-ионами ОН – образуют малорастворимый гидроксид, то продуктом коррозии будет Mn(OH)2:
б) Коррозия пары металлов Mn/Sn в растворе кислоты (H2SO4)
Анод Mn – 2 = Mn 2+
Катод 2Н + + 2 = Н2
Mn + 2H + = Mn 2+ + H2↑
Так как ионы Mn 2+ с ионами SO4 2- образуют растворимую соль, придающая светло-розовую окраска раствора, то продуктом коррозии будет MnSO4:
Образуется сульфат ьарганц и при этом выделяется газообразный водород. Происходит интенсивное разрушение марганца.
Таким образом, при контакте марганца и олова коррозии будет подвергаться марганец.
Коррозия при контакте свинца с магнием
Задача 124.
Какой металл из 2х, находящихся в контакте, будет подвергаться коррозии? Указать катодный и анодный процессы, записать схему и продукты коррозии:
Pb/Mg в нейтральной среде.
Решение:
Стандартные электродные потенциалы свинца и магния равны соответственно -0,136 В и -2,38 В. Окисляться, т.е. подвергаться коррозии, будет магний.
Потенциал, отвечающий электродному процесу:
В нейтральной среде, потенциал равен приблизительно -0,41 В. Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислять только те металлы, потенциал которых меньше, чем -0,41 В, - в данном случае это может быть магний, его потенциал намного меньше (-2,38 В).
В нейтральной среде коррозия металла протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере.
Магний имеет более электроотрицательный стандартный электродный потенциал (-2,36 В), чем свинец (-0,136 В), поэтому он является анодом, свинец – катодом.
При коррозии пары Pb/Mg в нейтральной среде на катоде происходит кислородная деполяризация, а на аноде – окисление магния:
Анодный процесс: Mg 0 - 2 = Mg 2+
Катодный процесс: в нейтральной среде: 1/2O2 + H2O + 2 = 2OH – (O2 ↑+ 2H2O + 4 = 4OH – )
Так как ионы Mg 2+ с гидроксид-ионами ОН – образуют нерастворимый гидроксид, то продуктом коррозии будет Mg(OH)2:
Таким образом, при контакте свинца и магния коррозии будет подвергаться магний.
Коррозия металлов и защита от коррозии. химия
Коррозия металлов и защита от коррозии
1.В каком из контактов: а) Cu/Ag; б) Be/Zn; в) Mn/Mg скорость коррозии больше? Ответ подтвердите расчётами.
2.В контакте с каким из указанных металлов Sn является анодом: Al, Cr, Ca?
3.Составьте схему работы (катодный и анодный процессы) гальванопары Mg/Fe в кислой среде.
В каком из контактов: а) Cu – Ag; б) Be – Zn; в) Mn – Mg скорость коррозии больше? Ответ подтвердите расчётами.
При контакте двух металлов с разными электродными потенциалами возникает гальваническая пара, а между металлами возникает разность потенциалов. Чем больше разность потенциалов между металлами в результате образования гальванической пары, тем быстрее и разрушительнее протекает электрохимическая коррозия.
Найдем разность электродных потенциалов трех гальванических пар.
φ1 = Eo(Ag(+)/Ag) – Eo(Cu(2+)/Cu) = 0,799 – 0,338 = 0,461 В
φ2 = Eo(Zn(2+)/Zn) – Eo(Be(2+)/Be) = – 0,762 – (– 1,847) = 1,085 B
φ3 = Eo(Mn(2+)/Mn) – Eo(Mg(2+)/Mg) = – 1,18 – (– 2,362) = 1,183 B
В последнем случае разность потенциалов наибольшая, следовательно, наибольшая скорость коррозии будет наблюдаться у гальванической пары Mn – Mg, при этом корродировать будет магний Mg как металл, имеющий меньший электродный потенциал.
В контакте с каким из указанных металлов Sn является анодом: Al, Cr, Ca?
Eo(Sn(2+)/Sn) = − 0,140 B
Eo(Ca(2+)/Ca) = − 2,87 В
Ео (Al(3+)/Al) = − 1,70 В
Eo(Cr(2+)/Cr) = − 0,852 В
В гальваническом элементе анодом становится металл, обладающего меньшим значением электродного потенциала, а катодом – металл с большим значением электродного потенциала.
Олово в сравнении с этими тремя металлами имеет наибольший электродный потенциал. Значит, ни с одним из этих металлов в составе гальванического или коррозионного элемента олово не будет являться анодом.
Составьте схему работы (катодный и анодный процессы) гальванопары Mg – Fe в кислой среде.
При электрохимической коррозии в кислой среде на аноде происходит окисление (разрушение) металла, а на катоде – восстановление ионов водорода.
Me(0) – ne → Me(n+)
2Н (+) + 2е → Н2↑(в кислой среде)
При электрохимической коррозии в гальванической паре анодом становится металл, обладающего меньшим значением электродного потенциала, а катодом – металл с большим значением электродного потенциала.
Железо в электрохимическом ряду напряжений стоит правее магния, значит, железо имеет большее значение электродного потенциала, чем магний. Следовательно, в гальванической паре Mg – Fe магний будет анодом, а железо – катодом.
Eo(Fe(2+)/Fe) = − 0,441 В
Eo(Mg(2+)/Mg) = – 2,362 B
Eo(Fe(2+)/Fe) > Eo(Mg(2+)/Mg)
Следовательно, в данной гальванической паре магний будет разрушаться (корродировать) , а на поверхности железа будет происходить восстановление ионов водорода.
Процессы окисления-восстановления на электродах.
Анод (-) Mg(0) - 2е → Mg(2+) │1 - процесс окисления на аноде
Катод (+) 2Н (+) + 2е → Н2↑ │1 - процесс восстановления на катоде
Суммируя реакции на аноде и катоде, получаем уравнение, которое в ионной форме, выражает происходящую в гальванической паре реакцию.
Mg(0) + 2Н (+) → Mg(2+) + Н2↑
Схема гальванической пары
А (-) | Mg | H(+) | Fe | К (+)
Из этого задания надо выбрать протектор.
И какие примеры могут для катодной и протекторной защиты Fe
ni, cr, ag, ca в морской воде
ОСНОВНЫЕ МЕТОДЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ
Одним из основных способов является нанесение защитных покрытий на изделия. Защитные покрытия - слои, искусственно создаваемые на поверхности металлических изделий для предохранения их от коррозии. Защитные покрытия делятся на неметаллические неорганические (оксидные, фосфатные, хроматные), неметаллические органические (лакокрасочные и полимерные) и металлические покрытия. Покрытия неметаллические неорганические и органические механически защищают металлы от коррозии, изолируя их от контакта с внешней средой.
Металлические покрытия по характеру защитного действия делятся на анодные и катодные.
а) анодным называется покрытие, стандартный потенциал которого меньше, чем у защищаемого металла. При нарушении слоя анодного покрытия возникают коррозионные Г.Э., в которых металл покрытия играет роль анода и корродирует, а на защищаемом металле - катоде - восстанавливается окислитель. Например, для железа j 0 (Fe 2+ /Fe) = -0,44B анодными будут покрытия – цинк, j 0 (Zn 2+ /Zn) =-0,76В, хром (j 0 (Cr 3+ /Cr) = -0,71В)
б) катодным называется покрытие, стандартный потенциал которого больше, чем у защищаемого металла. При нарушении катодного покрытия образуется ГЭ, в котором металлическое покрытие будет катодом, а защищаемый металл – анодом.
Например, катодные покрытия для меди (j 0 (Сu 2+ /Сu) = +0,337В) - серебро (j 0 (Ag + /Ag) = 0,799B, золото (j 0 (Au + /Au) = 1,68B).
Протекторная защита - к изделию присоединяют металл или сплав, потенциал которого значительно меньше потенциала изделия. Такие металлы или сплавы называются протекторами, чаще всего это Al, Mg, Zn. В коррозионной среде металл протектора растворяется, а на защищаемом металле протекают катодные процессы.
Пример 10 Подберите протектор для защиты изделия из сплава Sn-Pb от коррозии в водном растворе с рН = 1; Составьте уравнения процессов коррозии.
Анодный: А(Mn) : Mn – 2e® Mn 2+ х3
Катодный К(Sn-Pb): 2H + + 2e ®H2 - водородная деполяризация
O2 + 4H + +4e ® H2O - кислородная деполяризация
Суммарный процесс: 3Mn + 6H + + O2 ® 3Mn 2+ =H2 + H2O
61. Медный кабель находится в свинцовой оболочке. Среда – влажный воздух с рН = 7. Что будет корродировать, при нарушении оболочки? Напишите уравнения электродных процессов и суммарной реакции коррозии. Составьте схему коррозионного Г.Э.
62. Определите, какой из металлов: никель, кадмий или марганец является протектором для конструкции из железа. Опишите электродные и суммарный процессы коррозии во влажной среде с рН = 8.
63 Определите, какой металл будет растворяться при коррозии сплава никель-кобальт в растворе щелочи с рН =12. Напишите уравнения электродных процессов и суммарной реакции.
64. Деталь из латуни ( сплав медь-цинк ) помещена в раствор с рН = 11. С какой деполяризацией будет протекать коррозия? Напишите уравнения электродных и суммарного процессов коррозии. Будут ли при коррозии протекать побочные процессы?
65. Подберите анодное покрытие для серебра. Определите, с какой деполяризацией будет протекать коррозия при нарушении покрытия во влажной среде с рН = 5. Напишите уравнения электродных процессов и суммарной реакции коррозии.
66. Деталь из сплава хром-никель находится в щелочном растворе с рН = 10, кислород отсутствует. Какой из компонентов сплава будет растворяться при коррозии. Составьте уравнения электродных процессов, нарисуйте схему коррозионного Г.Э.
67. Составьте уравнения электродных процессов и суммарной реакции, происходящих при атмосферной коррозии (рН = 7) луженого железа и луженой меди в случае нарушения целостности покрытия.
68. Будет ли корродировать деталь из сплава кадмий-олово в 0,001М растворе серной кислоты в отсутствии кислорода? Опишите уравнения электродных процессов, если коррозия возможна.
69. Можно ли хранить в контакте магний и алюминий во влажной среде с рН = 7? Ответ мотивируйте.
70. Алюминиевые детали изделия склепаны медными заклепками. Какие процессы происходят в местах контакта алюминия и меди в морской воде с рН = 6,5?
71. Подберите катодное и анодное покрытия для кобальта. Опишите процессы коррозии в кислой среде с рН = 2 в присутствии кислорода при нарушении целостности катодного и анодного покрытий.
72. В контакте с каким из металлов: цинком, кобальтом, медью кадмий будет корродировать? Напишите уравнения электрохимической коррозии в кислой среде с рН = 5.
73. Возможна ли коррозия серебра в средах : а) с рН = 2, б) с рН =12. Опишите процессы коррозии, нарисуйте схему коррозионного Г.Э.
74. Какой из металлов: медь или никель – будет корродировать в растворе соляной кислоты с концентрацией С = 0,001М в отсутствии кислорода. Напишите электродные реакции и суммарный процесс коррозии. Нарисуйте схему коррозионного Г.Э.
75. Напишите электродные реакции и суммарные процессы коррозии железа во влажной среде с рН = 5
а) в присутствии кислорода, б) без кислорода.
76. Магний корродирует в растворе хлорида натрия при контакте раствора с воздухом. Напишите электродные реакции и суммарный процесс коррозии, если рН = 7.
77. Для какого из металлов: цинка, марганца или олова кадмий может служить протектором при защите от коррозии в водном растворе с рН = 10.Напишите уравнения электродных процессов и суммарной реакции коррозии. Составьте схему коррозионного Г.Э.
78. Каким покрытием является хром – катодным или анодным – по отношению к алюминию. Какой из металлов будет корродировать в случае нарушения поверхностного слоя покрытия в атмосфере влажного воздуха с рН = 6,5. Составьте схему коррозионного Г.Э.. Напишите уравнения электродных процессов при коррозии.
79. Изделие из хрома, спаянного со свинцом, находится в водном растворе с рН = 10. Опишите электродные процессы и суммарную реакцию процесса коррозии изделия. Подберите к изделию протектор.
80. Какой из перечисленных металлов: золото, медь, серебро, - будет разрушаться в атмосфере влажного воздуха при рН = 7. Напишите уравнения электродных процессов и суммарной реакции для коррозии этого металла. Составьте схему коррозионного Г.Э. Подберите для этого металла анодное покрытие.
81. Какие из приведенных металлов:Fe, Pb, Sn, Cu , будут корродировать в водных средах в отсутствии кислорода:а) рН = 2; б) рН =7. Напишите уравнения электродных процессов и суммарной реакции металла в кислой среде.
82 Приведена схема коррозионного гальванического элемента в растворе серной кислоты при нарушении целостности хромового покрытия на железе.
Определите, с какой деполяризацией будет протекать процесс. Напишите уравнения процессов коррозии и укажите деполяризаторы процесса.
83. Подберите анодное покрытие для сплава олово-никель. Напишите электродные процессы и суммарную реакцию коррозии во влажном воздухе при рН = 6 в случае нарушения целостности покрытия. Составьте схему образующегося коррозионного гальванического элемента.
84. В контакте находятся серебро и свинец. Какой из металлов будет корродировать и с какой деполяризацией в растворе с рН = 12. Напишите уравнения коррозионного процесса. Составьте схему коррозионного Г.Э.
85. Каким является цинковое покрытие на меди – катодным или анодным. Опишите процессы коррозии в щелочном растворе с рН = 8 при нарушении покрытия. Составьте схему коррозионного Г.Э.
86. Никель покрыт золотом и находится в растворе соляной кислоты. Коррозия никеля происходит при нарушении целостности покрытия в результате работы гальванического коррозионного элемента: опишите процессы коррозии и составьте схему коррозионного Г.Э.
87. Подберите к олову катодное и анодное покрытия. Напишите уравнения электродных процессов и суммарной реакции во влажном воздухе с рН = 4,5: а) при нарушении целостности катодного покрытия; б) при нарушении целостности анодного покрытия.
88. Какой из металлов(никель, железо, алюминий) может быть протектором от коррозии кадмия в растворе с рН = 10. Напишите уравнения протекающего процесса коррозии с выбранным протектором. Составьте схему коррозионного Г.Э.
89. Какие металлы (железо, олово, медь, серебро, цинк) будут разрушаться в воде (рН = 7), из которой удален кислород? Для одного из корродирующих металлов напишите уравнения электродных процессов и суммарной реакции коррозии. Составьте схему коррозионного Г.Э.
90. Напишите уравнения электродных реакций и суммарного процесса коррозии кобальта в водном растворе с рН =3: а) в присутствии кислорода, б) в отсутствии кислорода. Составьте схемы коррозионных Г.Э.
При контакте с каким из металлов - Pb или Zn, будет корродировать стальное изделие во влажной атмосферной среде? Составить электронное
В 20:38 поступил вопрос в раздел ЕГЭ (школьный), который вызвал затруднения у обучающегося.
Вопрос вызвавший трудности
При контакте с каким из металлов - Pb или Zn, будет корродировать стальное изделие во влажной атмосферной среде? Составить электронное уравнение катодного и анодного процессов.
Для того чтобы дать полноценный ответ, был привлечен специалист, который хорошо разбирается требуемой тематике "ЕГЭ (школьный)". Ваш вопрос звучал следующим образом: При контакте с каким из металлов - Pb или Zn, будет корродировать стальное изделие во влажной атмосферной среде? Составить электронное уравнение катодного и анодного процессов.
После проведенного совещания с другими специалистами нашего сервиса, мы склонны полагать, что правильный ответ на заданный вами вопрос будет звучать следующим образом:
Стальное изделие будет корродировать при контакте с менее активным металлом, т.е. с металлом, имеющим больший эл. потенциал и находящимся правее железа в электрохимическом ряду напряжений. Таким металлом является Pb. В этом случае стальное изделие будет являться анодом, а свинец - катодом.
Анод: 2Fe – 4e- → 2Fe2+
Во влажной атмосферной среде на катоде происходит кислородная деполяризация воды:
Катод: 2H2O + O2 + 4e- → 4OH-
НЕСКОЛЬКО СЛОВ ОБ АВТОРЕ ЭТОГО ОТВЕТА:

Работы, которые я готовлю для студентов, преподаватели всегда оценивают на отлично. Я занимаюсь написанием студенческих работ уже более 4-х лет. За это время, мне еще ни разу не возвращали выполненную работу на доработку! Если вы желаете заказать у меня помощь оставьте заявку на этом сайте. Ознакомиться с отзывами моих клиентов можно на этой странице.
Федотова Номи Альбертовна - автор студенческих работ, заработанная сумма за прошлый месяц 61 777 рублей. Её работа началась с того, что она просто откликнулась на эту вакансию
ПОМОГАЕМ УЧИТЬСЯ НА ОТЛИЧНО!
Выполняем ученические работы любой сложности на заказ. Гарантируем низкие цены и высокое качество.
Деятельность компании в цифрах:
Зачтено оказывает услуги помощи студентам с 1999 года. За все время деятельности мы выполнили более 400 тысяч работ. Написанные нами работы все были успешно защищены и сданы. К настоящему моменту наши офисы работают в 40 городах.
Ответы на вопросы - в этот раздел попадают вопросы, которые задают нам посетители нашего сайта. Рубрику ведут эксперты различных научных отраслей.
Полезные статьи - раздел наполняется студенческой информацией, которая может помочь в сдаче экзаменов и сессий, а так же при написании различных учебных работ.
Красивые высказывания - цитаты, афоризмы, статусы для социальных сетей. Мы собрали полный сборник высказываний всех народов мира и отсортировали его по соответствующим рубрикам. Вы можете свободно поделиться любой цитатой с нашего сайта в социальных сетях без предварительного уведомления администрации.
Коррозия при непосредственном контакте различных металлов
Рассмотрим коррозию железа, находящегося в контакте с медью в кислой среде, например водном растворе НС1(рис.11). В образующемся гальваническом элементе анодом является железо (Е° Fe/Fe2+ = -0,44 В), а като-
Рисунок 11- Коррозии железа при контакте с медью в кислой среде (рН <7)
Следовательно, железо на поверхности окисляется, образующиеся при этом свободные электроны перемещаются от железа к меди (на катод), где участвуют в процессе восстановления ионов водорода (Н + ), находящихся в электролите (рН < 7):
Анод: Fe│ Fe° - 2 е → Fe 2+
Катод: Сu | 2Н + +2 ё → Н2
Если в электролите не содержится кислоты (рН > 7), то анодный процесс не изменится, но на катоде будет восстанавливаться растворённый в воде кислород:
При контакте железа с металлом, имеющим меньший потенциал, например с цинком (E°Zn/Zn2+ = - 0,76 В), в возникающем гальваническомэлементе анодом будет являться цинк, а катодом - железо. Коррозии в данном случае будет подвергаться цинк, а железо разрушаться не будет, так как катодные реакции не затрагивают металл катода:
Анод: Zn│Zn° - 2 ё → Zn 2+
Катод: Fe │2Н + + 2 ё → Н2 (в кислой среде),
Анод:Zn│Zn° - 2 ё → Zn│2
Катод: Fe │О2+2Н2О + 4ё →4(ОН) - │1(в отсутствие кислоты)
Таким образом, контакт с цинком предотвращает коррозию железа, что часто используется для защиты стальных изделий от коррозии. Соединения металлов в сплавах также обладают электропроводностью, а следовательно, могут участвовать в работе гальванических элементов.
Рассмотрим атмосферную коррозию стали (рис. 12).
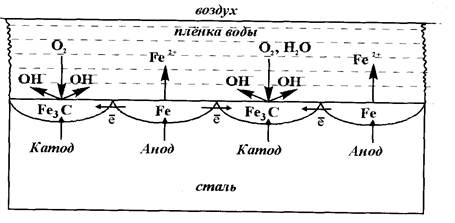
Рисунок 12 - Атмосферная коррозия стали
В составе стали всегда имеются кристаллиты феррита (железо) и цементита (карбид железа - Fe3C). Так как Е°Fе< Е°Fе3С , то при наличии влаги (электролита) на поверхности стали между кристаллами Fe и Fe3C возникает множество микрогальванических элементов, в которых анодом будут частицы железа (феррита), а катодом - кристаллиты цементита:
Анод:Fe │Fe° - 2 ё → Fe 2+ │2
Образующиеся на аноде и катоде ионы соединяются в нерастворимый гидроксид:
который быстро окисляется кислородом воздуха:
Получающийся таким образом Fe(OH)3 составляет основу ржавчины.При высыхании он может частично или полностью терять воду, превращаясь в метагидроксид FeO(OH), или Fe2О3. Ржавчина представляет собой бурый, рыхлый налет, не защищающий металл от дальнейшего разрушения.
2) Коррозия при неравномерной аэрации разных участков поверхности одного металла
Неравномерная аэрация означает неодинаковое содержание кислорода воздуха в электролите (воде) у разных участков поверхности металла. Известно, что с ростом концентрации растворённого в электролите (воде) кислорода, возрастает и значение электродного потенциала металла.
Если на гладкую железную пластинку нанести каплю водного раствора соли (например, NaCl), то по краям капли (там, где кислорода больше) образуются катодные участки, а анод будет находиться там, где содержание кислорода меньше всего - в центре капли. Там же (на аноде) будет происходить окисление, то есть коррозия железа. По краям капли на поверхности железной пластинки происходит восстановление кислорода с образованием ионов ОН - . Эти ионы образуют с ионами железа нерастворимые гидроксиды (ржавчина) в виде колец между центром и краями капли, как показано на рис.13.
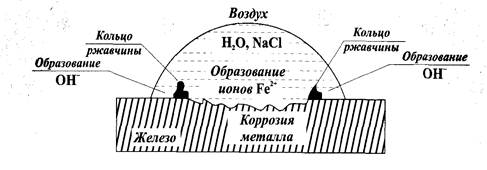
Рисунок 13 - Коррозия железа в условиях неравномерной аэрации
Запишем анодный и катодный процессы:
Анод: Fe - центр капли│Fe° - 2 ё → Fe 2+ │2
Катод: Fe - край капли│О2+2Н2О + 4ё →4(ОН) - │1
Аналогичные процессы будут происходить и в других случаях неравномерной аэрации: коррозии в первую очередь подвергается тот участок поверхности металла, доступ кислорода воздуха к которому затруднён.
3) Коррозия под действием блуждающих токов
Источником подземных блуждающих токов могут быть различные устройства, работающие на постоянном токе. Это электропоезда, метро, трамваи, троллейбусы, установки для электросварки, электролизёры и т.д. Коррозию под действием внешнего источника электрического тока называют электрокоррозией.
Рассмотрим коррозию подземного стального трубопровода во влажной почве под действием блуждающих токов (рис.14).
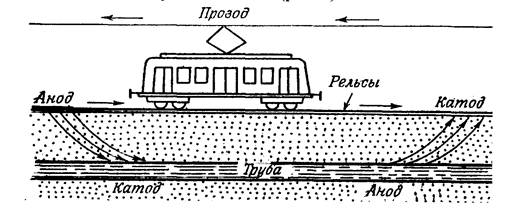
Рисунок 14 - Коррозия подземных коммуникаций под действием блуждающих токов
В месте входа тока в трубопровод возникает катодный участок, и на этом участке будет протекать реакция восстановления молекулярного кислорода, находящегося во влажной почве. Участок металла трубопровода, где происходит выход тока, становится анодом и разрушается.
Анод: Fe│Fe° - 2 ё → Fe 2+ │2
Коррозия под действием блуждающих токов обычно приводит к быстрому разрушению подземных металлических конструкций.
Читайте также:
