При взаимодействии галогенов с металлами образуются
Обновлено: 05.10.2024
Галогены – элементы, находящиеся в VIIA группе. Они взаимодействуют со многими неорганическими и органическими соединениями. К ним относятся:
- фтор F;
- хлор Cl;
- бром Br;
- йод I;
- астат At.
Галогены широко распространены в природных условиях.
Строение галогенов
На наружном уровне галогенов располагается шесть спаренных и один неспаренный электрон. До устойчивого состояния элементам недостает одного электрона, поэтому они относятся к сильным окислителям. Молекулы галогенов состоят из двух атомов.
У галогенов в соединениях, как правило, отрицательная степень окисления:
В некоторых соединениях для них характерна положительная степень окисления:
Фтор – самый электроотрицательный элемент, который окисляет даже кислород. Таким образом, существует фторид кислорода OF2.
Закономерности галогенов
Для получения галогенов в свободном состоянии, необходимо оценить способность ионов к окислению. В ряду F-Cl-Br-I увеличивается атомный радиус. Значит, иону сложнее удерживать электроны и, таким образом, окислительные свойства в ряду уменьшаются.
В ряду F-Cl-Br-I уменьшается электроотрицательность. Следовательно, фтор – самый активный элемент. У него самый маленький атомный радиус, поэтому он активно притягивает к себе электроны.
Физические свойства
Для галогенов характерна молекулярная решетка. С этим связаны низкие температуры плавления и кипения, которые по мере увеличения атомной массы повышаются.
В ряду химических элементов F-Cl-Br-I повышается плотность вещества. В нормальных условиях галогены выглядят следующим образом:
- фтор – светло-желтый газ;
- хлор – желто-зеленый газ;
- бром – оранжевая жидкость;
- йод – темно-фиолетовые кристаллы.
Галогены ядовиты и издают неприятный аромат. Они практически не растворимы в воде. Только фтор может реагировать с водой.

Способы получения
Получение хлора
В промышленности хлор получают путем электролиза.
- Электролиз расплава хлорида натрия
- 2 NaCl → 2Na + Cl2
- К (-): Na+ + 1 e → Na 0
- А (+): 2 Cl- - 1 e → Cl2 0
- Электролиз раствора хлорида натрия
- 2NaCl + 2H2O → H2 + 2NaOH + Cl2
- К (-): 2H2O + 2 e → H2 0 + 2OH -
- А (+): 2Cl - - 1 e → Cl2 0
В лаборатории хлор получают при реакции соляной кислоты и сильных окислителей.
Получение фтора
Фтор получают с помощью электролиза расплава.
Получение брома
Бром получают с помощью окисления.
Получение йода
Йод получают с помощью окисления.
Химические свойства
Галогены – окислители, которые реагируют с металлами и неметаллами.
- С серой
- S + Cl2 → SCl2
- С фосфором
- 2Р + 3Cl2 → 2РCl3
- 2Р + 5Cl2 → 2РCl5
- С углеродом
- 2F2 + C → CF4
- С металлами
- 2Fe + 3Cl2 → 2FeCl3 Для ряда химических элементов F-Cl-Br характерно образование галогенидов железа (III), а для йода — железа (II). При реакциях с медью продукты аналогичны.
- С водородом
- F2 + Н2 → 2НF
- С галогенами (более активные вытесняют менее активные галогены)
- Cl2 + F2 → 2ClF
В реакциях со сложными веществами галогены ведут себя как окислители.
Применение галогенов
Костная ткань и зубная эмаль включают соединения фтора. При недостатке фтора зубная эмаль разрушается. В состав плазмы крови входят различные хлориды. Соединения брома регулируют процессы торможения и возбуждения нервной системы. Йод регулирует работу щитовидной железы, а также контролирует обмен веществ.
Фторид кислорода используется в производстве ракетного топлива. Соединения фтора входят в состав зубных паст. С помощью молекулярного хлора обеззараживают воду, а также используют для отбеливания тканей, бумаги, древесины. Поваренная соль – хлорид натрия, который добавляется в пищу. А хлорид калия применяется в качестве удобрения.
2.3.1. Химические свойства водорода и галогенов.
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s 1 . С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов. Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов. Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
![2.3.1. Химические свойства водорода и галогенов.]()
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
Галоген
Физические свойства
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns 2 np 5 , где n – номер периода таблицы Менделеева, в котором расположен галоген. Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике. Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены. К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5). При этом происходит образование пентафторида фосфора:
При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
VII группа главная подгруппа периодический таблицы Менделеева (галогены)
К элементам главной подгруппы VII группы периодической таблицы Менделеева относятся элементы с общим названием «галогены»:
Общая характеристика галогенов
От F к At (сверху вниз в периодической таблице)
Увеличивается
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
![Периодическая таблица_7 группа]()
Электронные конфигурации у данных элементов схожи, они содержат 7 электронов на внешнем слое ns 2 np 5 :
Br – 3d 10 4s 2 4p 5 ;
I — 4d 10 5s 2 5p 5 ;
At – 4f 14 5d 10 6s 2 6p 5
Электронная конфигурация фтора и хлора
![Электронная конфигурация_фтор, хлор]()
Электронная конфигурация брома и йода
![Электронная конфигурация_бром, йод]()
Нахождение в природе галогенов
Галогены являются химически активными веществами, в связи с чем, в природе они встречаются только в виде соединений. Их распространённость в земной коре снижается при увеличении атомного радиуса (от фтора к иоду). Например, содержание астата в земной коре исчисляется граммами.
Наиболее распространённые соединения фтора — флюорит CaF2, криолит Na3AlF6 и др., хлора — каменная соль (галит) NaCl, сильвин KCl и сильвинит KCl⋅NaCl.
Бром и иод не образуют индивидуальных минералов, но их соединения содержатся в морской воде и могут накапливаться водорослями.
![галогены_нахождение в природе]()
Способы получения фтора
Фтор получают методом электролиза расплава гидрофторида калия (смеси HF и KF):
Физические свойства фтора
![газ-фтор]()
Фтор при обычной температуре — зеленовато-жёлтый ядовитый газ, с резким запахом, очень реакционноспособный, хорошо растворим в жидких водороде и кислороде.
Химические свойства фтора
Фтор является самым сильным окислителем из всех простых веществ. Непосредственно он не взаимодействует только с N2, Не, Ne, Аr, а при нормальных условиях также и с O2.
Взаимодействие с простыми веществами
С кислородом
Реакция протекает при электрическом разряде (2100-2400 В, 25-30 мА), температуре от -196°C до -183°C и давлении 12 мм рт.ст. с образованием дифторида трикислорода (триоксодифторид, фторид озона) или фторида кислорода:
С галогенами (Cl, Br, I)
Фтор вступает в реакции с другими галогенами:
Например, Cl2 + F2 → 2ClF
С водородом
Взаимодействует с водородом со взрывом даже в темноте:
С серой
Реакция с серой протекает легко даже при сильном охлажлении:
С углеродом
Реакция окисления порошкообразного углерода сопровождается самовоспламенением последнего:
С азотом
При нагревании фтор реагирует и с азотом:
С фосфором
Фтор взаимодействует с P энергично (со взрывом) на свету и в темноте, даже при охлаждении жидким N2:
С кремнием
Взаимодействует с кремнием с образованием фторида кремния
C инертными газами
Окисляет ксенон, образуя фторид ксенона:
С металлами
При взаимодействии с металлами образуются фториды:
- К, Na, Pb, Feзагораются при обычной температуре на свету. С щелочными металлами реакция протекает со взрывом:
- Mg, Zn, Sn, Al, Ag, Cu и др. загораются на свету при слабом нагревании:
- с малоактивными металлами – Au, Pt реагирует при нагревании до 300-400°С
Взаимодействие со сложными веществами
С водой
Фтор активно разлагает воду с образованием таких соединений, как фториды кислорода OF2, O2F2; пероксид водорода Н2O2; кислород, озон, фтороводород:
С кислотами
- Взаимодействует с безводной азотной кислотой при комнатной температуре с образованием диоксида-гипофторита азота и фтороводорода:
- С серной кислотой образует гексафторид серы, фтороводород и кислород:
С щелочами и аммиаком
Фтор окисляет щелочи:
Реагирует с газообразным аммиаком:
С солями
Не взаимодействует
Взаимодействие фтора с водными растворами солей невозможны, т.к. он ступает в реакцию с водой.
С оксидами
Реагирует с оксидом кремния, который загорается в атмосфере F2:
Способы получения хлора
Промышленный способ
Электролиз расплавов или водных растворов хлоридов, чаще – NaCl.
- Электролиз расплава хлорида натрия:
A(+): 2Cl − ̶ 2e → Cl2 0
2Na + + 2Cl − → 2Na º + Cl2º
Таким образом, получаем:
- Электролиз раствора хлорида натрия.
Лабораторный способ
Окисление концентрированной HCI сильными окислителями:
Физические свойства хлора
Хлор Cl2 при обычной температуре – тяжелый, желто-зеленый газ с резким удушающим запахом.
![газ-хлор]()
Cl2 в 2,5 раза тяжелее воздуха, малорастворим в воде (~ 6,5 г/л); хорошо растворим в неполярных органических растворителях. В свободном состоянии встречается только в вулканических газах.
Химические свойства хлора
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, с образованием в устойчивые хлорид-ионы:
Непосредственно не взаимодействует
С галогенами
Хлор взаимодействует с другими галогенами – более активные галогены окисляют менее активные. В зависимости от условий могут получиться различные соединения:
Реакция с водородом при обычных условиях не протекает. Однако, при нагревании, УФ — освещении или электрическом разряде реакция протекает со взрывом:
С фосфором
Непосредственно не взаимодействует
С кремнием
2Cl2 + Si = SiCl4 (при нагревании)
- Активные металлы самовоспламеняются и горят в атмосфере сухого газообразного хлора:
- Окисление малоактивных металлов происходит легче влажным хлором или его водными растворами:
Окисляет сложные вещества:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кипячении)
С водой
При растворении хлора в воде вступает в реакцию диспропорционирования (самоокисления-самовосстановления), с образованием хлорноватистой кислоты:
С водными растворами щелочей
При взаимодействии с щелочами хлор диспропорционирует с образованием солей, состав которых зависит от условий проведения реакции:
- с холоднымраствором щелочи образуются хлорид и гипохлорит:
- с горячимраствором щелочи образуются хлорид и хлорат:
- Хлор также растворяется в холодном растворе гидроксида кальция:
Эти реакции имеют важное практическое значение, приводят к получению гипохлоритов — КClO3 и Са(ClO)2; хлората калия (бертолетова соль) — КClO3
Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов:
HC ≡ CH + 2Cl2 → Cl2HC — CHCl2 1,1,2,2-тетрахлорэтан
Способы получения брома
- Исходное сырьё для получения брома — морская вода, озёрные и подземные рассолы и щелока калийного производства, содержащие бром в виде бромид-иона Br-
Бром втесняют при помощи хлора:
Далее бром отгоняют из раствора водяным паром или воздухом.
Лабораторный способ
- В лаборатории для получения брома используют сильные окислители:
Физические свойства брома
![бром_фото]()
В обычных условиях бром – красно-бурая жидкость с резким зловонным запахом. При Т=-7,2°C жидкий бром застывает, образуя красно-коричневые игольчатые кристаллы.
Пары брома жёлто-бурого цвета, Ткип = 58,78°C.
В воде бром растворяется лучше других галогенов (3,58 г брома в 100 г H2O при 20°C). Хорошо растворим во многих органических растворителях.
Бромная вода имеет желто-бурую окраску, быстро исчезающую, при взаимодействии растворенного Br2 с каким-либо веществом. «Обесцвечивание бромной воды» — широко используется в качестве теста на обнаружение в растворе многих неорганических и органических веществ.
Химические свойства брома
Химические свойства брома сходны с хлором. Различаются только условия протекания реакций.
Взаимодействие с простыми веществами
С металлами
Жидкий бром сильный окислитель. Например, железо и алюминий самовозгораются при соприкосновении с бромом даже при обычной температуре.
Взаимодействие брома с водородом происходит лишь при повышенной температуре. Реакция эндотермической и обратимой.
С азотом, углеродом, кислородом и благородными газами
Бром окисляется более активными галогенами:
Взаимодействие со сложными веществами
- диспропорционирует в водном растворе:
3BrO — ↔ BrO3 — + 2Br —
4BrO — ↔ BrO4 — + 3Br —
Обесцвечивание бромной воды
Обесцвечивание бромной воды – качественная реакция на многие неорганические и органические соединения:
- в воде SO2 и H2S в газообразном и растворенном виде, а также растворимые сульфиты и сульфиды реагируют с бромной водой, обесцвечивая ее:
- Обесцвечивание бромной воды непредельными органическими соединениями:
- Фенол и анилин также легко взаимодействуют с бромной водой:
Способы получения йода
- Йод, также как и бром, извлекают из морской воды, соленых озер, подземных рассолов и буровых вод, где он содержится в виде I — .
- Получение свободного йода с помощью различных окислителей, чаще всего газообразного хлора:
- Йод можно получить также как и хлор или бром действием различных окислителей (КМnО4, МnО2, КСlO3, КВrО3, FеСl3 и СuSO4) на иодоводородную кислоту:
2 FеC3 + 2 НI = 2 FeCl2 + I2 + 2 НСl
Физические свойства йода
Свободный йод I2 при обычной температуре — черно-серое с фиолетовым оттенком кристаллическое вещество с металлическим блеском. Легко возгоняется. Пары йода имеют своеобразный запах и очень ядовиты.
![йод_фото]()
Среди галогенов I2 обладает самой меньшей растворимостью в воде, однако он хорошо растворим в спирте и других органических растворителях.
Химические свойства йода
Химическая активность йода – наименьшая по сравнению с другими галогенами. Со многими элементами йод непосредственно не взаимодействует, а с некоторыми реагирует только при повышенных температурах (водород, кремний, многие металлы).
Йод-крахмальная реакция
Обнаружить I2 даже в самой минимальной концентрации можно с помощью раствора крахмала, который при наличии I2 окрашивается в грязно-синий цвет.
Йод-крахмальная реакция используется при качественном обнаружении йода, а также его количественного анализа
С водородом
Реакция обратима и возможна только при высокой температуре:
При добавлении капли воды в качестве катализатора цинк, железо и алюминий в смеси с порошком йода горят, образуя йодиды:
С азотом, углеродом, кислородом
С водой
Частично реагирует с водой (реакция диспропорционирования):
С щелочью
Диспропорционирует в водном растворе щелочи:
C аммиаком
C аммиаком образует аддукт нитрид трииодида:
С иодидами щелочных металлов
Молекулы галогенов присоединяются к иодидам щелочных металлов с образованием полииодидов (периодидов):
С окислителями
Йод проявляет восстановительные свойства в реакциях с сильными окислителями:
C восстановителями
Иод менее сильный окислитель, чем фтор, хлор и бром. Восстановители, такие как H2S, Na2S2O3 и др. восстанавливают его до иона I − :
При взаимодействии галогенов с металлами образуются
![]()
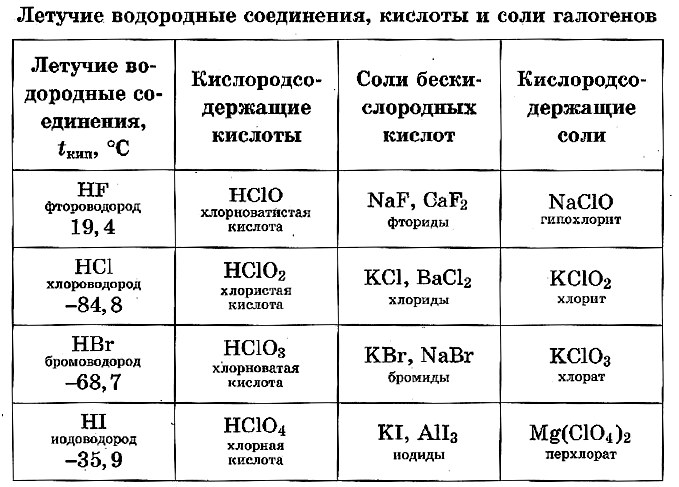
Галогены. Элементы VIIA-группы. Хлор, фтор
Ключевые слова: галогены, VIIA-группа, хлор, фтор, бром, йод, характеристика элемента, строение галогенов, получение хлора.
Раздел ОГЭ: 3.1.2. Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремнияГалогены (от греч. hals – соль и лат. genui – рождать, т. е. «рождающие соли») — это элементы VIIA-группы – фтор F, хлор Cl, бром Вг, йод I. Электронная конфигурация валентного слоя атомов галогенов в стационарном состоянии ns 2 np 5 . Радиусы атомов галогенов от фтора к йоду увеличиваются, энергия ионизации и электроотрицательности уменьшается, неметаллические свойства ослабляются.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ХЛОР
Высший оксид хлора – оксид хлора (VII) Cl2О7 – кислотный оксид, высшим гидроксидом хлора является хлорная кислота НСlO4 (сильная кислота).
Водородное соединение хлора – хлороводород НCl (газ при обычных условиях), его водный раствор – соляная кислота, сильный электролит.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ФТОР
В атоме фтора нет вакантных орбиталей на втором энергетическом уровне для перехода атома в возбуждённое состояние. Переход на вакантные орбитали третьего энергетического уровня потребовал бы слишком больших затрат энергии, следовательно, фтор может быть только одновалентен.
Электроотрицательность фтора среди других элементов максимальна (∼4,0 по шкале Полинга). Следовательно, для фтора невозможны положительные степени окисления. Возможные степени окисления фтора: 0 (F2) и –1 (HF, KF и т. д.).
СТРОЕНИЕ ГАЛОГЕНОВ – ПРОСТЫХ ВЕЩЕСТВ
Галогенам не присуща аллотропия, каждому элементу – галогену (Hal) соответствует одно простое вещество Наl2. Галогены – вещества молекулярного строения.
При обычных условиях фтор F2 – зеленовато–жёлтый газ; хлор Cl2 – жёлто–зелёный газ; бром Вг2 – красно–бурая жидкость, примерно в 3 раза тяжелее воды; йод I2 – фиолетово–чёрные кристаллы с металлическим блеском. Все галогены обладают характерным запахом.
Хлор, бром, йод умеренно растворимы в воде, их растворы называются соответственно хлорной, бромной и йодной водой (фтор с водой реагирует).
![]()
![]()
ПОЛУЧЕНИЕ ХЛОРА
В промышленности хлор получают электролизом расплава поваренной соли.
Лабораторные способы получения хлора основаны на окислении хлора в соляной кислоте с помощью таких окислителей, как перманганат калия, дихромат калия или диоксид марганца. Приведём примеры этих реакций:
Конспект урока по химии «Галогены. Элементы VIIA-группы. Хлор, фтор «. Выберите дальнейшее действие:
Читайте также: