Различия в строении атомов типичных металлов и типичных неметаллов
Обновлено: 05.07.2024
Наш мир наполняют различные простые вещества – металлы или неметаллы. При существовании 120 химических элементов, Вселенную наполняют более 400 простых веществ. Этот парадокс связан с понятием аллотропии – явлением образования одним химическим элементом двух и более простых веществ. Например, атом кислорода может формировать молекулярный кислород О2 и озон О3.
План урока:
Физические свойства металлов
Металлы – химические элементы, атомы которых в процессе реакции стремятся отдавать электроны. Они обладают металлической кристаллической решеткой и общими физическими свойствами. На данный момент известно более 87 металлов.
Для металлов характерен ряд свойств:
- твердость (кроме ртути, которая представляет собой жидкость);
- металлический блеск;
- проводимость электрического тока и тепла;
- пластичность.
Металлы при ударах не разрушаются, а меняют форму. С этой особенностью связано то, что из них производят проволоку, металлические листы и др. Развитие бронзового и железного века связано с производством товаров из металлов.
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.
Для неметаллов характерен ряд свойств:
- хрупкость (неметаллы нельзя ковать);
- отсутствие блеска;
- непроводимость электрического тока и тепла.
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.
Красные ячейки – неметаллы, синие – металлы
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.
Красные ячейки – полуметаллы
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.
Способы получения металлов
Большую часть металлов получают из оксидов при нагревании.
Металлы, имеющие на внешнем уровне один-два электрона, получают с помощью электролиза расплавов.
Химические свойства металлов
Все металлы проявляют восстановительные свойства. Легкость в отдачи внешнего электрона применяется в фотоэлементах. Степень активности определяется рядом активности. У самых активных на внешнем уровне располагается по одному электрону.
Общие химические свойства металлов выражаются в реакциях со следующими соединениями.
Активные металлы реагируют с галогенами и кислородом. С азотом взаимодействуют только литий, кальций и магний. Большинство металлов при взаимодействии с кислородом образуют оксиды, а наиболее активные металлы – пероксиды (N2O2).
2 Ca + MnO2 → 2 CaO + Mn(нагревание)
Водород в кислотах вытесняют только те металлы, которые в ряду напряжений стоят до водорода.
Более активные металлы вытесняют из соединений менее активные.
- Химические свойства щелочных и щелочно-земельных металлов (реакции с водой)
2 Na + 2 H2O → 2 NaOH + H2
Способы получения неметаллов
Неметаллы синтезируют из природных соединений с помощью электролиза.
2 KCl → 2 K + Cl2
Также неметаллы получают в результате окислительно-восстановительных реакций.
SiO2 + 2 Mg → 2 MgO + Si
Химические свойства неметаллов
Неметаллы проявляют окислительные свойства. Самый активный неметалл – фтор. Он бурно реагирует со всеми веществами, а некоторые реакции сопровождаются горением и взрывом. В атмосфере фтора горят даже вода и платина. Фтор окисляет кислород и образует фторид кислорода OF2.
Неметаллы вступают в реакции со следующими веществами.
3 F + 2 Al → 2 AlF3 (нагревание)
S + Fe →FeS (нагревание)
Меньшей активностью обладают такие неметаллы как бор, графит, алмаз. Они могут проявлять восстановительные свойства.
2 C + MnO2 → Mn + 2 CO
Коррозия металла
Коррозия – это процесс разрушения металлов или металлических конструкций под действием кислорода, воды и вредных примесей. Не все металлы подвергаются коррозии. Их стойкость зависит от ряда факторов.
- На благородных металлах не образуется коррозия.
- На поверхности алюминия, титана, цинке, хрома и никеля есть оксидная пленка, которая предотвращает процессы коррозии.
Различают несколько видов коррозии – химическую и электрохимическую.
Химическая коррозия
Химическая коррозия сопровождается химическими реакциями. Она образуется под действием газов.
Электрохимическая коррозия
Электрохимическая коррозия – процесс разрушения металлов или металлических конструкций, который сопровождается электрохимическими реакциями. В большинстве металлов находятся примеси. В процессе коррозии электродами могут служить не только металлы, но и его примеси.
Например, в железе могут находиться примеси олова. В этом случае на аноде электроны переносятся от олова к железу и металлы растворяются, т.е. железо подвергаются коррозии. На катоде восстанавливается водород из воды или растворенного кислорода. Электрохимическая коррозия может сопровождаться следующими процессами.
Анод: Fe 2+ - 2e → Fe 0
Катод: 2H + + 2e → H2
Способы защиты от коррозии
В промышленности популярны различные методы защиты металлов от коррозии.
Покрытия защищают поверхности от действия окислителей. Ими служат различные вещества:
- покрытие менее активным металлом (железо покрывают оловом);
- краски, лаки, смазки.
- Создание специальных сплавов
Физические свойства сплавов и чистых металлов отличаются. Поэтому для повышения стойкости в сплав необходимо добавить дополнительные металлы.
Биологическая роль металлов и неметаллов
В организмах содержится множество различных металлов и неметаллов. Различных химических элементов в организме может не хватать, поэтому приходится потреблять их извне.Химические элементы можно разделить на две большие группы – макроэлементы и микроэлементы.
К макроэлементам относятся вещества, содержание которых в организме превышает 0,005 %. Эта группа включает водород, углерод, кислород, азот, натрий, магний, фосфор, сера, хлор, калий, кальций.Микроэлементы – элементы, содержание которых не превышает 0,005%. К ним относятся железо, медь, селен, йод, хром, цинк, фтор, марганец, кобальт, молибден, кремний, бром, ванадий, бор. Каждый макро- и микроэлемент в организме выполняет определенную функцию.
Применение металлов и неметаллов
В синтезе химических препаратов и лекарств применяются чистые металлы и неметаллы. В органической химии металлы используются в качестве катализаторов, а также при получении металлорганических соединений. Неметаллы служат исходным сырьем для получения чистых кислот и других химических соединений.
чем отличается строение атомов и простых веществ неметаллов и металлов
Для атомов неметаллов, по сравнению с атомами металлов характерны: меньший атомный радиус; четыре и более электрона на внешнем энергетическом уровне. Отсюда и такое важнейшее свойство атомов неметаллов – тенденция к приёму недостающих до 8 электронов, т. е. окислительные свойства. А металлы – восстановители. Это обусловлено небольшим числом электронов внешнего слоя. большим радиусом атомов, вследствие что эти электроны слабо удерживаются с ядром. Т. е. неметаллы принимают, а металлы отдают). У металлов мало число электронов на последней электронной оболочке (внешней) . Так металлы первой группы таблицы Менделеева имеют только один электрон. Второй - последняя оболочка имеет два и т. д. Исключения Sn, Pb, Sb, Bi. Это приводит к повышенной активности металлов.
Так натрий приходиться хранить под керосином, иначе он быстро окисляется. Добавлю одно:
- Т. к. внешние электроны слабо удерживаются ядром, они способны свободно перемещаться под воздействием приложенной ЭДС или электромагнитного поля (свойство проводимости и индукции) .
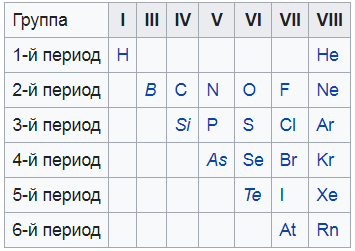
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
Группа III IV V VI VII
2-й период B C N O F
3-й период Si P S Cl
4-й период As Se Br
5-й период Te I
6-й период At
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода четыре формы — графит, алмаз, карбин, фуллерен.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими - мышьяк, селен, иод.
Естественные семейства химических элементов и их свойства
После того как выяснилось, что классификация на металлы и неметаллы не является полной, ученые стали выделять из этих двух больших классов элементы, особенно близкие по свойствам их простых веществ. Такие группы элементов назвали естественными семействами.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Выделяют следующие естественные семейства: Щелочные металлы – Na, K, Cs, Rb, Li. Галогены – F, CI, Br, I.
Щелочные металлы
В любой отрасли науки по мере накопления фактов возникает необходимость в их систематизации и установлении внутренней причинно-следственной связи между ними.
Из курса биологии вы хорошо знакомы с систематизацией в растительном и животном мире. В химии накопление знаний об элементах и их соединениях привело к необходимости их группировки по сходным признакам.
Классификация элементов началась с деления их на металлы и неметаллы, что было предложено шведским химиком Й. Я. Берцелиусом.
Кроме металлов и неметаллов существуют химические элементы, которые проявляют двойственную природу, т. е. обладают свойствами и металлов, и неметаллов в зависимости от условий протекания химических реакций (Be, Zn, Аl и др.). Их оксиды и гидроксиды называют амфотерными веществами (от греческого аmphoteros – оба, тот и другой).
В природе существуют группы элементов со сходными химическими свойствами, их называют естественными семействами элементов. К типичным металлам относятся щелочные металлы. Кроме этих металлов мы будем рассматривать группу галогенов (VIIА) и инертных газов.
Щелочные металлы расположены в IА группе. Это литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr). Франций – радиоактивный элемент. Они называются щелочными металлами, потому что при взаимодействии с водой образуютсильные растворимые основания – щелочи (рис. 39). Общая электронная формула валентных электронов

Щелочные металлы обладают некоторыми общими свойствами: молекулы щелочных металлов состоят из одного атома, очень активные. Поэтому их нужно хранить под слоем керосина. Энергично реагируют с водой, в соединениях проявляют валентность, равную I.
Металлическая активность щелочных металлов усиливается сверху вниз по группе, что связано с возрастанием атомных радиусов в этом направлении.
У щелочных металлов валентные электроны расположены на s-орбитали, поэтому их называют s-элементами. s-элементы в обычных условиях – это кристаллические вещества, которые по сравнению с остальными металлами обладают малыми значениями плотности (табл. 13). Литий, калий и натрий легче воды

Литий по своим свойствам несколько отличается от остальных металлов. С водой литий взаимодействует медленно, натрий – более энергично, калий – наиболее энергично реагирует с водой, вспыхивает фиолетовым пламенем, а рубидий – со взрывом.
Оксиды этих элементов являются основными, им соответствуют основания, хорошо растворимые в воде, – щелочи, основные свойства которых усиливаются сверху вниз по группе.
Литий был открыт в 1817 г. шведским ученым Арфедсоном, натрий и калий – в 1807 г. английским ученым Г. Дэви, рубидий и цезий – в 1861 г. Р. Бунзеном.
Литий используют для изготовления различных свинцовых и алюминиевых сплавов, которые применяются в самолетостроении. Добавка лития к сплавам увеличивает их твердость.
Рубидий и цезий используют для изготовления фотоэлементов.

Галогены и инертные газы
Какие галогены и инертные газы вы знаете? Где они применяются? Что вы знаете об инертных газах? Расскажите об их применении.
В природе существуют группы элементов с противоположными щелочным металлам свойствами, к примеру, галогены (табл. 15).

Галогены – типичные неметаллы, при взаимодействии с металлами образуют соли (галоген означает солерод). Молекулы галогенов двухатомные. Все галогены образуют летучие водородные соединения, растворы которых являются кислотами. В отличие от щелочных металлов, активность элементов по мере возрастания относительных атомных масс у галогенов ослабевает.
Галогены расположены в VIIА группе. Это фтор F, хлор Cl (рис. 41), бром Br, йод I, астат At. Астат – радиоактивный элемент.
Электронная конфигурация внешнего слоя этих элементов


Последний электрон у атомов галогенов поступает на р-орбиталь, поэтому они называются р-элементами. По группе сверху вниз радиусы атомов увеличиваются, в том же направлении растут значения температур кипения и плотности. Агрегатные состояния переходят из газообразного через жидкое а окраска сгущается (от желто-зеленой у хлора до черно-серого с фиолетовым блеском у йода).
Галогены – типичные неметаллы, на внешнем энергетическом уровне у них не хватает одного электрона для завершения слоя, поэтому они легко принимают один электрон, проявляя неметаллические свойства. При этом принимают электронное строение инертного газа, стоящего после них в периодической системе. Кроме фтора, все остальные галогены образуют кислотные оксиды.
В соединениях фтор проявляет валентность, равную I. Остальные галогены проявляют валентности I, III, V, VII.
Неметаллические свойства элементов в группе сверху вниз ослабевают, так как из-за увеличения атомных радиусов сила притяжения электронов к ядру уменьшается.
Еще одна природная группа элементов – инертные газы (табл. 17).
Каждый период в Периодической системе завершается инертным газом. Инертные газы характеризуются низкой химической активностью. Из-за чего такая пассивность? Для разрешения этого вопроса рассмотрим электронное строение этих элементов. У известных вам инертных газов
Это одноатомные газы без цвета и запаха. Среди них самым химически инертным является гелий, более активны криптон и ксенон. В направлении возрастания относительной атомной массы, от He до Xe, наблюдается возрастание температуры кипения и плавления. Усиливается также растворимость газов в воде и других растворителях.

Инертные газы (He, Ne, Ar) применяются в основном при сварке металлов, в лампах, в фонарях, а также как хладагенты при физических исследованиях (рис. 42).
Изучение свойств естественных семейств химических элементов и их соединений помогает нам систематизировать наши знания.
Йод был открыт при «помощи» кошки. Французский ученый Б. Кур-туа приготовил в двух склянках два различных раствора: в первой -концентрированную
Металлы и неметаллы
Вы знаете, что простые вещества в зависимости от электронного строения атомов подразделяются на металлы и неметаллы. Рассмотрим их структуру, свойства и применение в сравнительном аспекте. Обратите внимание на их различия и с чем они связаны.
В периодах в I, II, ІІІ группах находятся в основном металлы, а в IV–VIII главных подгруппах в основном расположены неметаллы.
Если провести диагональ от бора к астату, то справа вверх от диагонали расположены элементы – неметаллы (кроме элементов побочных подгрупп), а слева вниз – элементы металлы. На внешних энергетических уровнях металлов вращаются в основном 1–3 электрона, у неметаллов 4–8 электронов.
Электронное строение металлов Радиусы атомов металлов большие, неметаллы характеризуются малыми значениями радиусов.
В химических реакциях металлы отдают электроны
неметаллы присоединяют и могут отдавать электроны, кроме фтора.
Металлы, кроме ртути, твердые вещества, а неметаллы – твердые (S, P, C, Si, и газообразныеМеталлы и их соединения применяются в тяжелой индустрии, а соединения неметаллов применяются в пищевой, бумажной и текстильной промышленности.
Металлы встречаются в литосфере, а соединения неметаллов чаще находятся в атмосфере.
По распространенности металлы подразделяются на благородные (Au, Ag, Pt), редкие, рассеянные, макро- и микроэлементы; неметаллы по содержанию в живых организмах – на макро-, микро- и ультраэлементы. В недрах земли они встречаются в виде минералов, в морских и водах океанов – в виде соединений.
Оксиды металлов I–II главных подгрупп – основные оксиды, им соответствуют гидроксиды: СаО → Металлы не образуют летучие водородные соединения. Неметаллы образуют летучие водородные соединения кислотного характера, например, иМеталлы обладают характерной особенностью – металлическим блеском, легко куются, вытягиваются, гнутся и прокатываются.
Металлы хорошо проводят электричество и тепло, они хорошие провjдники. Из неметаллов хорошим проводником электрического тока является графит. Многие соединения неметаллов (кристаллический кремний) проявляют полупроводниковые свойства или являются диэлектриками.
- Свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда атомных ядер.
- Группы элементов со сходными физическими и химическими свойствами называются естественными семействами.
- Формулы валентных электронов щелочных металлов ns1, галогенов - ns2np5, а инертных газов - пз2пръ (кроме гелия).
- Щелочные металлы - легко отдают один электрон с внешнего энергетического уровня, а галогены легко присоединяют недостающий до завершения внешнего слоя один электрон.
- В группе металлические свойства щелочных металлов усиливаются сверху вниз, а у галогенов неметаллические свойства в этом направлении ослабевают.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Простые вещества
Простые веществаа — химические вещества, состоящие исключительно из атомов одного химического элемента, в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде; или, иначе говоря, химические элементы, не связанные химически ни с каким другим элементом, образуют простые вещества. Известно свыше 400 разновидностей простых веществ.
Химические вещества, состоящие исключительно из атомов одного химического элемента, в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде; или, иначе говоря, химические элементы, не связанные химически ни с каким другим элементом, образуют простые вещества. Известно свыше 400 разновидностей простых веществ.
Прежде чем приступить к рассмотрению свойств простых веществ, необходимо вспомнить некоторые закономерности, характеризующие способность свободных атомов к перестройке электронной конфигурации. Так, у свободных атомов элементов III периода наблюдаются следующие тенденции:

Результатом реализации отмеченных тенденций, присущих свободным атомам, является образование соответствующих связей в простых веществах. Как известно, в периодах наблюдается постепенный переход от активных металлов (щелочные металлы) к типичным неметаллам (галогены).
При рассмотрении тех же тенденций у свободных атомов в группах периодической системы наблюдаем следующие изменения:

С указанными характеристиками свободных атомов можно связать усиление металлических свойств и ослабление неметаллических с ростом зарядов ядер у элементов одной и той же группы.
Металлы и неметаллы. Относительность деления простых веществ на металлы и неметаллы
Простые вещества, характеризующиеся атомным (ионным) строением и наличием свободных электронов, являются металлами. Эти вещества обладают металлическим блеском, электро- и теплопроводностью. По химическим свойствам металлы являются типичными восстановителями (т. е. легко отдают валентные электроны).
Все простые вещества, образованные атомами элементов дополнительных подгрупп, являются металлами.
Типичными неметаллами являются такие простые вещества^ которые, как правило, состоят из молекул с атомной и ковалентной связью. Не имея свободных электронов, неметаллы по физическим свойствам характеризуются отсутствием электронной проводимости, металлического блеска и т. п. По химическим свойствам многие из них являются энергичными окислителями, так как их атомы обладают сильной склонностью к присоединению электронов.
Рассмотрим фрагмент периодической системы, составленный из элементов главных подгрупп:

Как видно из этой схемы, типичные неметаллы располагаются в правом верхнем углу системы, а металлы — в ее левом нижнем углу.
Валентность перехода, или относительность деления на металлы и неметаллы, выражается в наличии ряда простых веществ, являющихся как бы полуметаллами. При обычных условиях простые вещества, образованные этими элементами, имеют незначительную электропроводность . Поэтому их нельзя отнести ни к неметаллам, ни к металлам. Иногда их называют металлоидами (т. е. неполными металлам). Атомы этих элементов в простом веществе соединяются ковалентными связями. При этом нередко образуются прямые кристаллические структуры, подобные структуре алмаза, в которых каждый атом связан с несколькими другими.
Следовательно, одна из причин относительности деления простых веществ на металлы и неметаллы тесно связана со знанием атомов элементов.
Другая причина относительности такого деления заключается в состоянии внешних условий. Так, при обычных условиях металлы, как известно, характеризуются наличием свободных электронов. Металлическая связь осуществляется и в твёрдом и в жидком состоянии. Но если перевести в пар при определённых условиях (высокие температуры и низкие давления), то он теряет свое характерное свойство — электропроводность. У неметаллов в условии высокого давления наоборот возникает электронная проводимость, что является результатом глубоких изменений в структуре вещества.
Таким образом, структура вещества, тип химической связи, простого вещества могут изменяться под воздействием соответствующих внешних условий. Хорошо известным примером такого рода изменений являются различия физических свойств у различных аллотропных модификаций одного и того же элемента.
Аллотропия
Способность одного и того же элемента существовать в виде нескольких простых веществ называется аллотропией. В настоящее время известно около 400 простых веществ. Причина образования различных аллотропных видоизменений одного элемента кроется в возможности образования новых связей между атомами при изменении внешних условий. В результате образуются молекулы нового состава или новые кристаллические вещества, отличающиеся пространственным расположением атомов.
Так, например, существуют обыкновенный кислород и озон, отличающиеся друг от друга числом атомов в молекуле: кислород О2, и озон О3. Озон образуется при прохождении через воздух электрических разрядов.
Для серы известны два аллотропных видоизменения: ромбическая и призматическая сера. Выше температуры 95,6° С существует призматическая сера, ниже — ромбическая. Изменяется кристаллическая форма (ясно из названия) — изменяются и физические свойства.
Для олова переход одной модификации (серое олово) в другую (белое олово) совершается при температуре 18° С. Здесь также происходит изменение типа кристаллической решетки.
Наличие нескольких аллотропных видоизменений характерно для всех элементов четвертой группы. Рассмотрим, как влияет изменение структуры на физические свойства простых веществ элементов этой группы. Как известно, углерод и кремний принято относить к неметаллам, германий — к полупроводникам, олово и свинец — к металлам. Однако такое деление условно. В этом можно убедиться, рассмотрев, например, аллотропные видоизменения углерода.
В алмазе каждый атом углерода находится в центре правильной треугольной пирамиды (тетраэдр) и соединен ковалентными связями с четырьмя соседними атомами углерода (рис. 6). Таким образом, в таком кристаллическом веществе нет отдельных молекул (это понятие здесь теряет свой смысл). Связи между атомами углерода весьма прочны. Этим объясняется исключительно высокая твердость алмаза, высокая температура плавления и кипения.
В структуре графита плоские слои из атомов углерода расположены шестиугольниками. При этом расстояние между слоями больше расстояния между соседними атомами углерода, находящимися в одном слое (рис. 7). Для образования связей в шестиугольниках от каждого атома углерода требуется три электрона, четвертый же остается «свободным». Этим объясняется электропроводность графита. Поэтому графит используется для изготовления электродов.
Точно так же отличаются физическими свойствами кристаллические модификации олова: белое олово обладает электронной проводимостью, серое является полупроводником.
Выше мы отмечали, что переход одного аллотропного видоизменения в другое происходит при соответствующих условиях. Однако дело в том, что скорость указанного превращения, как правило, незначительна, различные простые вещества одного элемента могут сосуществовать.

рис. 6. Структура алмаза

Если различия между физическими свойствами аллотропных модификаций одного элемента нередко велико, то по химическим свойствам они чаще всего близки. Отличия касаются, главным образом, окислителей (озон — более активный окислитель), скорости реакции с участием простого вещества.
Понятие об окислительно-восстановительных процессах
При первоначальном знакомстве с химией рассматриваются четыре вида химических реакций: реакции соединения, разложения, замещения и двойного обмена.

Цифры над символами элементов означают окислительное число. Мы видим, что одни реакции (1, 3, 5, 6) идут с изменением окислительного числа элементов, другие (2, 4, 7) — без его изменения. На этой основе все химические реакции условно делят на два типа: реакции, идущие с изменением окислительного числа элементов — окислительно-восстановительные реакции — и реакции, течение которых не сопровождается изменением окислительного числа. Первые реакции играют огромную роль в жизни человека, в окружающем нас мире. Окислительно-восстановительные процессы имеют место при горении, дыхании, при получении серной кислоты из серы или сульфидов металлов, при выплавке металлов из руд, при коррозии металлов и сплавов, при работе химических источников электрической энергии.
Что же лежит в основе перечисленных выше процессов? Почему одни простые вещества легко вступают в реакцию друг с другом, тогда как другие нет.
В основе рассматриваемых процессов лежит такая перестройка электронной структуры атомов, составляющих соединение, которая ведет к изменению окислительного числа элементов. Таким образом, в этом случае, как правило, имеет место переход электронов от одних атомов, ионов, молекул к другим. Правда, иногда изменение окислительного числа сопровождается не передачей электронов от одного атома (иона) к другому, а смещением электронных пар:

(вертикальной линией условно обозначена середина межатомного расстояния в рассматриваемых молекулах).
В первом случае из двух простых веществ образуется ионное соединение, во втором — ковалентное полярное. Окислительное число элементов в простых веществах принимается равным нулю.
Окислительное число хлора и в поваренной соли, и в хлористом водороде равно -1, хотя указанные соединения различаются типом химической связи (что и представлено на схеме).
Окислителями называются вещества (атомы, ионы, молекулы), которые в ходе химической реакции присоединяют электроны или оттягивают их от других атомов. В только что рассмотренных примерах в качестве окислителя выступал хлор (С12). В результате реакции окислительное число хлора понизилось.
Восстановителями называются вещества (атомы, ионы, молекулы), вторые в ходе химической реакции отдают электроны для образования ионной или ковалентной связи. В тех же примерах в качестве восстановителей выступали соответственно натрий и водород. В результате реакции окислительное число восстановителей повысилось.
Принципиальная возможность электронной перестройки, наличие потенциального окислителя или восстановителя определяются строением атомов, строением вещества в целом.
Реализация этой возможности в общем случае находится в зависимости от многих факторов: наличия соответствующего партнера, концентрации окислителя и восстановителя, температуры, среды, в котоорой осуществляется реакция, и т. п.
Рассмотрим это на примере реакции взаимодействия двух простых веществ натрия и хлора:
2Na + С12 = 2NaCI
Как известно, для атомов натрия характерно «стремление» к отдаче электрона, для атомов хлора — к присоединению. Следовательно, в данном случае имеет место взаимодействие активного окислителя и активного восстановителя. Реакция осуществляется довольно легко: попаренная соль образуется с большим выделением тепла, в чём легко убедиться на практике. Процессы взаимодействия многих металлов с хлором идут самопроизвольно или при незначительном нагревании (для увеличения скорости реакции). Образовавшиеся при реакции ионы натрия (Na + ) и хлора (СI - ) обладают завершёнными электронными конфигурациями и поэтому, представляет себе возможность течения обратной реакции, мы понимаем, что Na + будет очень плохим окислителем, а СI - — плохим восстановителем. Для осуществления такой реакции потребуется значительная затрата энергии (высокие температуры). При обычных условиях натрий и хлор из поваренной соли получают электролизом расплава поваренной соли.
Ранее, рассматривая вопрос о положении водорода в периодической системы, мы указывали на сходство водорода как со щелочными металлами, так и с галогенами. Это сходство проявляется, в частности в том, что подобно щелочным металлам, водород может выступать в качестве восстановителя, но с другой стороны, подобно галогенам, способен быть и окислителем. Причина двух способов изменения электронной конфигурации нейтрального атома водорода заключается в особенности строения атомов I периода (первый энергетический уровень заполняется двумя электронами). Изменение
окислительного числа водорода можно представить следующим образом:
В первом случае водород выступает как восстановитель, во втором — как окислитель. Например:

Таким образом, мы прежде всего должны учитывать принципиальные возможности присоединять или отдавать электроны, т. е. возможности, прямо вытекающие из строения атомов и окислительного числа элемента в соединении. В нашем примере водород (Н2) может выступать и в роли окислителя и в роли восстановителя. Какая из этих двух возможностей будет реализована, зависит от партнера по реакции, от того, с каким веществом (окислителем или восстановителем) будет взаимодействовать водород.
Как же связать окислительные и восстановительные свойства простых веществ с положением элементов в периодической системе? Рассмотрим конкретные примеры. Например, окислительная способность в ряду галогенов убывает от хлора к йоду:
Восстановительную способность металлов отражает ряд активности (напряжения) металлов который составлен с учетом последовательности вытеснения металлов из растворов их солей.
По-иному будет выглядеть ряд, иллюстрирующий способность металлов образовывать соединения с кислородом или азотом, водородом или фтором и т. д.
В группах периодической системы восстановительные свойства простых веществ, как правило, усиливаются, а окислительные — падают. Однако это общее положение нуждается в уточнении, когда мы приступаем к изучению некоторых конкретных примеров. Число реакций, в которых данный элемент может выступать, скажем, в качестве восстановителя, достаточно велико, а процесс окисления— восстановления зависит от многих факторов, которые мы пока еще не рассматривали.
Металлы и неметаллы – в чем разница и как понять, когда металлические свойства усиливаются, а когда ослабевают

Металлы – это такие элементы, которые стараются отдавать свои электроны. Неметаллы – наоборот, стараются их принимать. Вам надо понять, почему это происходит, и что значат фразы типа «металлические свойства усиливаются, а неметаллические ослабевают». Сейчас я вам это объясню.
Почему металлические свойства слабеют «слева направо»
Итак. В атоме есть три частицы: протоны, нейтроны и электроны. У протонов заряд +1, у электронов -1. У нейтронов заряда нет.
Протоны и нейтроны находятся в ядре. Поэтому заряд ядра всегда плюсовой. А электроны крутятся вокруг ядра и притягиваются к нему, потому что у них заряд минусовой.
Электроны крутятся по электронным уровням – как планеты по орбитам вокруг Солнца.
Атомный номер показывает, сколько в атоме протонов. Как видите, это количество постоянно увеличивается.

Чем больше протонов, тем сильнее они «тянут» к себе электроны. Сравните:

Вывод – чем больше становится протонов, тем сильнее они удерживают электроны. Тем сложнее становится эти электроны отдавать. Поэтому слева направо, с увеличением порядкового номера (и, соответственно, числа протонов) металлические свойства слабеют, а неметаллические усиливаются.
На заметку – про радиус атома
Чем сильнее протоны притягивают электроны, тем ближе эти электроны становятся к протонам. Поэтому радиус атома уменьшается, атом как бы сжимается из-за увеличения заряда.
Почему неметаллические свойства слабеют «сверху вниз»
Идем дальше. Период в таблице показывает количество уровней (тех самых орбит), по которым летают электроны.
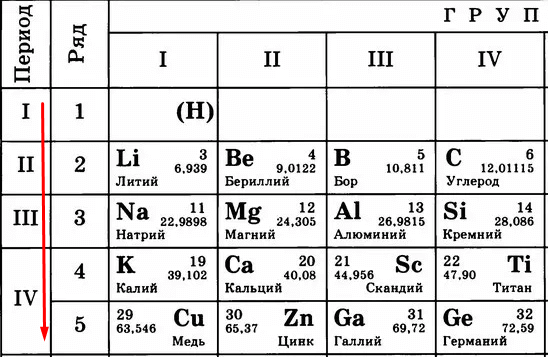
Чем больше период, тем больше этих орбит и тем дальше оказываются электроны от ядра. Сравните:
Кому сложнее удерживать электроны на последнем уровне? Меди, конечно, потому что эти электроны в два раза дальше от ядра, чем, например, у лития. Их проще становится отдать, чем пытаться удерживать.
Следовательно, «сверху вниз» количество уровней, по которым движутся электроны, растет, удерживать их становится сложнее, поэтому металлические свойства усиливаются, а неметаллические – слабеют.
Еще про радиус
Если смотреть на таблицу «сверху вниз» радиус ядра растет, потому что уровней становится больше.
Да, заряд атома тоже растет, но все-таки расстояние перевешивает. Чем больше уровней, тем труднее становится держать электроны, даже несмотря на то, что заряд увеличивается.
- Слева направо в таблице металлические свойства слабеют, неметаллические усиливаются из-за того, что ядро сильнее тянет к себе электроны.
- Сверху вниз металлические свойства усиливаются, неметаллические слабеют, потому что уровней становится больше, и удерживать электроны на последних уровнях становится труднее.
Из этих двух положений следует, что в правом углу таблицы Менделеева будут сосредоточены неметаллы, а в левом – металлы.
Я нашел вам вот такую картинку, на ней показаны все неметаллы. То, что выделено курсивом – это так называемые металлоиды – вроде и не совсем металлы, и в то же время не неметаллы. Нечто среднее.
Это основа основ. Надеюсь, я объяснил понятно и вы разобрались. Если нет – перечитайте еще раз, задайте вопросы мне в комментариях. Только когда разберетесь – читайте дальше.
Свойства металлов
Эти свойства проявляются в разной мере, но все-таки присущи всем металлам:
- Плавятся.
- Их можно ковать.
- Обладают металлическим блеском.
- Проводят электрический ток. Это происходит благодаря металлической связи, которая соединяет их атомы.
- Проводят тепло.
- Твердые – это касается всех, кроме ртути.
На сегодняшний день металлов известно 87.
Свойства неметаллов
У них почти все наоборот:
- Ковать нельзя, потому что они хрупкие.
- Не обладают металлическим блеском.
- Не проводят электрический ток (за редким исключением – кремний и графит могут быть проводниками).
- Очень плохо проводят тепло.
- Есть твердые, газообразные, жидкие.
Неметаллов на данный момент 22.
Это первая статья по химии на нашем сайте. Напишите, что не так, что нравится и не нравится. Я буду думать, как сделать материал лучше.
И еще – есть идея записывать видеоролики с объяснениями. Лично вам удобнее разбираться в чем-то, читая текст, или просматривая видео?
Читайте также:
