Реакция альдегидов с металлами находящимися в ряду активности до водорода
Обновлено: 04.10.2024
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы. Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием. В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами.
Все элементы IIA группы относятся к s-элементам, т.е. содержат все свои валентные электроны на s-подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns 2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме 0 – 2e — → Ме +2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO. Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл. Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C2 2- , фактически являющийся фрагментом молекулы ацетилена. Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла. С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода. Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO. В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
c кислотами-окислителями
− разбавленной азотной кислотой
С разбавленной азотной кислотой реагируют все металлы IIA группы. При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы происходит преимущественно до сероводорода:
с щелочами
Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении. При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
с оксидами
Щелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.
Химия. 10 класс
§ 30. Химические свойства, получение и применение альдегидов
Химические свойства альдегидов
Химические свойства альдегидов прежде всего обусловлены наличием в их молекулах альдегидной группы. По месту двойной связи альдегидной группы могут протекать реакции присоединения.
1. Гидрирование. Присоединение водорода
Молекула альдегида может присоединить по двойной связи молекулу водорода. Такая реакция сопровождаются разрывом π-связи в молекуле альдегида, так как она менее прочная, чем σ-связь:
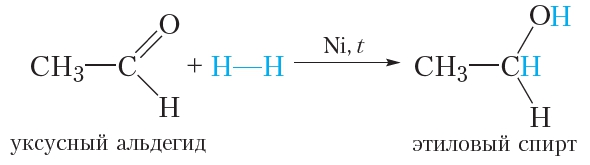
Условия протекания данной реакции схожи с реакцией гидрирования алкенов: смесь водорода с парами альдегида пропускают над нагретым никелевым катализатором.
Продуктом присоединения водорода к альдегиду является первичный спирт.
В результате присоединения водорода молекула альдегида восстанавливается, поэтому реакцию с водородом также называют реакцией восстановления альдегидов.
2. Окисление
Альдегидная группа легко окисляется. В качестве окислителей могут выступать ионы металлов, расположенных в ряду активности правее водорода — ионы серебра (Ag + ) и меди (Cu 2+ ).
Окисление альдегидов аммиачным раствором оксида серебра
Если к разбавленному раствору нитрата серебра приливать раствор аммиака, то выпадает белый осадок оксида серебра:
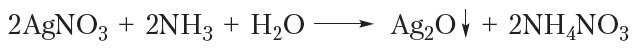
Этот осадок сразу же растворяется в избытке аммиака. Образующийся прозрачный раствор называется аммиачным раствором оксида серебра. Если к этому раствору прибавить раствор уксусного альдегида и смесь осторожно нагреть, то вскоре на стенках пробирки образуется блестящий зеркальный налёт серебра, благодаря чему эта реакция называется реакцией «серебряного зеркала».
В протекающей реакции уксусный альдегид окисляется до уксусной кислоты, а оксид серебра восстанавливается с образованием металлического серебра:
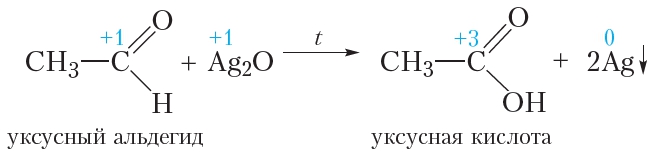
Реакция «серебряного зеркала» является качественной реакцией на альдегиды.
Окисление альдегидов гидроксидом меди(II)
В качестве окислителя альдегидов до соответствующих кислот может быть использован также гидроксид меди(II). Для проведения такой реакции в пробирку помещают раствор сульфата меди(II), затем прибавляют раствор щёлочи. При этом выпадает голубой осадок гидроксида меди(II):
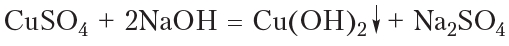
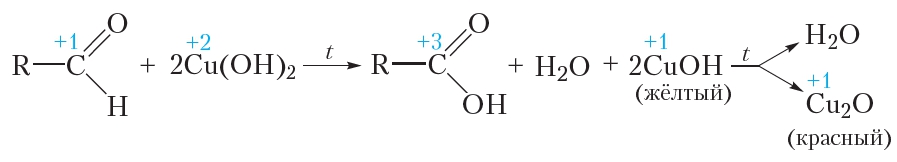
Затем в пробирку с осадком добавляют водный раствор альдегида и смесь нагревают. В процессе нагревания изначально голубой осадок становится жёлтым, а при дальнейшем нагревании — красным. Уравнение протекающей реакции:
Как видно из приведённого уравнения реакции, в результате восстановления гидроксида меди(II) образуется жёлтый осадок гидроксида меди(I), который при нагревании разлагается с образованием красного оксида меди(I).
Как и в случае реакции «серебряного зеркала», продуктом окисления альдегида является карбоновая кислота.
Реакция окисления альдегидов гидроксидом меди(II) так же, как и реакция «серебряного зеркала», является качественной реакцией на альдегиды.
Способность альдегидов окисляться до карбоновых кислот и восстанавливаться до спиртов особенно наглядно демонстрирует взаимосвязь между классами органических соединений, благодаря которой вещества одного класса могут быть получены из представителей других классов.
3.6. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров.
где R – углеводородный радикал, который может быть разной степени насыщенности, например, предельный или ароматический.
Группу –СНО называют альдегидной.
Кетоны – органические соединения, в молекулах которых содержится карбонильная группа, соединенная с двумя углеводородными радикалами. Общую формулу кетонов можно записать как:
где R и R’ – углеводородные радикалы, например, предельные (алкилы) или ароматические.
Гидрирование альдегидов и кетонов
Альдегиды и кетоны могут быть восстановлены водородом в присутствии катализаторов и нагревании до первичных и вторичных спиртов соответственно:
Окисление альдегидов
Альдегиды легко могут быть окислены даже такими мягкими окислителями, как гидроксид меди и аммиачный раствор оксида серебра.
При нагревании гидроксида меди с альдегидом происходит исчезновение изначального голубого окрашивания реакционной смеси, при этом образуется кирпично-красный осадок оксида одновалентной меди:
В реакции с аммиачным раствором оксида серебра вместо самой карбоновой кислоты образуется ее аммонийная соль, поскольку находящийся в растворе аммиак реагирует с кислотами:
Кетоны в реакцию с гидроксидом меди (II) и аммиачным раствором оксида серебра не вступают. По этой причине эти реакции являются качественными на альдегиды. Так реакция с аммиачным раствором оксида серебра при правильной методике ее проведения приводит к образованию на внутренней поверхности реакционного сосуда характерного серебряного зеркала.
Очевидно, что если мягкие окислители могут окислить альдегиды, то само собой это могут сделать и более сильные окислители, например, перманганат калия или дихромат калия. При использовании данных окислителей в присутствии кислот образуются карбоновые кислоты:
Химические свойства карбоновых кислот
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп.
Карбоксильная группа:
Как можно видеть, карбоксильная группа состоит из карбонильной группы –С(О)- , соединенной с гидроксильной группой –ОН.
В связи с тем, что к гидроксильной группе непосредственно прикреплена карбонильная, обладающая отрицательным индуктивным эффектом связь О-Н является более полярной, чем в спиртах и фенолах. По этой причине карбоновые кислоты обладают заметно более выраженными, чем спирты и фенолы, кислотными свойствами. В водных растворах они проявляют свойства слабых кислот, т.е. обратимо диссоциируют на катионы водорода (Н+) и анионы кислотных остатков:
Реакции образования солей
С образованием солей карбоновые кислоты реагируют с:
1) металлами до водорода в ряду активности:
3) основными и амфотерными оксидами:
4) основными и амфотерными гидроксидами металлов:
5) солями более слабых кислот – карбонатами и гидрокарбонатами, сульфидами и гидросульфидами, солями высших (с большим числом атомов углерода в молекуле) кислот:
Систематические и тривиальные названия некоторых кислот и их солей представлены в следующей таблице:
| Формула кислоты | Название кислоты тривиальное/систематическое | Название соли тривиальное/систематическое |
| HCOOH | муравьиная/ метановая | формиат/ метаноат |
| CH3COOH | уксусная/ этановая | ацетат/ этаноат |
| CH3 CH2COOH | пропионовая/ пропановая | пропионат/ пропаноат |
| CH3 CH2 CH2COOH | масляная/ бутановая | бутират/ бутаноат |
Следует помнить и обратное: сильные минеральные кислоты вытесняют карбоновые кислоты из их солей как более слабые:
Реакции с участием ОН группы
Карбоновые кислоты вступают в реакцию этерификации с одноатомными и многоатомными спиртами в присутствии сильных неорганических кислот, при этом образуются сложные эфиры:
Данного типа реакции относятся к обратимым, в связи с чем с целью смещения равновесия в сторону образования сложного эфира их следует осуществлять, отгоняя более летучий сложный эфир при нагревании.
Обратный реакции этерификации процесс называют гидролизом сложного эфира:
Необратимо данная реакция протекает в присутствии щелочей, поскольку образующаяся кислота реагирует с гидроксидом металла с образованием соли:
Реакции замещения атомов водорода в углеводородном заместителе
При проведении реакций карбоновых с хлором или бромом в присутствии красного фосфора при нагревании происходит замещение атомов водорода при α-атоме углерода на атомы галогена:
В случае большей пропорции галоген/кислота может произойти и более глубокое хлорирование:
Реакции разрушения карбоксильной группы (декарбоксилирование)
Особые химические свойства муравьиной кислоты
Молекула муравьиной кислоты, несмотря на свои малые размеры, содержит сразу две функциональные группы:
В связи с этим она проявляет не только свойства кислот, но также и свойства альдегидов:
При действии концентрированной серной кислоты муравьиная кислота разлагается на воду и угарный газ:
Получение альдегидов
1. Неполное окисление спиртов
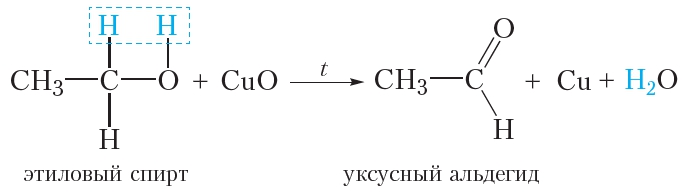
Как вы уже знаете, альдегиды могут быть получены при неполном окислении первичных спиртов оксидом меди(II) (§ 24). Так, при окислении этилового спирта образуется уксусный альдегид:
Для проведения реакции медную проволоку прокаливают в пламени спиртовки, в результате поверхность проволоки покрывается чёрным оксидом меди(II). Затем проволоку погружают в этиловый спирт, при этом оксид меди(II) окисляет спирт до уксусного альдегида и образуется медь, поэтому проволока снова становится блестящей (видео 24.1).
2. Гидратация ацетилена
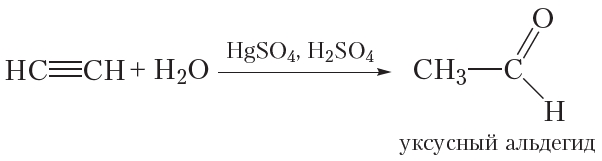
Уксусный альдегид можно получить по реакции присоединения воды к ацетилену в присутствии солей ртути и серной кислоты:Эта реакция носит имя русского химика Михаила Григорьевича Кучерова.
Рассмотрим подробнее, как протекает данная реакция. Сначала молекула воды присоединяется по одной π-связи молекулы ацетилена. При этом образуется неустойчивый виниловый спирт:
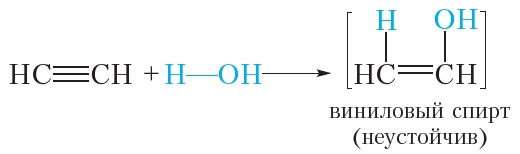
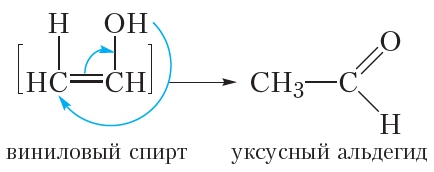
Напомним, что радикал CH2 CH имеет тривиальное называние винил. Спирты, у которых гидроксильная группа находится при двойной связи C C , неустойчивы, поэтому виниловый спирт сразу же превращается в уксусный альдегид:

С промышленным методом получения уксусного альдегида вы можете познакомиться, перейдя по ссылке в QR-коде.
Применение
Наибольшее применение имеют муравьиный и уксусный альдегиды.
Некоторые области использования муравьиного альдегида основаны на его свойстве свёртывать белки. Он используется в медицине в качестве консерванта биологических тканей. Формальдегид широко применяется в кожевенном производстве, так как, оказывая влияние на белки кожи, он делает последнюю более твёрдой и устойчивой к гниению.
В результате взаимодействия формальдегида с аммиаком получают лекарственное средство — уротропин.
Кроме того формальдегид используется в производстве фенолформальдегидных пластмасс. Основу таких пластмасс составляет высокомолекулярное соединение — фенолформальдегидная смола. Она образуется при нагревании фенола с формальдегидом в присутствии катализатора. Механизм образования фенолформальдегидной смолы достаточно сложен и представлен схематически:
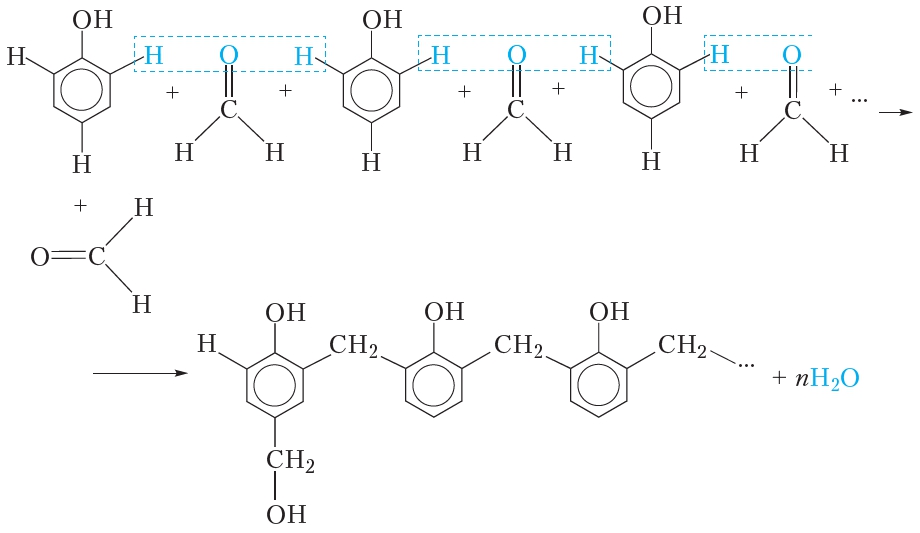
Как видно из приведённой схемы, в результате реакции образуется линейный полимер, в котором молекулы фенола соединены группами —CH2— через положения 2 и 6 бензольного кольца. Кроме этого, некоторые остатки фенола содержат в положении 4 бензольного кольца группы —CH2OH .
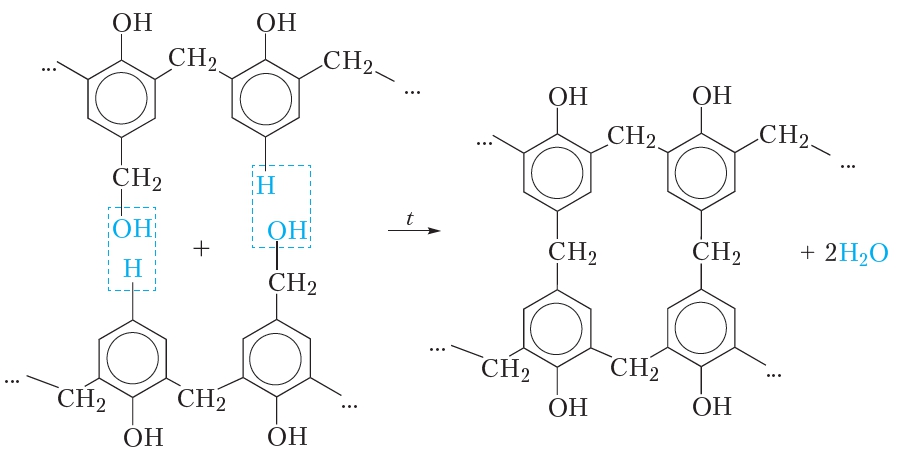
За счёт групп —CH2OH при нагревании до 130—150 °С такой полимер «сшивается», образуя очень твёрдую и прочную фенолформальдегидную смолу с «сетчатой» структурой:
Материалы на основе фенолформальдегидных смол обычно изготавливают, смешивая расплавленный полимер линейного строения с наполнителем (древесная мука, стружки, асбест и др.). Далее полученный материал прессуют при нагревании. При этом расплавленный полимер хорошо заполняет форму, а затем затвердевает, образуя «сетчатую» структуру. В результате получается монолитное твёрдое изделие. Некоторые материалы, в которых фенолформальдегидная смола выступает в качестве связующего, вам хорошо знакомы. Например, некоторые виды ДСП (древесностружечная плита) представляют собой смесь древесных стружек, скреплённых между собой фенолформальдегидным полимером.
В процессе образования фенолформальдегидной смолы из низкомолекулярных веществ — фенола и формальдегида — в результате отщепления воды образуется высокомолекулярное вещество. Такой процесс называется поликонденсацией. Следует различать процессы поликонденсации и полимеризации. В процессе поликонденсации наряду с высокомолекулярным соединением образуется побочный низкомолекулярный продукт. В рассмотренной реакции поликонденсации фенола с формальдегидом этим продуктом является вода.
В процессе полимеризации высокомолекулярное вещество (полимер) образуется в результате многократно повторяющейся реакции присоединения. Поэтому, в отличие от поликонденсации, процесс полимеризации не сопровождается образованием побочных низкомолекулярных продуктов.
Уксусный альдегид в больших количествах используется для производства уксусной кислоты, а также других органических веществ.
Альдегиды вступают в реакции присоединения по месту двойной связи C O . В результате присоединения водорода альдегиды восстанавливаются, образуя первичные спирты.
Альдегиды окисляются гидроксидом меди(II) и аммиачным раствором оксида серебра до карбоновых кислот. Эти реакции являются качественными реакциями на альдегидную группу.
Альдегиды могут быть получены окислением первичных спиртов оксидом меди(II).
Уксусный альдегид можно получить присоединением воды к ацетилену в присутствии солей ртути и серной кислоты.
Альдегиды используются для получения пластмасс, лекарственных препаратов, для синтеза органических веществ, а также в парфюмерии.
*Получение уксусного альдегида
В настоящее время уксусный альдегид получают в результате так называемого Вакер-процесса. Для этого газообразную смесь этилена с кислородом пропускают через водный раствор, содержащий хлориды палладия(II) и меди(II). Происходящие процессы можно выразить суммарным уравнением:
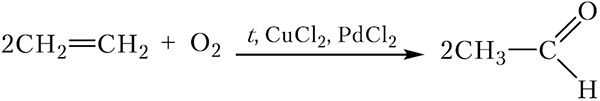
Вопросы и задания
1. Какие спирты образуются в результате восстановления водородом этаналя и 2-метилпропаналя? Напишите уравнения реакций, назовите образующиеся продукты.
2. Напишите уравнение реакции пропаналя с гидроксидом меди(II) при нагревании. Опишите наблюдаемые явления.
3. В результате нагревания водного раствора вещества А с аммиачным раствором оксида серебра образуется кислота Б, а стенки пробирки покрываются серебряным налётом.
При пропускании смеси вещества А с водородом над нагретым никелевым катализатором образуется спирт В. При нагревании спирта В с концентрированной серной кислотой получается углеводород Г, немного легче воздуха. Установите формулы веществ А—Г и приведите уравнения реакций, описанных в задании.
4. В результате окисления 2,15 г гомолога уксусного альдегида аммиачным раствором Ag2O было получено 5,4 г серебра. Установите молекулярную формулу альдегида.
5. Одним из современных промышленных методов получения уксусного альдегида является окисление этилена хлоридом палладия в присутствии хлорида меди(II) и кислорода воздуха (Вакер-процесс):

Для синтеза этаналя в промышленных условиях смесь этилена и кислорода пропускают через реактор, содержащий раствор хлоридов палладия и меди(II) при температуре 130 о С и давлении 400 кПа. Известно, что степень превращения веществ в реакторе в указанных условиях составляет 25 %. Укажите массу этаналя, образующегося из этилена объёмом (н. у.) 10 м 3 и достаточного количества кислорода.
6*. При действии воды на твёрдое вещество А образуется газ (н. у.) Б, легче воздуха. При пропускании Б через горячий водный раствор содержащий серную кислоту и сульфат ртути(II) образуется органическое вещество В. Вещество В можно также получить двухстадийным синтезом. Сначала вещество Б гидрируют на специальных катализаторах. При этом образуется газ (н. у.) Г, легче воздуха. Затем смесь газа Г и кислорода поглощают водным раствором, содержащим смесь CuCl2 и PdCl2. При этом образуется вещество В.
а) Приведите структурные формулы веществ А, Б, В и Г.
б) Напишите уравнения всех описанных в задаче реакций.
в) При гидрировании вещества В образуется вещество Д, имеющее только один изомер (вещество Е). Приведите формулы и названия веществ Д и Е, а также уравнение реакции гидрирования вещества В.
г) Температура кипения какого вещества (Д или Е) выше и почему?
7*. Напишите схемы реакций, с помощью которых можно получить в две стадии бромэтан, исходя из уксусного альдегида.
Реакция альдегидов с металлами находящимися в ряду активности до водорода
Альдегиды и кетоны относятся к карбонильным органическим соединениям.
Карбонильные соединения (оксосоединения) — органические вещества, в молекулах которых имеется карбонильная группа (карбонил)
Общая формула карбонильных соединений:
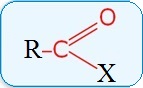
В зависимости от типа заместителя Х эти соединения подразделяют на:
- альдегиды (Х=Н);
- кетоны (Х=R, R');
- карбоновые кислоты (Х=ОН) и их производные (Х=OR, NH2, NHR, Hal и т.д.)
Общая формула предельных альдегидов и кетонов СnH2nO .
В молекулах альдегидов карбонильная группа связана с атомов водорода:
Эта группа является функциональной группой этого класса соединений и называется альдегидной группой, сокращенно она записывается – СНО.
— это органические соединения, молекулы которых содержат альдегидную группу, связанную с углеводородным радикалом.
Общая формула: R–CН=O или
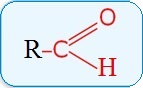
R = H, алкил, арил
Первый член ряда альдегидов – формальдегид, в его молекуле карбонильная группа связана только с атомами водорода — H2C=O.

Кетоны — органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами.
Общие формулы: R2C=O, R–CO–R' или

R, R' = алкил, арил
Функциональную карбонильную группу кетонов называют кетогруппой.
Простейший представитель кетонов – ацетон CH3—C (O)—CH3.
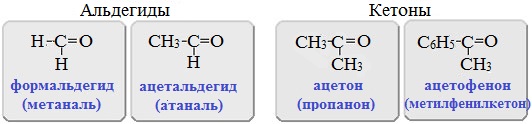
Альдегиды – органические вещества, в молекулах которых карбонильная группа находится на конце углеродной цепи.
Кетоны – органические вещества, в молекулах которых карбонильная группа находится внутри углеродной цепи.
Если в молекулах альдегидов или кетонов содержатся две карбонильные группы, то такие соединения являются диальдегидами или дикетонами соответственно.

Например, диальдегидом является глиоксаль, а дикетоном – диацетил.
Читайте также:
