Реакция растворения газов в металле
Обновлено: 04.10.2024
При выборе технологических параметров термической обработки цветных металлов и сплавов следует учитывать их возможное взаимодействие с газами при нагреве, выдержке и охлаждении. Состав газовой среды, окружающей металл, определяется прежде всего способами нагрева и применяемым для нагрева оборудованием: электрические печи, печи с газопламенным нагревом, мазутные, индукционные печи и т. п. Состав газовой среды печен, в которых нагрев осуществляется нагревателями различного типа, а не пламенем, определяется составом окружающей нас атмосферы. В состав воздуха входит, % (по массе): 75,60 азота; 23,10 кислорода; 1,286 аргона; 0,030 углекислого газа; 0,002 гелия, неона, криптона, ксенона, радона и водорода; 0,2—4 водяного пара. В средних широтах содержание водяного пара колеблется в пределах 0,2-2,5% (по массе), а у морского побережья в жаркую погоду достигает 4%. В воздухе индустриальных районов и крупных городов, кроме того, содержатся значительные количества SO2, SO3, HCl, NH3, NO2 и др.
Состав атмосферы пламенных печей определяется прежде всего равновесием реакций водяного пара:



Из константы реакции водяного пара следует, что с повышением температуры в составе атмосферы печи уменьшается содержание углекислого газа и возрастает содержание паров воды.
Из приведенных выше данных следует, что при термической обработке цветных металлов можно ожидать их взаимодействия с кислородом, азотом, парами воды, двуокисью и окисью углерода. В общем случае взаимодействие металлов с газами включает физическую адсорбцию, активированную или химическую адсорбцию, диффузию, растворение в химическое взаимодействие металла с газом с образованием химических соединении.
Адсорбционные процессы не приводят к какому-либо заметному газонасыщению конструкционных металлов, и эти процессы обычно не рассматривают при оценке возможного газонасыщения. Молекулы газа не могуч диффундировать в твердых телах. Лишь после диссоциации молекулы на атомы на поверхности твердого тела атомы, составляющие молекулу, проникают в металл В связи с этим состояние поверхности существен но влияет на скорость диффузии. При наличии окисных и иного рода пленок процесс диффузии сильно замедляется, причем в этих условиях скорость диффузии часто не зависит от давления газа и определяется порами и трещинами в пленке.
Для оценки распределения кислорода, азота и углерода при диффузии из газовой среды в достаточно массивные полуфабрикаты и детали, как правило, можно ограничиться решением второго уравнения Фика для простейшего случая диффузии в полубесконечное тело.
В отличие от кислорода, азота и углерода водород обладает очень высокой диффузионной подвижностью в металлах (рис. 10). Поэтому при оценке насыщения металлов водородом при термической обработке нельзя считать рсалг,пыс детали и полуфабрикаты полубесконечным телом. При теоретической оценке возможного проникновения водорода в металл при достаточно высоких температурах, свойственных термической обработке, необходимо обращаться к решениям более сложных диффузионных задач, приведенных в специальной литературе по диффузии.

Проникновение газа в металл и распределение составляющих его молекул и атомов в объеме металла называют абсорбцией или окклюзией. Проникающие в металлы атомы молекул, составляющих газовую атмосферу печи, могут образовывать с ними твердые растворы и химические соединения, а также накапливаться в несплошностях внутри металла.
В зависимости от знака теплового эффекта различают эндотермическую и экзотермическую абсорбцию. Эндотермическая абсорбция протекает с поглощением тепла, и поэтому количество абсорбированного газа при заданном внешнем его давлении возрастает с повышением температуры. Экзотермическая абсорбция протекает с выделением тепла, и поэтому содержание газа в металле при данном давлении с повышением температуры уменьшается.
При образовании растворов равновесная концентрация растворенного двухатомного газа в металле С при заданном равновесном его давлении р в газовой среде связана с температурой уравнением Борелиуса:

где Q — теплота растворения 1 моля газа, ψ — константа (энтропийный фактор); R — газовая постоянная, T — абсолютная температура.
Коэффициент «два» в знаменателе показателя степени (2RT) связан с тем, что растворению этих газов в металле предшествует диссоциация молеrул на два атома (например, H2-2H). В координатах lgC-1/T при заданном давлении уравнение (14) графически выражается прямой линией, по наклону которой можно легко найти теплоту растворения Q. При постоянно, температуре зависимость растворимости двухатомных газов С от давления газа p описывается уравнением

где К — константа для данной температуры. Этот закон, получивший название закона Сивертса, является следствием диссоциации молекул газа на атомы при растворении.
При переходе металлов из твердого состояния в жидкое резко изменяется растворимость газа. Аналогичное, но меньшее по величине скачкообразное изменение растворимости наблюдается также при аллотропических превращениях.
Уравнения Борелиуса и Сивертса широко используются при описании равновесия в системах металл — водород. Условия равновесия металл — газ обычно представляют в виде системы изотерм, изобар или изоконцентрат. Для примера на рис. 11 приведены изобары равновесного давления водорода для системы алюминий водород. Аналогичные изобары равновесного давления водорода построены для всех имеющих важное практическое значение металлов, а также для ряда систем металл — азот и металл — кислород.

Условия образования соединений зависят от упругости их диссоциации Когда давление кислорода достигнет упругости диссоциации рО2, окисла, начинается реакция (реакцию обычно записывают так, чтобы в ней участвовал один моль газа):


Упругость диссоциации нерастворимых в металле соединений постоянного стехиометрического состава можно рассчитать по уравнению

где ΔG°Т — изменение стандартной свободной энергии системы при образовании соединения Изменение свободной энергии ΔG°Т равно:


где А и В — константы, значения которых для большинства практически важных реакций определены экспериментально и приведены в справочной литературе. На рис. 12 показаны для примера температурные зависимости упругости диссоциации соединений для рядя практически важных реакции. По этим зависимостям можно легко оценить, в каком направлении будет смешаться равновесие в системе металл газ — соединение в тех или иных условиях. Если при рассматриваемой температуре парциальное давление газа в газовой средe бoльше упругости диссоциации данного соединения, то будет проходить реакция его образования, в противном случае соединение диссоцирует.

Характер взаимодействия металла с газом, как и металлические системы, описывают с помощью диаграмм состояния, которые, однако, имеют ряд специфических особенностей. Эти особенности обусловлены необходимостью учета давления газа в системе металл газ, в то время как для большинства металлических систем давлением паров можно пренебречь. В соответствии с этим правило фаз для систем металл — газ следует применять в виде: c=k-ф+2,
где с — число степеней свободы системы; k — число компонентов системы; ф — число находящихся в равновесии фаз.
На рис. 13 приведена схематичная диаграмма состояния системы металл—водород для случая, когда водород стабилизирует высокотемпературную модификацию металла β, который экзотермически абсорбирует водород и образует с ним гидриды (γ). На диаграмму нанесены также изобары. Для металлов, экзотермически абсорбирующих водород, с увеличением его содержания понижается температура, при которой устанавливается заданное равновесное давление р. При достаточной концентрации водорода однофазная область сменяется двухфазной. С дальнейшим введением водорода количество второй фазы постепенно растет, но равновесное давление газа остается постоянным. Наконец, двухфазная область сменяется однофазной; в этой области концентраций температура, соответствующая заданному равновесному давлению водорода, понижается с увеличением его содержания в металле.
Из приведенной схемы очевидно, что линии диаграммы не являются изобарами системы: они представляют геометрическое место точек изломов на изобарах системы. Так, в частности, линия аа0 не является линией изобарической растворимости водорода в a-фазе; это линия растворимости в α-фазе гидридов. Растворимость гидридов в a-фазе увеличивается с повышением температуры, в то время как изобарическая растворимость уменьшается.
Равновесие в системах металл—окисел описывают фазовыми диаграммами в координатах температура T (или 1/Т) — окислительный потенциал (IgpO2, или lgp0). На рис. 14 приведены для примера подобные диаграммы для окислов титана и ниобия. Для сравнения приведены условия равновесия реакции FeO⇔Fe+1/2O2. Эти диаграммы позволяют оценить, при каких температурах и парциальных давлениях кислорода могут стабильно существовать те или иные окислы данного металла.

Кислород отличается большой активностью по отношению ко многим металлам. Некоторые металлы, в том числе медь, титан, цирконий, ванадий, ниобий, тантал и ряд других, растворяют свои окислы. Другие, такие как магний, молибден, вольфрам, дают окислы, практически нерастворимые в металле. По возрастанию термодинамической устойчивости, т. е. по уменьшению упругости диссоциации, окислы при температурах, близких к комнатной, располагаются в ряд (см. рис. 12): Cu2O, MoO3, FeO, WO3, SnO2, ZnO, Cr2O3, MnO, SiO2, Ta2O6, Nb2O5, TiO2, ZrO2, Al2O3, MgO, CaO, BeO. При всех температурах наименее устойчивы окислы меди, никеля, молибдена; наиболее устойчивы окислы алюминия, магния, кальция, бериллия.
Все практически важные металлы взаимодействуют с азотом менее активно, чем с кислородом. Небольшой термодинамической устойчивостью обладают нитриды железа, молибдена, марганца, а наиболее устойчивы нитриды циркония и титана Такие металлы, как железо, молибден, хром, цирконий, титан, растворяют свои нитриды, а алюминий и магний нет.
Все металлы в той или иной степени взаимодействуют с водородом. Металлы, адсорбирующие водород по эндотермической реакции (Al, Mg, Cu, Fe и др.), не образуют с водородом гидридов при непосредственном взаимодействии металла с водородом, хотя искусственно, косвенным путем, гидриды могут быть получены. Металлы абсорбирующие водород по экзотермической реакции (Ti, Zr, V, Nb, Ta и др.), образуют с водородом гидриды при сравнительно небольшом внешнем давлении водорода, которое значительно меньше атмосферного
Хотя растворимость водорода в металле не является константой для данной температуры в литературе часто условно сопоставляют металлы по способности абсорбировать водород на основе оценки содержания водорода в металле при давлении водорода, равном 0,1 МПа (при заданной температуре) Эту растворимость мы будем в дальнейшем называть нормальной Содержание водорода в эндотермических окклюдерах обычно оценивают в кубических сантиметрах водорода при нормальных условиях (температура 20 С, давление 0,10 МПа) приходящихся на 100 г металла. Так в частности нормальная растворимость в твердом состоянии вблизи точки плавления металла составляет см3/100 г для алюминия 0,044; магния 31; меди 2,0; железа 14,3.
Общее содержание водорода в этих металлах превышает растворимость, так как он может находиться в растворе в пересыщенном состоянии заполнять несплошности разного вида, сегрегировать на различных включениях, в частности на поверхности окислов.
С парами воды металлы взаимодействуют по реакции

При этой реакции на поверхности металла образуются окислы, которые могут частично растворяться в металле, и водород, который распределяется между газовой фазой и раствором в металле в соответствии с законом Сивертса. Таким образом, в результате взаимодействия металлов с парами воды металлы наводороживаются, и этот эффект —наиболее неприятное последствие рассматриваемой реакции
В атмосфере содержится всего 0,01% (объемн.) H2. Содержание молекулярного водорода в окружающей металл газовой среде при термической обработке также столь невелико, что наводороживания не происходит (если атмосфера печи не является водородной). Основным источником наводороживания является влага — атмосферная и образующаяся в результате сгорания топлива при нагреве металла открытым пламенем. Содержание паров воды в атмосфере печи на много порядков больше, чем водорода, и может колебаться в довольно широких пределах. Парциальное давление паров воды при плавке в электрической лабораторной печи составляет 1700—2000 Па, а в газовой печи 8000—16000 Па. Концентрация растворенного водорода, образующегося при взаимодействии металла с парами воды, прямо пропорциональна концентрации атомарного водорода в газовой фазе, точнее, в газовом слое вблизи поверхности металла и связана с парциальным давлением паров воды в атмосфере рН2О зависимостью типа уравнения Сивертса:

где К - константа, отличная от аналогичного параметра для систем металл-водород.
Согласно термодинамическим расчетам большинства систем металла - пары воды следам паров воды соответствуют огромные давления водорода, так как изменение свободной энергии системы при реакции (21) весьма велико по абсолютной величине и отрицательно по знаку. Поэтому почти весь водород, образующийся ПО этой реакции, должен поступать в металл. Лишь, образующаяся на поверхности металла при этом окисная пленка препятствует насыщению металла водородом до чрезвычайно больших концентрации.
При термической обработке металл может также взаимодействовать с двуокисью и окисью углерода по реакциям:

Направление этих реакций зависит от соотношения упругости диссоциации окислов металла, с одной стороны, и окислов углерода, с другой стороны. Реакция будет идти в направлении образования окислов металла лишь в том случае, если их упругость диссоциации меньше упругости диссоциации окислов углерода. В каждом конкретном случае для оценки направления течения реакций (23) и (24) необходимо проводить термодинамический анализ.
При определенном, зависящем от температуры соотношении парциальных давлений газов в правой и левой части уравнений (23) и (24) устанавливается равновесие этих реакций. Для этих реакции константы равновесия выражаются следующими соотношениями


где А и В — коэффициенты, зависящие от типа реакции и металла, вступающего в реакцию с окисью или двуокисью углерода. Значения этих коэффициентов для реакций (23) и (24) приведены в справочной литературе.
Реакция растворения газов в металле
Существует мнение, что растворимость газов в металлах подчиняется каким-то своим законам в противоположность растворимости их в водных растворах и других жидкостях. Наиболее существенные разногласия имеют место по вопросам зависимости растворимости газов от температуры.
Растворимость газов в большинстве расплавленных металлов с повышением температуры, начиная от температуры плавления, возрастает, тогда как при нагревании раствора газа в воде, наоборот, происходит выделение его в виде пузырьков, что указывает на уменьшение растворимости газа с повышением температуры. Это кажущееся несоответствие исчезает, если рассмотреть зависимость растворимости от температуры во всем интервале — от твердого состояния до температуры кипения. Наряду с металлами, растворимость газов в которых возрастает с повышением температуры, обнаруживаются и такие, которые с повышением температуры растворяют меньшие количества газа. К таким металлам принадлежит цинк, растворимость водорода в котором уменьшается с повышением температуры уже от самой температуры плавления. С другой стороны, все металлы, даже и те, у которых растворимость газов при сравнительно низких температурах увеличивается с температурой, меняют знак растворимости при более высоких температурах, когда уже значительно возрастает упругость пара.

Таким образом, типичная кривая растворимости газов в жидкостях, в том числе и в металлах, будет иметь вид, представленный на рис. 43, а. Пока металл находится в твердом состоянии, растворимость газа в нем не высока. С повышением температуры она медленно возрастает, резко увеличиваясь при достижении температуры плавления металла. При одной и той же температуре (температура плавления) жидкий металл растворяет значительно большее количество газа, чем твердый. По мере повышения температуры уже расплавленного металла растворимость продолжает возрастать, причем темп нарастания растворимости при увеличении температуры на одно и то же число градусов значительно больше, чем для твердого металла. При еще большем повышении температуры наклон кривой начинает уменьшаться. Кривая растворимости переходит через максимум, и при дальнейшем повышении температуры растворимость газа в металле начинает падать. Когда температура металла достигает температуры кипения металла, растворимость становится близкой к нулю.
Кривая, приведенная в общем виде на рис. 43, а, справедлива для растворимости газов как в расплавленных металлах, так и в водных растворах. Вещества, обладающие малой упругостью пара, по растворимости газов в полной мере соответствуют общему виду закономерности рис. 43, а. Для веществ, имеющих значительную упругость пара уже при сравнительно низких температурах, температура плавления на типичной кривой растворимости должна расположиться в правой части диаграммы от максимума (рис. 43, б).

Если на одной диаграмме (рис. 44, а) изобразить и кривую растворимости без учета влияния упругости пара (представлено на рис. 44, а штрих-пунктиром) и величину уменьшения растворимости под влиянием испарения (штриховая линия на рис. 44, а), которое можно принять пропорциональным величине упругости пара, то результирующая кривая (сплошная линия на рис. 44, а) и окажется не чем иным, как типовой кривой растворимости газа в металле (рис. 43, а).
В зависимости от относительного положения кривой собственно растворимости и кривой упругости пара результирующая растворимость может оказаться снижающейся по мере повышения температуры и для твердого металла и для расплавленного (рис. 44,6).
Известные в литературе математические формулы зависимости растворимости от температуры не учитывают упру ости пара металла, поэтому они не оправдываются во всем интервале, растворимости:

где C и K — постоянные;
Q — теплота растворения или теплота образования химического соединения;
T — температура в °К.
Математических выражений, которые могли быть распространены и на растворимость газов в различных металлах к соответствовали бы всему интервалу температур от низких до температуры кипения, не предложено, поэтому приходится пользоваться данными, полученными опытным путем.
Результаты исследований, проведенных с достаточной тщательностью, показывают, что растворимость газов начинает уменьшаться при достижении температур, при которых упругость пара становится значительной.
Цинк обладает высокой упругостью пара, поэтому растворимость газов в нем с повышением температуры уменьшается, так как при этом упругость пара цинка быстро увеличивается.
Процесс растворения простых двухатомных газов в металле можно представить себе следующим образом.
Молекулы газа при каждой определенной температуре и давлении имеют определенную степень (или упругость) диссоциации на атомы, аналогично тому, что имеет место в случае химических соединений. Если атомы газа из системы куда-либо отбираются, то новые молекулы диссоциируют и поддерживают определенную концентрацию атомов.
Как установлено опытами по изучению влияния давления на растворимость газов в металлах, один из наиболее легко растворяющихся в металлах газ — водород растворяется в целом ряде металлов в атомном состоянии.
Атомы газа, получившиеся в результате диссоциации молекул, растворяются в металле вначале в его поверхностных слоях, затем диффундируют вглубь металла, а в поверхностные слои переходят из атмосферы новые атомы газа. Вначале концентрация газа, растворенного в металле, довольно быстро увеличивается, а затем по мере приближения к насыщению, растет все медленнее и медленнее. При достаточном времени воздействия газа на металл кривая растворения газа ассимптотически приближается к некоторому пределу (рис. 43, г), который и может быть принят за растворимость газа в металле при взятых условиях; температуры, давления и концентрации газа у поверхности металла.
Иногда считают, что существенной стадией растворения является адсорбция газа металлом. Вряд ли это мнение справедливо, так как в большинстве случаев с повышением температуры адсорбционная способность понижается, а растворимость, так же как и скорость растворения, повышается. Отсюда можно сделать, пожалуй, обратное заключение, что адсорбция скорее препятствует растворению, а не способствует.
Как показали работы А.Н. Морозова, не всегда растворимость газа в металле пропорциональна корню квадратному из давления, хотя во многих случаях это и оправдывается. Как бы то ни было, а с возрастанием давления газа увеличивается и растворимость его в металле.
Вопрос о растворении сложных газов в настоящее время не может считаться достаточно выясненным. Наиболее вероятным представляется предположение, что сложные газы растворяются в металле в виде молекул, HO эти молекулы не представляют механические включения газа в металл, а они находятся в растворе, т. е. между этими молекулами и металлом действуют силы, аналогично тому, как это имеет место при растворении атомов в металле.
Растворенные молекулы, разумеется, в некоторой степени диссоциируют, поэтому, наряду с молекулярным растворением, всегда имеется и атомное. Такой же механизм растворения может иметь место и в случае простых газов, причем соотношение между атомным и молекулярным растворением может меняться в широких пределах. В тех случаях, когда растворимость соответствует закону квадратного корня из давления, превалирует атомное растворение. Если же такого соответствия нет, то преобладает растворение молекулярное.
Если условия, в которых находится металл, насыщенный газом, меняются, то будет меняться и растворимость. Если, например, металл, насыщенный при определенном давлении и температуре, охлаждать, то растворимость будет меняться в соответствии с диаграммой (рис. 43, а), а именно, понижаться, если состояние соответствовало левой части теоретической кривой растворимости, и наоборот.
Выделение газа из раствора при понижении температуры не происходит мгновенно. Некоторое время может существовать пересыщенный раствор. В этом случае кривая насыщения (вернее, пересыщения) металла газом в зависимости от температуры будет соответствовать пунктирной кривой на рис. 43, в. Это будет справедливо для растворимости и в жидком состоянии и в твердом.
При уменьшении парциального давления или уменьшении концентрации растворимого в металле газа в газовой смеси количество растворенного в металле газа падает. При этом время насыщения металла газом возрастает.
Газ, остающийся в твердом растворе в большинстве цветных металлов, в процессе отливки слитков большого влияния на качества металла не оказывает.
Газ, растворяющийся в расплавленном металле и выделяющийся при охлаждении и кристаллизации, часто обусловливает пузыристость слитков и поэтому обращает на себя значительно большее внимание, чем газ, находящийся в твердом растворе.
Методы изучения растворимости газов в металлах могут быть разделены на следующие группы:
А. Методы изучения действительной растворимости газов в металлах прямым определением. Осуществляются они с помощью системы малого объема с применением высокого вакуума и нагрева металла в высокочастотной печи. Этот способ в применении к трудно летучим металлам дает наиболее надежные результаты при тщательном выполнении эксперимента.
Б. Косвенные методы суждения о растворимости газов. преимущественно в расплавленных металлах, путем определения пористости слитков, длительности периода образования брызг при кристаллизации слитка, веса выброшенного в виде брызг металла и т. д. Эти методы не дают возможности судить количественно о растворимости газов в металлах, но позволяют получать приближенные результаты, которые могут быть использованы в практических целях для выбора режима плавки и получения беспузыристого слитка.
В. Исследование газа, собранного при его выделении из охлаждающегося или кристаллизующегося металла. Этот способ не дает возможности получить достаточно точный результат, выполнение его затруднительно. Неточность обусловлена возможностью попадания вместе с газом, растворенным в металле, также и газа, механически запутанного во время литья.
Г. Вырубание или высверливание металла над пузырем в слитках или болванках, собирание газа из них над водой или ртутью и его анализ. Этот метод также не дает возможности отделить газ, растворенный в металле и выделившийся при кристаллизации, от газа, механически запутанного при литье.
Д. Переплавка образцов, насыщенных газом, в вакууме и последующий анализ газов, извлеченных таким образом из металла. Этот способ дает возможность определять совместное содержание газа, выделившегося из раствора, и газа, адсорбированного на неметаллических включениях и по наружным и внутренним поверхностям кристаллов. Кроме того, если в образце имелись включения механически запутанного газа, то и этот газ добавится и будет проанализирован в общей сумме.
Е. Разрушение образцов путем электронной бомбардировки и собирание газа в вакууме. Этот способ дает, так же как и предыдущий, суммарное содержание газа. Кроме того, количество газа, определяемое таким путем, в десятки раз больше, чем то, которое получается любым другим методом. Этим методом обнаруживается большое количество газа даже в тех образцах, которые не обнаруживают никаких дефектов и с обычной точки зрения являются вполне доброкачественными, поэтому метод электронной бомбардировки имеет интерес скорее теоретический, чем практический.
Для суждения о наличии газов в алюминиевых сплавах оказался удобным способ кристаллизации сплава в вакууме.
Этот способ состоит в том, что зачерпнутый в маленький, объемом в 50—100 мл, тигелек сплав помещается в вакуум-эксикатор, в котором после закрытия крышки создается вакуум, соответствующий остаточному давлению, порядка 0.1 мм рт. ст.
В эксикаторе сплав оставляют до полного затвердевания. Под влиянием разрежения пузырьки газа в слитке, которые при нормальном давлении имели бы объем, скажем, 1—2 мм3, увеличиваются во много раз. По этой причине плотность слитка уменьшается весьма сильно, почему пористость слитка, закристаллизованного в обычных условиях, остающаяся незамеченной, проявляется при кристаллизации в вакууме вполне отчетливо. Измеряя плотность слитков, можно составить представление и о грубо количественном соотношении степени газированности различных сплавов. Для быстрого суждения о степени газированности можно ограничиваться сопоставлением макроразрезов слиточков, закристаллизованных в вакууме, или даже судить о пузыристости по величине выпуклости верхней поверхности таких слиточков.
Так как вакуум при этом способе создается еще в то время, когда сплав находится в расплавленном состоянии, то часть газа из раствора в металле может уйти раньше, чем образуется поверхностная корочка твердого металла на слитке. Для того чтобы уменьшить потери газа, иногда сверху на поверхность металла в тигельке кладут круглую железную пластинку толщиной 1,5—2 мм, которая быстро отнимает теплоту от верхних слоев сплава и способствует образованию корки, препятствующей выходу газа из сплава. Этот метод может быть применен также и для определения газированности других сплавов. В особенности он пригоден для сплавов, легко образующих с поверхности прочную и плотную пленку окислов, аналогично тому, что имеет место на алюминиевых сплавах.
В случае применения этого метода для определения наличия газов в сплавах на медной основе, следует на тигелек с испытуемым сплавом накладывать массивный кружок из теплопроводного металла, но таким образом, чтобы он не соприкасался с расплавленным сплавом.
Пузыристость слитков порождается тремя причинами. Первой причиной может явиться наличие газа, механически запутавшегося вследствие захвата падающей струей металла или входящего в металл слитка от смазки поверхности формы. В тех случаях, когда отливается металл, обладающий повышенной вязкостью, газ, попавший в металл извне, не в состоянии выйти из него и остается в слитке в виде пузырей. Повышенная вязкость металла может быть обусловлена мелко раздробленными включениями твердых окислов, а также низкой температурой литья.
Состав газа такого рода пузырей является составом атмосферы изложницы или продуктов перегонки смазки, или газов, адсорбированных поверхностью изложницы, во всех случаях измененным в результате взаимодействия с металлом. Газ может оказаться измененного состава вследствие химических реакций как с металлом, так и с попавшими в слиток посторонними твердыми веществами, например древесным углем. Кроме того, древесный уголь может выделять адсорбированные им газы. В таких пузырях могут обнаружиться газы, никакого отношения к растворимости их в металле не имеющие.
Второй причиной пузыристости слитков может явиться выделение газа из раствора при кристаллизации слитка. В этом случае состав газов будет обусловлен растворимостью их в расплавленном металле и выделением вследствие уменьшения ее при охлаждении.
Третьей причиной пузыристости слитков является образование газа в результате происходящих в металле химических реакций.
Если чистый жидкий металл достаточно долго соприкасается с газовой средой, то в итоге возможны следующие три типа изменения в составе и состоянии этого расплава:
1. Газовая среда может быть инертна по отношению к жидкому металлу, так что не происходит ни растворения газа в расплаве, ни образования каких-либо соединений. В данном случае отсутствие растворения газа оценивается с практической точки зрения, и сюда относятся случаи с достаточно малой растворимостью, не имеющей значения для процесса плавки металлов. Примеры подобного отсутствия взаимодействия можно видеть между любым металлом и любым инертным газом нулевой группы периодической системы элементов Д.И. Менделеева, а также в системах золото — любой газ, содержащийся в воздухе, в системах медь — азот, серебро — азот, в системах таких легкоплавких металлов, как олово, висмут, свинец, кадмий, цинк, сурьма с водородом и азотом.
2. Взаимодействие жидких металлов с газами отличается тем; что наблюдается значительная растворимость газа в металлическом расплаве. Здесь также имеется в виду практически значимая растворимость, которая ощутимо влияет на качество сплава и определяет технологию плавки. В системах, где происходит подобное взаимодействие, в конечном итоге будет существовать насыщенный газом жидкий раствор и газовая фаза при заданных температуре и давлении. В других случаях, по достижении предельной концентрации газа в жидком растворе, возможно образование химического соединения между газом и металлом. Это соединение может быть в твердом или жидком виде. Если газовой фазы несравнимо больше, чем жидкого металла, то в конце концов весь металл будет связан в такое соединение. Для процесса плавки определяющим обстоятельством является именно образование раствора газа в жидком металле. Второй тип взаимодействия наблюдается во многих системах металл — водород. Подобным образом взаимодействуют с водородом магний, алюминий, серебро, медь, никель, железо, титан, хром. Такое же взаимодействие происходит между азотом и жидкими железом и никелем. В системах медь — кислород, никель — кислород, железо — кислород также образуются растворы кислорода в жидких металлах, однако затем возможно появление жидких соединений — оксидов.
3. Очень важный для плавки тип взаимодействия жидкого металла с газом выражается в образовании устойчивых химических соединений металл — газ. Растворимость газа в жидком металле в этих случаях настолько мала, что не имеет практического значения. Подобного рода взаимодействие наблюдается в системах металл — кислород, где металлом является олово, висмут, кадмий, свинец, цинк, сурьма, магний, алюминий. Хотя в случае олова, висмута, свинца и сурьмы отмечается некоторая растворимость кислорода, достигающая около 0,1 % при 900—950 °С, ею можно пренебречь ввиду малости при обычных температурах плавки, не превышающих точку плавления металла на 100—150 °С. Таким образом, взаимодействие подобных металлов с кислородом выражается в образовании оксидной пленки на поверхности жидкого металла. Оксиды этих металлов обладают весьма малым давлением диссоциации' поэтому при плавке практически во всех случаях появляется такая пленка. Далее процесс взаимодействия с кислородом (окисление) расплава будет определяться свойствами этой пленки. Она обычно замедляет окисление.
Итак, в результате взаимодействия жидкого металла с газовой средой при плавке возможно получение либо чистого незагрязненного расплава, либо расплава, содержащего растворенный газ, либо расплава, содержащего частицы нерастворимых соединений металл — газ. Тип взаимодействия определяется, прежде всего, природой металла и газа, а также температурой и давлением газа над расплавом. Для двойной системы металл — простой газ характер взаимодействия и образующиеся фазы можно довольно легко установить по соответствующим диаграммам состояния.
При приготовлении сплавов важно знать не только возможный результат взаимодействия жидкого металла с газами, но и оценивать те изменения, которые вызывает понижение температуры расплава и процесс кристаллизации. В первом типе взаимодействия при полной инертности системы металл — газ, очевидно, этот вопрос не имеет смысла, поскольку приходится иметь дели с практически чистым жидким металлом.
В третьем типе взаимодействия расплав оказывается загрязненным частицами соединений металл — газ, так называемыми первичными докристаллизационными неметаллическими включениями. Эти включения часто имеют вид плен на поверхности расплава и в объеме расплава, куда они попадают при перемешивании и переливах металла из печи в ковш и т. д. Если образующееся соединение металл — газ находится в жидком состоянии, то частицы этого соединения приобретают шарообразную форму размером от долей миллиметра до 1—2 мкм. Все подобные частицы могут быть центрами кристаллизации и оказаться в твердом металле внутри зерен, но могут обнаруживаться и на границах зерен, куда попадают, сдвигаясь при росте кристаллов. Пока металл находится в жидком состоянии, возможно всплывание частиц этих соединений, поскольку они, как правило, имеют меньшую плотность по сравнению с расплавом.
JB металлических расплавах, содержащих растворенный газ, при охлаждении и кристаллизации, происходящих при неизменном общем давлении и парциальном давлении данного газа над расплавом, либо может наблюдаться выделение газа из раствора, либо этого явления может не происходить. Выделение растворенного газа из расплава при его охлаждении и кристаллизации происходит обычно в виде пузырей, которые, оставаясь в твердом металле, нарушают его сплошность. Недопустимость подобного явления очевидна. Однако и в тех случаях, когда газ не выделяется из расплава, он может вызывать изменение физико-механических и других свойств металла.
Примером систем, в которых охлаждение и кристаллизация расплава вызывают выделение газа из раствора, могут служить системы металл — водород, где металлом является магний, алюминий, медь, никель, железо, а также системы железо — азот, никель — азот.
В тех случаях, когда растворенный в расплаве газ не выделяется при кристаллизации из раствора в свободном виде, он непосредственно участвует в процессе кристаллизации: полностью или частично переходит из жидкого раствора в твердый или образует новые фазы в ходе соответствующих реакций. Так, при кристаллизации титана, содержащего растворенные водород, азот или кислород, эти газы целиком переходят из жидкого раствора в твердый. Жидкая медь, содержащая растворенный кислород, кристаллизуется с прохождением эвтектической реакции: расплав твердый раствор на основе меди + закись меди. В зависимости от содержания кислорода эвтектической реакции может предшествовать первичная кристаллизация твердого раствора на основе меди или закиси меди.
Процесс взаимодействия жидкого металла с газами состоит из нескольких ступеней. Прежде всего необходимо поступление молекул газа к поверхности жидкого металла. Это обеспечивается посредством молекулярной диффузии в газе и конвективного массопереноса в нем. Коэффициент диффузии в газах прямо пропорционален величине T3/2 (T—температура), обратно пропорционален давлению газа и корню квадратному из массы частиц газа. Поэтому повышение температуры сильно ускоряет поглощение расплавом газов. При давлениях, составляющих около 10в4 Па и более, роль диффузии становится очень малой, и основной массоперенос осуществляется посредством свободной конвекции.
Следующая ступень в процессе взаимодействия заключается в осаждении молекул газа на поверхности расплава. Этот процесс называется адсорбцией. При высоких температурах основная роль принадлежит так называемой активированной адсорбции или хемосорбции, а не простой физической адсорбции, реализуемой лишь при низких температурах. Хемосорбция выражается не только в осаждении молекул газа на поверхности расплава, но и в частичной диссоциации молекул на атомы. Об этом свидетельствует большая величина теплоты хемосорбции, близкая к теплоте диссоциации двухатомных газов и составляющая сотни килоджоулей на 1 моль газа
Атомы, газа, адсорбированные на поверхности расплава, готовы как для образования молекул химического соединения металл — газ, так и для диффузии в глубь расплава. Если взаимодействие состоит в возникновении нерастворимых в расплаве соединений, то на поверхности расплава начинает нарастать слой этого соединения Обычно слой нарастает в результате диффузии атомов (вернее, ионов) газа через слой соединения к поверхности раздела расплав — соединение. Чем выше температура, тем этот процесс идет интенсивнее. Если слой соединения сплошной и механически прочный, то скорость взаимодействия непрерывно убывает по параболическому закону во времени по мере утолщения этого слоя. Подобным образом происходит взаимодействие жидкого алюминия и многих сплавов на его основе с кислородом, когда на поверхности образуется пленка оксида алюминия. Так же происходит окисление жидких олова, висмута, кадмия, свинца, цинка и сплавов на их основе при невысоких перегревах (100—200 °С над ликвидусом).
Если же пленка соединения металл — газ непрочна и не покрывает полностью поверхность расплава, то взаимодействие идет с постоянной скоростью, не замедляясь. При условии экзотермичности процесса образования соединения металл — газ может происходить очень сильное локальное повышение температуры, приводящее к горению расплава. Это наблюдается при перегревах жидкого магния и его сплавов на воздухе выше 700 С, а также при перегревах цинка выше 600 °С.
Если расплав способен растворять газ, то адсорбированные атомы газа диффундируют в глубь расплава. В металлических расплавах газы могут растворяться лишь в атомарном состоянии, т. е. в виде атомов простых газов или в виде атомов элементов, составляющих сложный газ. Процесс растворения газа в приповерхностном слое целиком определяется диффузией. Коэффициент диффузии водорода в жидких металлах при небольших перегревах составляет около 10в-3 см2/с; для азота и кислорода он примерно на порядок меньше. В глубине расплава распространение атомов газов осуществляется главным образом конвективным массопереносом. Нередко вследствие ограниченности диффузионного массопереноса в жидкой фазе на поверхности расплава возникает слой соединения, хотя еще во всей массе расплава предельная концентрация газа в растворе далеко не достигнута
Поскольку газ, растворенный в жидком или твердом металле, находится в атомарном состоянии, зависимость растворимости двухатомных газов в металлах [S] от их давления над расплавом р при постоянной температуре подчиняется закону квадратного корня; [S] = k√р, где k — постоянный множитель для данной пары металл — газ.
Эту зависимость называют законом Сивертса, по имени ученого, впервые ее исследовавшего. Закон Сивертса является частным случаем закона Генри, выражающего прямую пропорциональную зависимость растворимости газа в жидкости от давления при отсутствии диссоциации газа. Закон Генри описывает, в частности, растворимость кислорода и азота (воздуха) в воде.
Закон Сивертса строго справедлив при давлениях газа примерно до 10 МПа и выполняется в широком интервале температур, охватывающем как жидкое, так и твердое состояние металла. График функции [S ] — k√р изображен на рис. 4.
Зависимость растворимости газа в металле [S] от абсолютной температуры T при постоянном давлении описывается законом Борелиуса:

где A0 — постоянная величина; Q — теплота растворения газа в металле; R — газовая постоянная. Общее уравнение, описывающее растворимость газа в металлах как функцию давления и температуры, имеет вид:

Во многих системах металл — газ растворение газа происходит с поглощением тепла, т. е, является эндотермическим процессом. Поэтому, как это принято в термодинамике, величина Q считается положительной. При таком условии оказывается, что увеличение температуры приводит к росту растворимости газа в металле. Графически зависимость при таких условиях изображена на рис. 5. На этом рисунке имеются две кривые, описывающие растворимость газа в твердом металле ниже tпл и в жидком металле выше tпл. Для каждой кривой имеются свои значения А и Q.

Имеется большое число металлов, в которых процесс растворения газов является экзотермическим, и, следовательно, теплота растворения газов в них отрицательна. В таких металлах повышение температуры вызывает монотонное снижение растворимости газа, причем это справедливо как для твердого, так и для жидкого металла. Подобное явление наблюдается у всех металлов 4, 5 и 6-й групп периодической системы элементов Д. И. Менделеева, т. е. у титана, циркония, гафния (4-я группа), ванадия, ниобия, тантала (5-я группа), хрома, молибдена, вольфрама (6-я группа) при взаимодействии с водородом и азотом. Точно так же ведут себя с этими газами все редкоземельные металлы.
Рассмотренные изменения растворимости газов в металлах в зависимости от давления и температуры справедливы для равновесного состояния при достаточно медленном изменении внешних условий. Если давление или температура возрастают слишком быстро, растворимость начинает отставать от значений, определяемых приведенными формулами, из-за того, что некоторые из ступеней общего процесса растворения не обеспечивают передачу нужного количества газа. Обычно таким узким местом является диффузия. В итоге получаются завышенные или заниженные значения содержания растворенного в металле газа.
Еще более осложняются явления при понижении температуры и давления газа над расплавом, если при этом должна снижаться растворимость газа. В большинстве случаев оказывается, что выделение газа из раствора не успевает проходить через свободную поверхность расплава, граничащую с газом. Усиливающееся пересыщение расплава из-за снижения давления или температуры приводит к возникновению пузырьков газа внутри расплава. Это явление представляет собой зарождение и рост частиц новой фазы в исходной матрице. В данном случае процесс осложнен тем, что возникают дополнительные ограничения, связанные с сжимаемостью газового пузырька. Гомогенное зарождение газовых пузырьков в расплаве, по-видимому, невозможно. Из энергетических соображений следует, что газовые пузырьки могут возникнуть лишь на готовых зародышах, представляющих собой поры и трещины в нерастворимых в расплаве твердых частицах примесе, заполненные какими-то инертными для данного металла газами. Именно в эти готовые полости устремляются атомы растворенных в металлах газов, и здесь начинает расти газовый пузырек.
Особенность существования газового пузырька в расплаве состоит в том, что давление в нем рпуз определяется зависимостью: рпуз = рвн + dgh + 2σ/r, где рвн — внешнее давление над расплавом; dgh — металлостатическое давление, зависящее от плотности расплава d, земного ускорения g, расстояния от зеркала металла (глубины) h; 2σ/r — капиллярное давление, зависящее от межфазного натяжения σ на границе расплав — газ и радиуса пузырька r.
Если в газовой среде имеется только один газ, а давлением пара металла можно пренебречь, то давление этого газа и будет внешним р°вн. Это же давление будет определять содержание данного газа в расплаве по закону Сивертса [S°] = k√p°вн. Если предположить, что в расплаве возникает по каким-то причинам пузырек газа радиусом r, причем для простоты принять, что он возникает у самой поверхности, так что h = 0, то давление газа в таком пузырьке будет р°пуз = p°вн + 2σ/r. Поскольку газ в пузырьке находится под таким давлением, содержание его в окружающем растворе должно быть равно:
Очевидно, что [S'] всегда больше [S°], т. е. имеющийся раствор по отношению к давлению в пузырьке ненасыщен. Поэтому газ из пузырька будет растворяться в расплаве. В итоге пузырек газа должен исчезнуть. Таким образом, оказывается, что пузырьки газа вообще не могут существовать в расплаве, находящемся в равновесии с газовой средой, если равновесие, как обычно, достигнуто через открытое зеркало расплава.
Скорость изменения температуры расплава существенно сказывается на уровне содержания растворенных в металле газов. Если нагрев металла происходит быстро, то расплав не успевает насытиться газом до предела, содержание его в расплаве оказывается меньшим, чем по кривой [S] = f(T). Опыт показывает, что понижение температуры со скоростью более 1 °С/с приводит к неполному выделению газа из раствора. В итоге в металле при низких температурах обнаруживаются большие содержания газа, чем следует из кривой на рис. 5. Газы могут полностью остаться в растворе в случае повышенных скоростей охлаждения; иначе говоря, происходит типичная закалка раствора газа, сначала в жидком металле, а затем и в твердом. Этим явлением широко пользуются при отборе проб расплава для определения содержания газов.
Газы, оставшиеся в пересыщенном растворе в твердом металле, нельзя считать безвредными. Они могут влиять на прочностные свойства, снижать показатели пластичности металла, изменять коррозионные свойства Происходящий постепенный распад раствора приводит к выделению свободного газа, который скапливается на границах зерен, в микротрещинах, около неметаллических включений. В этих местах резко возрастает давление, создаваемое выделяющимся газом, и это может привести к разрушению металла. Подогрев ускоряет распад раствора и усиливает опасность разрушения. Такие виды брака, как флокены (своеобразные трещины) в сталях и расслоения в деформируемых цветных сплавах, объясняются именно выделением газов из раствора.
Растворимость газов в металле
В любой стали в некоторых количествах содержатся газы. К ним в первую очередь относятся кислород, водород, азот. В отливках газы содержатся в виде газовых включений или раковин, химических соединений, твердых растворов.
В чистом железе при комнатной температуре водород содержится в твердом растворе в виде атомов или ионов, азот в виде нитридов и частично в твердом растворе, кислород преимущественно в виде оксидов и частично в твердом растворе. В стали, содержащей много компонентов, могут существовать различные соединения газов с примесями железа.
Источниками газов могут быть шихтовые материалы, атмосфера печи, топливо, флюсы, футеровка печи и разливочных ковшей (рис. 4.1).
Процесс растворения газов в металле в виде атомов, ионов или с образованием химических соединений является многостадийным. Его можно разделить на несколько этапов:
- массоперенос газа к поверхности металла;
- адсорбция газа на поверхности металла;
- переход через границу газ металл;
- массоперенос в толщу металла.
Лимитирующим звеном процесса растворения газа в стали может быть либо внешнедиффузионная (подвод газа к поверхности металла), либо внутридиффузионная (массоперенос в металле) область. В ряде случаев лимитирующим будет адсорбционно-кинетическое звено (адсорбция на поверхности и переход через граничный слой). Наиболее часто лимитирующим звеном процесса является внутридиффузионная область.

При этом необходимо учитывать, что в стали всегда присутствует то или иное количество примесей или легирующих элементов. Компоненты стали (кроме железа и газа), обладающие поверхностной активностью, будут оказывать существенное влияние на интенсивность перехода газа через границу металл газ.
Зависимость растворимости газа S от температуры при нормальном парциальном давлении имеет следующий вид:
где ΔНS — изменение энтальпии при растворении и образовании раствора данного газа; R - универсальная газовая постоянная; Т — температура; С - постоянная интегрирования.

В логарифмической форме уравнение имеет вид:
В прямоугольных координатах зависимость lnS от 1/Т обычно изображается прямыми линия ми различного направления (рис. 4.2).
В общем случае ΔНs. зависит одновременно от изменения энтальпии при диссоциации молекул газа у поверхности расплава стали (ΔНдис при растворении (ΔНраств) и при взаимодействии, которое может иметь место между растворяющимся газом и растворенными в железе примесями (ΔНвзаим):
Δ Нs= Δ Ндис + Δ Нраств + Δ Нвзаим (4.3)
Именно поэтому, в зависимости от величины суммарного изменения энтальпии ΔНs, растворимость газов будет увеличиваться или уменьшаться с повышением температуры.
Изменение растворимости от давления газа Sг=f(Р) будет различным для случаев образования раствора, близкого к идеальному, или образования химического соединения. При образовании химического соединения на кривой Sг—Рг имеется перегиб (рис. 4.3).
Водород в стали и отливках
Водород в стали, попавший в нее в процессе плавки и из формы в процессе кристаллизации, является одной из причин образования газовых раковин.
Водород растворяется в железе и его сплавах в атомарном состоянии с образованием растворов внедрения. Растворимость водорода в чистом железе подчиняется закону Сивертса: пропорциональна корню квадратному из его парциального давления, т. е.
где Рн2 - парциальное давление водорода; К - константа. На рис. 4.4 показана растворимость водорода в железе в зависимости от температуры.

Анализ этой зависимости позволяет сделать следующие выводы:
- с повышением температуры растворимость водорода увеличивается; с понижением уменьшается;
- растворимость водорода в различных модификациях железа различна;
- при переходе железа из жидкого со стояния в твердое и из одной модификации в другую растворимость водорода меняется скачкообразно.
Исходя из этого, следует отметить, что на протяжении всего процесса затвердевания и охлаждения отливки в форме будет происходить выделение водорода.
Содержащиеся в стали элементы по-разному влияют на растворимость в ней водорода. По этому влиянию их можно разделить на 3 группы (рис. 4.5).
1. Элементы, повышающие растворимость водорода — титан, цирконий, тантал, ниобий, ванадий. Они образуют с ним достаточно стойкие соединения при низких температурах.
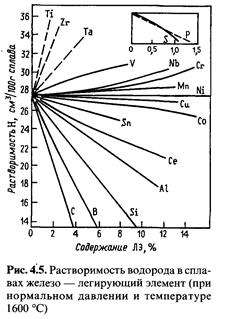
2. Элементы, уменьшающие растворимость водорода углерод, кремний, алюминий, бор и др. Их связи с железом сильнее, чем у водорода с железом.
3. Элементы, слабо влияющие на растворимость водорода никель, кобальт, марганец, молибден, медь, хром. Их влияние заметно проявляется только при высоких содержаниях: в средне- и высоко- легированных сталях.

Вследствие присутствия водорода в жидкой стали и затвердевающей отливке образуются газовые раковины.
В твердой отливке при повышении ее температуры или под влиянием времени атомарный водород может свободно диффундировать, но только если на его пути к поверхности отливки не встречаются нарушения сплошности металла. При попадании в такие полости, а также при столкновении с неметаллическими включениями и искажениями кристаллической решетки атомарный водород соединяется в молекулы, дальнейшая диффузия молекул водорода невозможна. В них начинает диффундировать атомарный водород и тоже образовывать молекулы. Процесс развивается, объем газа растет. Растет и его давление на стенки металла. И в данном месте отливки образуется сильно напряженный участок или даже внутрикристаллическая трещина, если давление газа превысит предел прочности стали, что снижает качество отливки.
Азот в стали и отливках
В жидкую сталь азот поступает с шихтовыми материалами. Металлический лом, скрап, чугун содержат обычно 0,002—0,008 % N. Дополнительно азот переходит в металл из печной атмосферы в области дуг при выплавке стали в дуговой электропечи. В зоне действия дуг молекулярный азот диссоциирует на атомарный. Это интенсифицирует процесс насыщения стали азотом.
Растворимость азота в стали также подчиняется закону Сивертса и описывается уравнением
где К - константа; - парциальное давление азота.
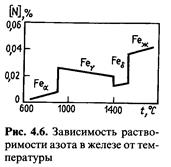
Кривая изменения растворимости азота в железе приведена на рис. 4.6. Анализ этого рисунка позволяет сделать следующие выводы:
— растворимость азота в α-Fе и δ-Fе увеличивается с увеличением температуры, а в γ-Fе снижается; снижение связано с уменьшением стойкости нитрида железа Fе4N;
— растворимость азота при переходе из жидкого состояния в твердое и из одной модификации в другую изменяется скачкообразно.
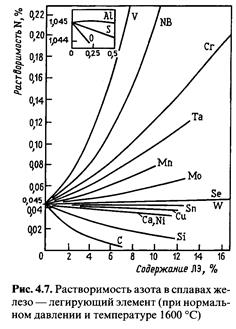
Азот обладает высоким химическим сродством ко многим элементам, входящим в сталь, и образует с ними нитриды. По влиянию на растворимость азота в жидком железе элементы можно разделить на 3 группы (рис. 4.7):
1. Элементы, образующие прочные нитриды (Аl, Тi, Zr, V, Nb) и повышающие растворимость азота в железе.
2. Элементы, обычно не образующие нитридов, но обладающие достаточно высоким сродством к азоту (Cr, Та, Mn, Мо) и заметно повышающие растворимость азота в железе.
3. Элементы, не образующие нитридов (С, Ni, Сu, Со) или образующие нитриды менее прочные, чем нитрид железа, и понижающие растворимость азота в железе.
Из теории и практики известно, что наличие в конструкционной стали 0,003—0,02 % N не приводит к образованию пузырей и пористости в процессе кристаллизации и затвердевания отливки, так как в этот момент нет пересыщения стали азотом и его парциальное давление недостаточно для развития газовыделения.
В массивных толстостенных отливках из углеродистых сталей содержание азота повышается снизу вверх и от стенок к центру. Ликвация его увеличивается с увеличением абсолютного содержания. Поэтому наличие азота и неравномерность его распределения в литой углеродистой стали нежелательны, так как азот является основной причиной «старения» сталей ферритного и ферритно-перлитного классов.
Старение это выделение избыточного азота из раствора в твердой отливке с образованием нитрида железа Fе4N. Присутствие в стали азота в виде Fе4N приводит к ее охрупчиванию, так как эти нитриды имеют игольчатую форму и пронизывают весь объем зерен железа. Для устранения этого явления в сталь вводят более сильные, чем железо, нитридообразующие элементы, например, Аl, Тi, V и др. В общем следует отметить, что процесс старения не характерен для стальных отливок, так как практически всегда конечное раскисление стали проводят алюминием.
Присутствие азота в стальных отливках в виде дисперсных нитридов легирующих элементов (TiN, VN, ZrN, NbN, АlN и др.) приводит к их модифицированию, а также сильному упрочнению при термической обработке. Именно поэтому получили распространение высокопрочные конструкционные стали с нитридным и карбонитридным упрочнением. Положительное влияние азота не может проявляться самостоятельно, а только в сочетании с сильными нитридообразующими элементами.
Обычно содержание азота, как легирующего элемента, находится в пределах 0,01—0,04%.
Таким образом, можно выделить три положительных фактора влияния азота в сочетании с сильными нитридообразующими элементами на свойства отливок:
- устранение образования нитридов неблагоприятной морфологии (Fе пленка АlN в азотсодержащих сталях при их раскислении алюминием);
- модифицирование структуры вследствие образования в жидкой стали дисперсных тугоплавких нитридов (ТiN, ZrN, HfN и др.), которые служат дополнительными центрами кристаллизации и измельчают структуру отливок;
- упрочнение отливок нитридными и карбонитридными частицами (VN, VCN и др.) в процессе термической обработки.
Максимальное содержание азота, определенное для обычной углеродистой стали в условиях равновесия при давлении ~100 кПа (1 ат) составляет 0,39 % (по массе), что значительно больше, чем содержание водорода. Но фактическое содержание азота в обычной стали, даже при выплавке в дуговой электропечи, не превышает 0,03—0,04 %. Объем азота, как газа, меньше объема водорода из-за большей атомной массы. Диффузия атомарного азота через кристаллическую решетку затруднена вследствие его больших атомных размеров по сравнению с атомным размером водорода.
Однако влиянием азота на образование газовых раковин по вине металла не следует пренебрегать. Если не связать азот в устойчивые нитриды, т. е. допустить выделение его в свободном состоянии, то аналогично водороду можно получить «азотистое кипение» стали.
4.1.4. Механизм образования зндогенных газовых включений
И меры по их предотвращению
Эндогенные газовые включения характеризуются тем, что источники газов более или менее равномерно рассредоточены по всему объему жидкого металла, поэтому следовало бы считать, что газовые дефекты также равномерно распределяются по сечению отливки. Однако на практике наблюдается неравномерность распределения в отливках газовых включений, что связано с действием таких факторов, как значительный перепад температур по объему отливки, последовательный характер кристаллизации металла, ликвация, действие гравитационных сил и т. д.
При затвердевании отливок вследствие уменьшения растворимости газов в металле с понижением температуры начинается выделение газов, и пузырек зарождается в тот момент, когда их содержание превысит равновесную концентрацию для данной температуры сплава. Условие зарождения пузырька в жидком металле определяется выражением
где Рг - парциальное давление газа в металле; Ратм - атмосферное давление над уровнем металла; Рм = ρНм — металлостатическое давление; Рσ = 2σ/r — давление поверхности металла на газовый пузырек радиусом r при величине поверхностной энергии σ.
В реальных сплавах зародышами газовых пузырьков в жидком металле служат различные микро- и макровключения, а также кристаллы твердой фазы, на границе с которыми пузырьки образуются при минимальных энергетических затратах. Кроме того, при достаточно высокой концентрации кислорода в углеродистых сталях в процессе кристаллизации создаются условия для возникновения и относительно быстрого роста зародышей оксида углерода и формирования газовой пористости в отливках.
Для того чтобы снизить вероятность или исключить образование эндогенных газовых дефектов в стальных отливках, можно рекомендовать следующие меры:
— предварительную подготовку и использование чистых шихтовых материалов; применение материалов без ржавчины и влаги;
— предотвращение активного взаимодействия расплава с атмосферой печи и футеровкой;
— интенсивное ведение плавки и рафинирование расплава;
— глубокое раскисление стали перед заливкой форм;
— выбор оптимальных температур плавки и заливки;
— уменьшение времени выдержки металла в ковше;
—создание условий для удаления из отливки выделяющихся при ее затвердевании газов.
Читайте также:
