Самостоятельная работа по химии 9 класс получение металлов
Обновлено: 04.10.2024
1. Напишите уравнения реакций восстановления углем меди из оксида меди (I) и из оксида меди (II). Обозначьте степени окисления элементов и укажите окислитель и восстановитель.
2. Какую массу марганца можно получить при восстановлении 90 г оксида марганца (IV), содержащего 5% примесей, алюминотермическим способом?
Вариант 2 (Способы получения металлов)
1. Составьте уравнение реакции получения хрома из оксида
хрома (III) алюминотермическим способом. Обозначьте степени
окисления элементов и укажите окислитель и восстановитель.
2. Какую массу железа можно получить из 960 г оксида железа
(III) при восстановлении его оксидом углерода (II), если массовая
доля выхода составляет 90%?
Вариант 3 (Способы получения металлов)
1. Напишите уравнения реакций восстановления оксидом углерода (II): а) свинца из его высшего оксида; б) меди из оксида меди (II). Обозначьте степени окисления элементов и укажите окислитель и восстановитель.
2. Какая масса оксида хрома (III), содержащего 10 % примесей, необходима для получения 52 г хрома алюминотермическим способом?
Вариант 4 (Способы получения металлов)
1. Составьте уравнение реакции получения молибдена из его высшего оксида путем восстановления водородом. Обозначьте степени окисления элементов и укажите окислитель и восстановитель.
2. Какую массу меди можно получить при восстановлении углем 160 г оксида меди (II), если массовая доля выхода меди составляет 85%?
О. Р. Татьянина, МОУ Лицей 15, г. Саратов
– ния элементов и укажите окислитель и восстановитель.
2. Какую массу марганца можно получить при восстановлении 90 г оксида марганца (IV), содержащего 5% примесей, алюмино-термическим способом?
Вариант 2 (Способы получения металлов)
Вариант 3 (Способы получения металлов)
1. Напишите уравнения реакций восстановления оксидом угле-рода (II): а) свинца из его высшего оксида; б) меди из оксида меди (II). Обозначьте степени окисления элементов и укажите окислитель и восстановитель.
2. Какая масса оксида хрома (III), содержащего 10 % примесей, необходима для получения 52 г хрома алюминотермическим спо-собом?
Вариант 4 (Способы получения металлов)
1. Составьте уравнение реакции получения молибдена из его высшего оксида путем восстановления водородом. Обозначьте сте-пени окисления элементов и укажите окислитель и восстановитель.
2. Какую массу меди можно получить при восстановлении уг-лем 160 г оксида меди (II), если массовая доля выхода меди со-ставляет 85%?
Тест по теме: «Металлы. Общая характеристика. Получение металлов».
тест по химии (9 класс) на тему
Тест в 2-х вариантах по теме: «Металлы. Общая характеристика. Получение металлов" для контроля знаний учащихся 9 класса по линиям учебника Рудзитиси, Фельдмана.
| Вложение | Размер |
|---|---|
| metally_testirovanie.doc | 29.5 КБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Тест по теме: «Металлы. Общая характеристика. Получение металлов».
1. На внешнем энергетическом уровне три электрона имеются у атомов металлов:
Б) кальция, бария;
В) алюминия, индия;
Г) алюминия, кальция.
2. Металлом, строение внешнего энергетического уровня которого …4s 2 , является:
3. Строение атомов кальция характеризуется следующим распределением электронов по электронным слоям в электронной оболочке:
4. Железо проявляет степень окисления +2 в соединении формула которого
5. Способ восстановления металлов более активным алюминием называется
С 1. Напишите электронную формулу Zn.
С 2. Охарактеризуйте металлическую химическую связь. Как она возникает? Что из себя представляет металлическая кристаллическая решетка?
С 3. Найдите число протонов, нейтронов и электронов у иона Cu 2+ .
1. На внешнем энергетическом уровне два электрона имеются у атомов металлов:
А) калия, серебра;
Г) магния, кальция.
2. Металлом, строение внешнего энергетического уровня которого …3s 1 , является:
3. Строение атомов магния характеризуется следующим распределением электронов по электронным слоям в электронной оболочке:
4. Сu проявляет степень окисления +1 в соединении формула которого
5. У атомов металлов на наружном энергетическом уровне находится
В) 2,3,7,8 электронов
Г) от 1 до 3 электронов.
С 1. Напишите электронную формулу Cu.
С 2. Каковы физические свойства металлов. Поясните.
С 3. Найдите число протонов, нейтронов и электронов у иона Ag + .
По теме: методические разработки, презентации и конспекты
Урок по теме "Общие способы получения металлов"
Урок в курсе химии 9 класса к учебнику О.С.Габриеляна.
Конспект урока по теме:"Металлы, их положение в Периодической системе, строение атомов металлов. Общие физические свойства металлов."

Урок в 9 классе "Общие способы получения металлов"
В помощь учителю материал можно использовать для подготовки отрытого урока.

Вопрос А-29 (Понятие о металлургии: общие способы получения металлов.)
Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение .

Урок на тему: "Общая характеристика щелочных металлов"

Урок химии в 11 классе по теме: «Металлы в природе. Общие способы получения металлов»
"Человек не может обойтись без металлов. Если бы не было металлов, люди влачили бы самую жалкую жизнь среди диких зверей. ".

Методическая разработка урока по химии «Металлы в природе. Общие способы получения металлов» 9 класс (базовый курс, О.С. Габриелян)
В данной разработке приведен подробный конспект урока химии в 9 классе по теме «Металлы в природе. Общие способы получения металлов». Содержание соответствует базовому курсу химии авт.
Самостоятельная работа "Сплавы. Способы получения металлов"
тренажёр по химии (9 класс) на тему
Самостоятельная работа включает 12 вопросов, 2 варианта.
| Вложение | Размер |
|---|---|
| test_sposoby_polucheniya_metallov_splavy.doc | 147.5 КБ |
«Получение металлов. Сплавы» Вариант
1. Сплав железа с углеродом, в котором содержание углерода от 2 до 4,5% называется …
2. Легирующий элемент, придающий стали твердость, жаропрочность, износоустойчивость – это …
3. Цветной сплав, на основе меди с добавлением олова (до 20%) - …
4. Латунь – сплав, состоящий из …… Применяют ее ….
5. Природные соединения, в которых металлы существуют в связанном состоянии, называются …
6. В самородном состоянии в природе встречается металл …
7. Минерал железа, имеющий формулу Fe 2 О 3 , называется …
8. Методы получения металлов, основанные на химических реакциях, происходящих при высоких температурах - ….
9. Минерал свинцовый блеск, или галенит имеет формулу …. Запишите уравнение реакции обжига этого минерала …
10. Марганец получают восстановлением оксида марганца (IV) алюминием. Запишите уравнение этой реакции.
11. В чистом виде металлы используют редко. Чаще применяют их сплавы, так как …
12. На рисунке представлена схема …
1. Сплав железа с углеродом, в котором содержание углерода менее 2%
2. Легирующий элемент, придающий стали жаропрочность, механическую прочность при высоких температурах, коррозионную стойкость - …
3. Цветной сплав, на основе меди с добавлением никеля (20%)- ..
4. Дюралюминий – это сплав, состоящий из …. Применяют его …
5. Наука о методах получения металлов и сплавов и их обработке называется ….
6. Метод получения металлов с использованием алюминия в качестве восстановителя, называется ….
7. Минерал железа, имеющий формулу Fe 3 О 4 называется …
8. Методы получения металлов, основанные на химических реакциях, происходящих в растворах- ….
9. Минерал цинковая обманка имеет
формулу …. Запишите уравнение реакции обжига этого минерала…..
10. Хром получают восстановлением оксида хрома (III) водородом. Запишите уравнение этой реакции.
11. Металлы цинк, олово, алюминий, никель не встречаются в самородном состоянии, так как…

презентация по теме "Способы получения металлов. Сплавы"
Способы получения металлов
Тест в программе PowerPoint. Указывает затраченное время, количество ошибок, оценка.
Презентация "Способы получения металлов"
Материал даёт возможность рассмотреть все способы получения металлов.
проверочные работы по теме "Металлы" 9 класс
тест по химии (9 класс) на тему
Данные проверочные работы предназначены для текущего контроля усвоения знаний обучающимися. В заключении проводится контрольная работа.
| Вложение | Размер |
|---|---|
| alyuminiy.docx | 18.56 КБ |
| zhelezo.docx | 18.08 КБ |
| sposoby_polucheniya_metallov.docx | 12.11 КБ |
| himicheskie_svoystva_metallov.docx | 11.91 КБ |
| kontrolnaya_rabota_po_teme.docx | 20.29 КБ |
Вариант 1 ( Алюминий и его соединения)
- Напишите уравнения реакций взаимодействия алюминия со следующими веществами:
хлором, разбавленной серной кислотой, оксидом хрома (III), раствором сульфата меди (II).
2. Напишите уравнения реакций, позволяющих осуществить следующие превращения:
Аl (ОН)з →А1Сlз →Аl(ОН)з → Аl 2 Оз
- По каким внешним признакам вы сможете отличить изделия из
алюминия от изделий из других материалов?
Вариант 2 ( Алюминий и его соединения)
1. Допишите следующие уравнения химических реакций
Fe 2 O 3 + Al → ; Al(OH) 3 + NaOH →;
Al 2 (SO 4 ) 3 + BaCl 2 →;
Укажите среди них окислительно-восстановительные реакции,
а также окислитель и восстановитель.
2. Напишите уравнения реакций, при помощи которых возмож-
ны следукццие превращения:
Аl ( NO 3 ) 3 →Аl (ОН) 3 →А1 2 O 3 → Аl 2 (SO 4 ) 3
3. Опишите области применения алюминия и укажите свойства,
на которых основано его использование.
Вариант 3( Алюминий и его соединения)
1. Напишите уравнения реакций получения хлорида алюминия четырьмя способами.
Аl →Аl 2 O 3 →А1 2 (SO 4 ) 3 →А1(ОН) 3
3. Почему алюминиевая посуда не разрушается в кипящей воде
и не подвергается атмосферной коррозии?
Вариант 4 ( Алюминий и его соединения)
бромом, серой, водой, гидроксидом на-трия.
2. Напишите полные уравнения реакций исходя из схем:
НС1 + ? = АlСl 3 + Н 2 О
- При производстве алюминиевой проволоки расплавленный алюминий выпускают
через круглое отверстие. Струя затвердева-ет, не разбиваясь на капли. Почему?
3.При производстве алюминиевой проволоки расплавленный алюминий выпускают
Вариант 1 (Железо и его соединения)
- Напишите уравнения реакций взаимодействия железа с про-стыми
веществами: кислородом, хлором, серой, бромом. Дайте на-звания
- Изобразите схему строения атома железа. Укажите степени окисления,
которые железо проявляет в соединениях.
- Как доказать, что в одном из двух растворов есть ионы Fе +2 , а в другом —
ионы Fе +3 ? Напишите уравнения протекающих ре-акций.
- К раствору, содержащему 32 г сульфата меди (11), прибавили
28 г железных стружек. Какая масса меди выделится при этом?
Вариант 2 (Железо и его соединения)
- Напишите уравнения реакций, при помощи которых можно осуществить
Fе (NOз)з→ Fе (ОН)з→ Fе 2 O 3 →Fе →FеС1 2
- Какие свойства: окислительные или восстановительные —
проявляют соединения железа со степенью окисления + 2? Почему?
- Как, исходя из металлического железа, можно получить
гид-роксид железа (II) и гидроксид железа (III)? Приведите уравнения реакций.
- Рассчитайте, какой объем (н. У.) водорода можно получить
при растворении в разбавленной серной кислоте 112 г железа, если
объемная доля выхода водорода составляет 98%.
Вариант 3 (Железо и его соединения)
1. Напишите уравнения реакций взаимодействия железа с растворами:
а) серной кислоты; б) сульфата меди (II); в) бромоводо-родной кислоты; г) нитрата свинца.
2. Какой характер имеют оксиды железа (II) и (III) и соответст-вующие им гидроксиды?
3. В трех пронумерованных пробирках выданы растворы хлори-дов: натрия, бария и железа (II). Как опытным путем их можно распознать? Напишите соответствующие уравнения реакций.
4. Какой объем (н. У.) оксида углерода (IV) выделится при взаи-модействии соляной кислоты с 50 г минерала сидерита, содержа-щего 80% FеСО 3 ?
Вариант 4 (Железо и его соединения)
1. Напишите уравнения реакций, при помощи которых можно
осуществить следующие превращения:
Fе → FеSO 4 → Fе (ОН) 2 → Fе (ОН)з →FеС1з
2. Какую реакцию среды имеют водные растворы солей железа (III)? Почему?
3. Как, исходя из сульфата железа (II), получить: а) хлорид же-леза (II); б) нитрат железа (II)? Напишите уравнения соответству-ющих реакций.
4. 7 г железа прореагировало с 18 г хлора. Какая масса хлори-да железа (III) образовалась?
1. Напишите уравнения реакций взаимодействия железа с про-стыми веществами: кислородом, хлором, серой, бромом. Дайте на-звания образующимся веществам.
2. Изобразите схему строения атома железа. Укажите степени окисления, которые железо проявляет в соединениях.
3. Как доказать, что в одном из двух растворов есть ионы Fе +2 , а в другом — ионы Fе +3 ? Напишите уравнения протекающих ре-акций.
4. К раствору, содержащему 32 г сульфата меди (11), прибавили 28 г железных стружек. Какая масса меди выделится при этом?
1. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
2. Какие свойства: окислительные или восстановительные — проявляют соединения железа со степенью окисления + 2? Почему?
3. Как, исходя из металлического железа, можно получить гид-роксид железа (II) и гидроксид железа (III)? Приведите уравнения реакций.
4. Рассчитайте, какой объем (н. У.) водорода можно получить при растворении в разбавленной серной кислоте 112 г железа, если объемная доля выхода водорода составляет 98%.
1. Напишите уравнения реакций взаимодействия железа с растворами: а) серной кислоты; б) сульфата меди (II); в) бромоводо-родной кислоты; г) нитрата свинца.
Вариант 1 (Способы получения металлов)
1. Напишите уравнения реакций восстановления углем меди из оксида меди (I) и из оксида меди (II). Обозначьте степени окисле-ния элементов и укажите окислитель и восстановитель.
1. Составьте уравнение реакции получения хрома из оксида
хрома (III) алюминотермическим способом. Обозначьте степени
окисления элементов и укажите окислитель и восстановитель.
2. Какую массу железа можно получить из 960 г оксида железа
(III) при восстановлении его оксидом углерода (II), если массовая
доля выхода составляет 90%?
Вариант 5 (Химические свойства металлов)
1. Составьте уравнения реакций взаимодействия: а) натрия с серой; б) железа с раствором серной кислоты; в) алюминия с бро-мом. В уравнении реакции (а) укажите степени окисления элемен-тов и расставьте коэффициенты методом электронного баланса.
2. Между какими веществами произойдет химическая реакция: а) медь и раствор сульфата железа (II); б) цинк и раствор нитрата ртути (II); в) магний и раствор нитрата свинца (II)? Напишите со-ответствующие уравнения реакций в молекулярной и сокращенной ионной формах.
Вариант 6 (Химические свойства металлов)
1. Составьте уравнения реакций взаимодействия: а) меди с кис-лородом; б) железа с хлором; в) бария с водой. В уравнении реак-ции (а) укажите степени окисления элементов и расставьте коэф-фициенты методом электронного баланса.
2. Между какими веществами произойдет химическая реакция: а) медь и раствор нитрата серебра; б) железо и раствор нитрата ртути (II); в) свинец и раствор хлорида хрома (III)? Напишите соот-ветствующие уравнения реакций в молекулярной и сокращенной ионной формах.
Вариант 7 (Химические свойства металлов)
1. Составьте уравнения реакций взаимодействия: а) алюминия с иодом; б) меди с серой; в) натрия с водой. В уравнении реакции (а) укажите степени окисления элементов и расставьте коэффици-енты методом электронного баланса.
2. Между какими веществами произойдет химическая реакция: а) железо и раствор хлорида меди (II); б) серебро и раствор броми-да кальция; в) алюминий и раствор нитрата свинца (II). Напишите соответствующие уравнения реакций в молекулярной и сокращен-ной ионной формах.
Вариант 8 (Химические свойства металлов)
1. Составьте уравнения реакций взаимодействия: а) магния с соляной кислотой; б) цинка с кислородом; в) кальция с хлором. В уравнении реакции (а) укажите степени окисления элементов и расставьте коэффициенты методом электронного баланса.
2. Между какими веществами произойдет химическая реакция: а) магний и раствор нитрата ртути (II); б) медь и раствор хлорида хрома (III); в) цинк и раствор сульфата железа (II)? Напишите со-ответствующие уравнения реакций в молекулярной и сокращенной ионной формах.
Контрольно-измерительные материалы по теме: " Способы получения металлов" химия 9 класс

презентация составлена согласно ФГОС.Предусмотрена проверка ранее изученного материала и закрепление.
Просмотр содержимого документа
«Контрольно-измерительные материалы по теме: " Способы получения металлов" химия 9 класс»

1. Какие высказывания верны, а какие – нет:
- Металлы активно взаимодействуют с основаниями
- При взаимодействии металла с водой всегда образуется оксид.
- Щелочные металлы взаимодействуют с водой при обычных условиях
- С кислотами взаимодействуют все металлы
- Щелочные металлы не взаимодействуют с растворами кислот
2. Найдите ошибки в уравнениях реакций:

Объясните, используя знания о химических свойствах металлов, почему нельзя:
а)хранить литий на воздухе?
б)использовать для прекращения горения натрия воду.
в)хранить кислые щи в алюминиевой кастрюле.
г)готовить раствор сульфата меди в ведре, сделанном из оцинкованного железа.

«Жизнь учит тех, кто её изучает»
Д. И. Менделеев
Способы получения металлов .
Пирометаллургия.
Пирометаллургия – это получение металлов из природных руд реакциями восстановления при высокой температуре.

Получение из оксидов.
1) Восстановление углеродом.
2) Восстановление угарным газом.
Fe 2 O 3 + 3CO 2Fe + 3CO 2
Такими способами получают металлы средней активности и неактивные.

Получение из оксидов .
3) Восстановление водородом.
WO 3 + 3H 2 t W + 3H 2 O
Таким способом получают редкоземельные металлы.

Алюмотермия
4) 3MnO 2 + 4Al t 3Mn + 2Al 2 O 3
Таким способом получают Mn, Cr, Ti, Mo, W

Получение из сульфидов.
Получение происходит по схеме:
сульфиды оксиды металлы

а) 2ZnS + 3O 2 t 2ZnO + 2SO 2
б) ZnO + C t Zn + CO

Ученые, занимающиеся получением металлов .
Николай Николаевич Бекетов
Русский химик, физик.
Способствовал развитию физической химии как самостоятельной области науки.
Открыл химический процесс вытеснения металлов из растворов их солей под действием других металлов и водорода.

Гидрометаллургия.
получение металлов из растворов их солей.
Получение происходит по схеме:
Руда раствор соли металл
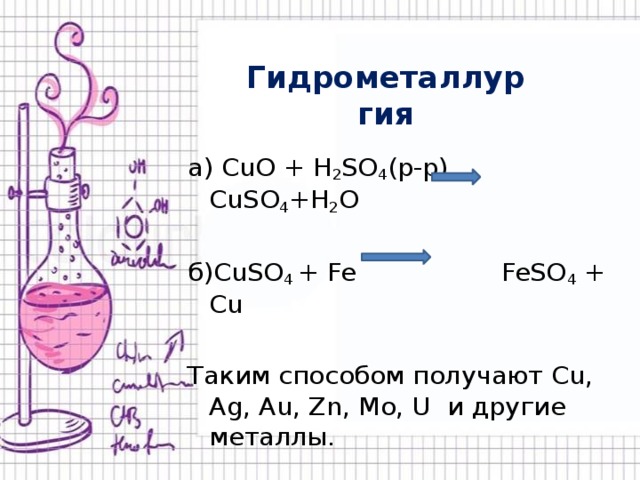
Гидрометаллургия
а) CuO + H 2 SO 4 (р-р) CuSO 4 +H 2 O
б)CuSO 4 + Fe FeSO 4 + Cu
Таким способом получают Cu, Ag, Au, Zn, Mo, U и другие металлы.

Электрометаллургия
Электрометаллургия – получение металлов с помощью электрического тока (электролиз).
2Na + Cl - Na 0 + Cl 2 0
Таким способом получают только самые активные металлы.
Ученые, занимающиеся получением металлов.
Английский химик и физик. Один из основателей электрохимии. Путем электролиза солей и щелочей получил калий, натрий, барий, кальций, амальгаму (раствор металла в ртути) стронция и магния.

Составьте уравнения реакций восстановления железа из его оксидов

Fe 2 O 3 + 2Al Al 2 O 3 + 2Fe
Fe 2 O 3 + 3H 2 3 H 2 O + 2Fe
Fe 2 O 3 +3CO 3CO 2 + 2Fe

Задание 1: Железнодорожные рельсы могут быть отремонтированы с помощью метода алюминотермии, при этом происходит следующая реакция:
Оксид железа (III) + алюминий = железо + оксид алюминия
Запишите уравнение реакции.

Задание 2: Заполните пропуски в уравнениях реакций:

Задание на дом
В начале века из Нью-Йоркского порта вышла в открытый океан красавица яхта. Ее владелец, американский миллионер, не пожалел денег. Корпус яхты был сделан из очень дорогого металла алюминия, листы которого скреплялись медными заклепками. Было очень красиво. Однако через несколько дней обшивка корпуса начала расходиться и яхта пошла ко дну. Почему?
Читайте также:
