Соли их состав и названия взаимодействие с металлами кислотами щелочами друг с другом с учетом
Обновлено: 04.10.2024
Соли- сложные вещества, состоящие из атома металла, или иона аммония NH + 4 и кислотного остатка (иногда содержат водород).
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла
Соли - твердые кристаллические вещества. Многие вещества имеют высокие температуры плавления и кипения. По растворимости делятся на растворимые и нерастворимые.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли– все атомы водорода в кислоте замещены металлом: Na2CO3, KNO3 и т.д.
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 ит. д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO3, KAl(SO4)2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д.
КЛАССИФИКАЦИЯ СОЛЕЙ
Химические свойства
1. B водных растворах соли могут реагировать со щелочами.
(хлористый магний MgCl2 взаимодействует с едким натром, образуя новую соль и новое основание:2. Соли могут реагировать с кислотами. Так, раствор азотнокислого бария
взаимодействует с раствором серной кислоты, образуя новую кислоту и
новую соль:З. В водных растворах соли могут реагировать между собой.
Если слить вместе водные растворы хлористого кальция CaCl2 и углекислого натрия Na2CO3, TO образуется белый осадок нерастворимого в воде углекислого кальция СаСО3, а в растворе — хлористый натрий:4. В водных растворах солей металл, входящий в их состав, может замещаться другим металлом, стоящим до него в ряду активности.
Если в раствор сернокислой меди опустить чистую железную проволоку или кусочек цинка, то на их поверхности выделяется медь, а в растворе образуется сернокислое железо (если было опущено железо) или сернокислый цинк (если был опущен цинк):
Запомнить.
1. Соли реагируют
со щелочами (если выпадает осадок или выделяется газ аммиак)
с кислотами, более сильными, чем та, которой образована соль
с другими растворимыми солями (если выпадает осадок)
с металлами (более активные вытесняют менее активные)
с галогенами (более активные галогены вытесняют менее активные и серу)
2. Нитраты разлагаются с выделением кислорода:
если металл стоит до Mg, образуется нитрит + кислород
если металл от Mg до Cu, образуется оксид металла + NO2 + O2
если металл стоит после Cu, образуется металл + NO2 + O2
нитрат аммония разлагается на N2O и H2O
3. Карбонаты щелочныхметаллов не разлагаютсяпри нагревании
4. Карбонаты металлов II группы разлагаются на оксид металла и углекислый газ
Билет 11. Соляная кислота (Хлоридна кислота). Хлориды. Химические свойства.
Соли их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учётом особенностей реакций окисления-восстановления и ионного обмена.
Соли – это сложные кристаллические вещества, в состав которых входят катионы металлов и анионы кислотных остатков (Исключение NH4Cl).
Названия солей смотрите в лекции основные классы неорганических соединений!
При растворении в воде или при расплавлении соли диссоциируют в зависимости от того, какими ионами они образованы (например, NaCl→Na + + Cl -
Классификация и номенклатура солей (приложение 4).
1)Взаимодействуют с металлами. Если металл, входящий в состав соли стоит правее металла простого вещества в электрохимическом ряду напряжения металлов, то реакция возможна.
протекание реакций взаимодействия солей с металлами определяется восстановительными свойствами простого вещества металла и окислительными свойствами катиона металла. Происходит следующая передача электронов.
а) Fe 0 +Cu 2+ =Fe 2+ +Cu 0 б) Cu 0 +2Ag + =Cu 2+ + 2Ag 0
2) Взаимодействуют с кислотами и щелочами (ионный обмен), образуя газ и осадок.
2Na + +S 2- +2Н + +2Cl - →2Na + +2Cl - +H2S↑
3)Взаимодействие солей друг с другом, образовавшаяся соль должна быть нерастворимой.
2Ag + +2NO 3- +Ca 2+ +2Cl - →2AgCl↓+Ca 2- +NO3 -
2Ag + +2Cl - →2AgCl↓
4) Под действием высоких температур соли разлагаются CaCO3→CaO+CO2↑
Гидролиз солей.
- Определение процесса гидролиза.
- Типы гидролиза.
Взаимодействие с водой, в результате которого образуется кислота (или кислая соль), и основание (или основная соль), называют гидролизом солей.
Различают несколько типов гидролиза солей:
- Соли сильного основания и сильной кислоты (например, KBr, NaNO3) при растворении в воде не гидролизуются, и раствор соли имеет нейтральную среду.
- Соли сильного основания и слабой кислоты, например Na2CO3, CH3COONa, K2S, NaCN, K2SiO3.
Запишем уравнение реакции гидролиза ацетата натрия:
СН3СОО - + H2O ↔2OH - + СН3СООН
Таким образом, раствор ацетата натрия проявляет щелочную реакцию.
При гидролизе солей многоосновных кислот гидролиз протекает ступенчато.
- Соли слабого основания и сильной кислоты, например, Al2(SO4)3, FeCl2, CuBr2, NH4Cl.
Рассмотрим гидролиз хлорида железа (II). Гидролиз идёт ступенчато, суммарно мы получим.
Fe 2+ + 2Cl - + H2O ↔ FeCl2↓+ 2H + + 2Cl -
Fe 2+ + H2O ↔ FeCl2↓+ 2H +
Реакция среды при данном гидролизе будет кислая.
- Соли слабого основания и слабой кислоты при растворении в воде образуют малодиссоциирующие кислоты и соли. Реакция среды в растворах подобных солей зависит от относительной силы кислоты и основания. Другими словами, водные растворы таких солей могут иметь нейтральную, кислую и щелочную среду в зависимости от константы диссоциации образующихся кислот и солей.
Электролиз солей.
- Определение электролиза?
- Растворимые и нерастворимые аноды.
- Продукты электролиза солей.
- Практическое значение электролиза.
Электролиз – это окислительно-восстановительная реакция, протекающая под действием электрического тока. При этом отрицательный электрод – катод выступает в качестве восстановителя, он отдаёт электроны. Положительный электрод – анод, наоборот, представляет собой окислитель, он забирает электроны. Так, если в расплав или раствор хлорида натрия NaCl=Na + +Cl - поместить электроды и пропустить электрический ток, то на катоде выделится натрий Na + +е - = Na, а на аноде – хлор 2Cl - -2 е - = Cl2.
Для процесса электролиза важно, из какого материала изготовлен анод. Различают растворимые и нерастворимые аноды. Нерастворимый анод не меняется в процессе электролиза, он может быть изготовлен из графита, платины, растворимый анод расходуется. Примером растворимого анода может служить медный, цинковый, железный. Если анод растворим, то на нём образуются ионы металла, из которого он изготовлен. В результате масса анода уменьшается. Например, если анод медный, то происходит следующий процесс: Cu-2 е - = Cu 2+ . Таким образом, анод окисляет сам себя. Медь в виде ионов уходит в раствор или расплав.
Чтобы показать продукты электролиза, можно привести пример электролиза расплава солей, хлорида калия:
на катоде: К + +е - →К 0 ;
на аноде: 2Cl — e - →Cl2 0
суммарное уравнение электролиза:
Практическое значение электролиза.
В промышленности получают хлор и гидроксид натрия, алюминий и щелочные металлы. С его помощью очищают медь, никель и др. металлы (рафинирование).
Степень окисления, правила расчёта, постоянные степени окисления.
- Определение степени окисления.
- Правила определения.
- Постоянные степени окисления.
- Пример расчёта степени окисления.
Степень окисления - это условный заряд атома в молекуле, вычисленный из предположения, что все связи имеют ионный характер. Это означает, что более отрицательный атом, смещая к себе полностью электронную пару, приобретает заряд -1. Неполярная ковалентная связь не даёт вклада в степень окисления.
Правила определения степени окисления:
Степень окисления элементов в простом веществе равна нулю;
Алгебраическая сумма всех степеней окисления элементов атомов в нейтральной молекуле равна нулю, а в сложном ионе заряду иона.
Постоянные степени окисления в соединениях проявляют:
+1 все щелочные металлы (Li, Na, K, Rb, Cs), почти всегда серебро;
+2 все элементы второй группы, кроме ртути (Hg);
-1 фтор и хлор (за исключением его соединений с кислородом и фтором)
-2 кислород (за исключением фторидов F2O, в которых степень окисления его положительна, и пероксидов Н2О2, в которых равна -1) ;
степень окисления водорода равна +1 в соединениях с неметаллами и -1 в соединениях с металлами (КН., СаН2)
Например: N2 0 – простое вещество.
N +4 O2 -2 – высчитываем алгебраическую сумму всех степеней 4+(-2∙ 2)=0
H + N +5 O3 -2 - высчитываем алгебраическую сумму всех степеней 1+5+(-2∙ 3)=0
Степень окисления ионов рассчитывается с учётом, что алгебраическая сумма должна равняться заряду иона.
(N +5 O3 -2 ) - - высчитываем алгебраическую сумму всех степеней 5+(-2∙ 3)=-1
Ca +2 (N +5 O3 -2 )2 -1 - высчитываем алгебраическую сумму всех степеней
1. Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена.
Соли – электролиты, при диссоциации которых образуются катионы металлов (или NH4 + ) и анионы кислотных остатков.
Химические свойства солей:
1.Взаимодействие солей с металлами (более активный металл - стоящий в ряду напряжений металлов левее - вытесняет менее активный металл из раствора его соли):
Fe + CuSO4 FeSO4 + Cu Fe + Cu 2+ +SO4 2- Fe 2+ +SO4 2- + Cu Fe + Cu 2+ Fe 2+ + Cu
2. Взаимодействие солей с щелочами (реакция возможна, если исходные вещества растворимы, а в результате выпадает осадок):
3.Взаимодействие солей с солями (реакция возможна, если исходные вещества растворимы, а в результате выпадает осадок):
NaCl +AgNO3 AgCl + NaNO3 Na + + Cl - + Ag + + NO3 - AgCl + Na + +NO3 - Ag + + Cl - AgCl
4. Взаимодействие солей с кислотами (реакция возможна, если в результате реакции образуется осадок, газ, слабый электролит)
HCl +AgNO3 AgCl + HNO3 H + + Cl - + Ag + + NO3 - AgCl + H + +NO3 - Ag + + Cl - AgCl
2Na + +CO3 2- +2H + + 2Cl - → 2Na + + 2Cl - + CO2↑+ H2O
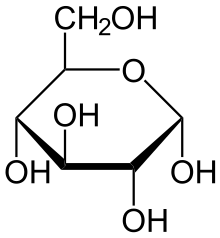
Глюкоза - представитель моносахаридов, строение, физические и химические свойства, применние.
Глюкоза С6Н12О6 – моносахарид, не гидролизующийся с образованием более простых углеводов.
Как видно из структурной формулы, глюкоза является одновременно многоатомным спиртом и альдегидом, то есть альдегидоспиртом. В водных растворах глюкоза может принимать циклическую форму.
Физические свойства
Глюкоза – бесцветное кристаллическое вещество со сладким вкусом, хорошо растворимое в воде. По сравнению со свекловичным сахаром менее сладкая.
Химические свойства
Глюкоза обладает химическими свойствами, характерными для спиртов и альдегидов. Кроме того, она обладает и некоторыми специфическими свойствами.
1. Глюкоза – многоатомный спирт.
Глюкоза с Cu(OH)2 даёт раствор синего цвета (глюконат меди)
2. Глюкоза – альдегид.
а) Реагирует с аммиачным раствором оксидом серебра с образованием серебряного зеркала:
б) С гидроксидом меди даёт красный осадок Cu2O
в) Восстанавливается водородом с образованием шестиатомного спирта (сорбита)
3. Брожение
а) Спиртовое брожение (для получения спиртных напитков)
б) Молочнокислое брожение (скисание молока, квашение овощей)
Применение, значение
Глюкоза образуется в растениях в процессе фотосинтеза. Животные получают её с пищей. Глюкоза – главный источник энергии в живых организмах. Глюкоза является ценным питательным продуктом. Применяется в кондитерском деле, в медицине как укрепляющее средство, для получения спирта, витамина С и др.
Билет №16
Основания, их классификация и свойства на основе представлений об электролитической диссоциации.
Основания -- вещества, диссоциирующие в водном растворе с образованием катионов металла и гидроксид-анионов ОН − .
Существует также основание, в котором гидрокси-группа присоединена не к металлу, а к иону NH4 + (катиону аммония). Это основание называется гидроксидом аммония и имеет формулу NH4OH. Гидроксид аммония образуется в рекции присоединения воды к аммиаку, когда аммиак растворяют в воде:
Основания бывают растворимыми и нерастворимыми. Растворимые основания называются щелочами. Растворы щелочей скользкие на ощупь ("мыльные") и довольно едкие. Они разъедают кожу, ткани, бумагу, очень опасны (как и кислоты) при попадании в глаза. Поэтому при работе со щелочами и кислотами необходимо пользоваться защитными очками.
Лишь небольшую часть всех оснований называют щелочами. Это, например, KOH – гидроксид калия (едкое кали), NaOH – гидроксид натрия (едкий натр), LiOH – гидроксид лития, Ca(OH)2 – гидроксид кальция (его раствор называется известковой водой), Ba(OH)2 – гидроксид бария. Большинство других оснований в воде нерастворимы и щелочами их не называют.
Щелочами называются растворимые в воде сильные основания.
Свойства, характерные для всех оснований, проявляются благодаря присутствию в их растворах гидроксид- ионов OH -. .
Наиболее важное химическое свойство всех оснований – взаимодействие с кислотами – реакция нейтрализации.
NaOH + HCl = NaCl + H2O
Na + + OH - + H + + Cl - = Na + + Cl - + H2O
Взаимодействие щелочей с кислотными оксидами.
Взаимодействие щелочей с солями, если в результате реакции одно из веществ выпадает в осадок.
3Na + + 3OH - + Fe 3+ + 3Cl - = Fe(OH)3↓ + 3Na + + 3Cl -
Глюкоза – представитель моносахаридов, химическое строение, физические и химические свойства, применение.
Глюко́за (C6H12O6), или виноградный сахар, или декстроза встречается в соке многих фруктов и ягод, в том числе и винограда, отчего и произошло название этого вида сахара.
Бесцветное кристаллическое вещество сладкого вкуса, растворимое в воде и органических растворителях, растворимо в реактиве Швейцера: аммиачном растворе гидроксида меди — Cu(NH3)4(OH)2, в концентрированном растворе хлорида цинка и концентрированном растворе серной кислоты.
Глюкоза может существовать в виде циклов (α и β глюкозы).
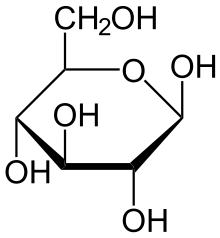
Химические свойства альдегидной формы глюкозы:
Глюкоза – это вещество с двойственной химической природой;
Как альдегид она окисляется. Окислительное действие аммиачного раствора оксида серебра (I) на глюкозу можно записать следующим образом:
Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учётом особенностей реакции окисления – восстановления и ионного обмена.
Соли – это сложные кристалические вещества, в состав которых входят катионы металлов и анионы кислотных остатков. Исключением являются соли амонияNH4Cl. Состав солей определяет их название. Сначало называют кислотный остаток, а затем металл который входит в состав соли NaCl – хлорид натрия MgSO4 – сульфат магния и т.д.
Расплавы и растворы солей диссоциируют на ионы Na2SO4
Na2SO4 = 2Na + SO4
В водных растворах соли реагируют с кислотами с образованием соли и кислоты.
Ba 2+ + 2Cl - + 2H + + SO4 2- = BaSO4 + 2H + + 2Cl -
Ba 2+ + SO4 2- = BaSO4
В водных растворах соли реагируют со щелочами с образованием соли и основания, если хотя бы один из продукции нерастворим.
2Na + + CO3 2- + Ca 2+ + 2OH - = CaCO3 + 2Na + + 2OH -
CO3 2- + Ca 2+ = CaCO3
В водных растворах соли реагируют между собой с образованием двух солей.
Pb 2+ + 3NO3 - + 2K+SO4 2- = PbSO4 + 2K + + 2NO3 -
Pb 2+ +SO4 2- = PbSO4
В водных растворах солей метал, входящий в их состав может замещаться другими, более активными металлами.
Fe + CuCl2 = Cu + FeCl2
Fe 0 + Cu 2+ + 2Cl - = Cu 0 + Fe 2+ + 2Cl -
Fe 0 + Cu 2+ = Cu 0 + Fe 2+
Средние соли, их состав, названия, химические свойства (взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена).
Соли — электролиты, в растворах которых есть катионы металлов или ион аммония и анионы кислотных остатков.
1.B водных растворах соли могут реагировать со щелочами. Так, хлористый магний MgCl2 взаимодействует с едким натром, образуя новую соль и новое основание:
2. Соли могут реагировать с кислотами. Так, раствор азотнокислого бария Ва(гЮз)а взаимодействует с раствором серной кислоты, образуя новую кислоту и новую соль:
З.В водных растворах соли могут реагировать между собой.
Если слить вместе водные растворы хлористого кальция CaCl2 я углекислого натрия Na2CO3TO тотчас же образуется белый осадок нерастворимого в воде углекислого кальция СаСО3, а в растворе — хлористый натрий:
Но из сернокислого цинка нельзя вытеснить цинк медью: медь в ряду активности стоит после цинка.
ВОПРОС №42
Химическая и электрохимическая коррозия металлов. Меры защиты металлов и сплавов от коррозии
Коррозия – это разрушение металлов и сплавов под действием окружающей среды. Различают два вида коррозии – химическую и электрохимическую..
1. Химическая коррозия – это разрушение металла окислителями, находящимися в окружающей среде, в отсутствии электролита. Такая коррозия протекает без возникновения электрического тока в системе.
Химическая коррозия может быть газовой и жидкостной. Газовая коррозия возникает при воздействии на металл агрессивных газов – кислорода, галогенов, оксида серы (IV) и т.д. в условиях высоких температур.
2Cu + O2 = 2CuO (t 0 C)
Жидкостная коррозия протекает в среде жидких неэлектролитов: нефти, бензина, керосина и т.д.
Если образующийся на поверхности металла оксид ложится рыхлым слоем
(как у железа или меди), то коррозия продолжается до полного разрушения металла, так как кислород может диффундировать сквозь постепенно утолщающуюся оксидную пленку.
Однако некоторые металлы образуют на своей поверхности оксид в виде очень плотной пленки, предохраняющей металл от дальнейшей коррозии, т.е.
оксидная пленка пассивирует металл. Такие пленки всегда существует на поверхности алюминия, хрома, цинка, никеля и некоторых других металлов. В
этом случае коррозия быстро прекращается и не приносит большого вреда. Например, оксидная пленка алюминия образуется в результате реакции:
2. Электрохимическая коррозия приносит гораздо больший вред. Это разрушение металла при контакте его с электролитами и возникновением в системе электрического тока.
В этом случае наряду с химическим процессом (отдача электролитов) протекает и электрический (процесс переноса электронов от одного участка к другому).
Если коррозия происходит в кислой среде, то металл окисляется катионами водорода.
Например: Fe + 2HCl = FeCl2 + H2↑
Таким образом, продукт коррозии железа – бурая ржавчина содержит гидроксид железа (III).
Электрохимическая коррозия может быть усилена, если металл содержит примеси других веществ (металлов и даже неметаллов). Например, железо загрязнено примесями меди. При этом возникает гальванический микроэлемент, который действует следующим образом: железо как более активный металл отдает электроны атому меди (Fe 0 – 2e → Fe 2+ ). Эти электроны принимаются катионами водорода и выделяются в виде пузырьков (2H + + 2e → H2↑). Образовавшиеся катионы железа Fe 2+ переходят в раствор электролита (в нашем случае – кислота) и соединяются с анионами кислотного остатка. Таким образом, направленный поток электронов все время движется от более активного металла к менее активному, а катионы более активного металла переходят в среду электролита, т.е. возникает электрический ток (направленное движение заряженных частиц), в результате чего более активный металл разрушается, а менее активный не изменяется, он служит лишь проводником электронов.
Для предохранения металлов от коррозии существуют различные способы:
1. Чтобы изолировать металл от окружающей среды, его покрывают защитными покрытиями. Это могут быть как металлические, так и неметаллические покрытия. К неметаллическим покрытиям относятся лаки, краски, смазки, эмали. К металлическим – покрытия более активным металлом (например, оцинкованное железо) или менее активным металлом (хромированные и никелированные стальные изделия). Во всех этих случаях покрытие имеет пассивирующую оксидную пленку. В случае нарушения менее активного покрытия, начинает постепенно корродировать защищаемый металл (например, железо) и тогда надо сразу же возобновлять покрытие.
2. Чтобы сделать металл более устойчивым к коррозии, промышленность выпускает сталь, содержащую до 12% хрома, который создает пассивирующую пленку на поверхности стали. Такая сталь называется нержавеющей. Существуют и другие сплавы с антикоррозионными свойствами.
3. Протекторная защита металла состоит в том, что к поверхности защищаемого металла (например, подводная часть судна) прикрепляют кусок более активного металла (например, цинка) и тогда разрушается протектор (Zn), а не защищаемый металл. По мере разрушения протектора, его заменяют новым.
4. Для замедления коррозии металлических изделий можно также изменить состав среды (электролита) путем введения специальных веществ (чаще всего органических), которые замедляют коррозию. Такие вещества называются ингибиторами. Их обычно используют, когда металл следует защитить от разъедания кислотами, например, при перевозке соляной кислоты в стальной таре.
ВОПРОС №43
Дисперсные системы. Коллоидные растворы
1. Дисперсные системы. Все дисперсные системы состоят из сплошной фазы, называемой дисперсионной средой, и прерывистой фазы (частиц), называемой дисперсной фазой.
От линейных размеров частиц дисперсной фазы зависит гомогенность или гетерогенность дисперсной системы. Гомогенные дисперсные системы называются истинными растворами, или просто растворами. Истинные растворы содержат молекулы или атомы, размеры которых не превышают 5 нм (5˙10 -9 м).
Гетерогенные дисперсные системы подразделяют на грубодисперсные системы, у которых частицы имеют размер 1000 нм и более, и коллоидные системы, размер частиц которых лежит в пределах от 1 до 500 нм.
К грубодисперсным системам относятся суспензии, эмульсии, пены. Суспензии представляют собой системы, состоящие из раздробленного твердого вещества и жидкости, в которой распределена дисперсная фаза. Например, крахмал в холодной воде, шоколад (какао в масле), мутная вода. Примеры концентрированных суспензий – пасты, взвесь глины в воде.
Эмульсии – образуются двумя несмешивающимися жидкостями; обычно одной из фаз является вода. Примеры эмульсий: молоко, майонез, маргарин, бензол в воде.
Пены – грубодисперсные системы, состоящие из ячеек, заполненных газом, и отделенных друг от друга пленками очень малой толщины. К пенам относятся: мыльная пена, мусс, пенопласты.
Характерным признаком грубодисперсных систем является то, что частицы дисперсной фазы видны в обычный микроскоп или даже невооруженным глазом.
Частицы в коллоидных системах уже невозможно различить в обычный микроскоп, так как их размеры меньше длины волны видимого света.
Дисперсные системы с частицами коллоидных размеров называют золями. По характеру дисперсионной среды различают: гидрозоли (растворитель – вода), аэрозоли (мельчайшие капельки жидкости, тонкораспыленные в газе, например, туман), мелкие твердые частицы в газе (дым).
Помимо классификации дисперсных систем по размерам частиц, существует и другая классификация – по агрегатному состоянию дисперсной фазы и дисперсионной среды.
2. Коллоидные растворы. Коллоидные растворы отличаются от истинных рядом свойств: 1) малой скоростью перемещения ввиду малой скорости диффузии; 2) повышенной вязкостью; 3) гетерогенностью.
От грубодисперсных систем они отличаются относительной устойчивостью. Для коллоидов характерна очень развитая поверхность, в связи с чем в коллоидных растворах исключительно важную роль играет адсорбция.
Адсорбция – это изменение (обычно – повышение) концентрации вещества вблизи поверхности раздела фаз.
Существует два основных пути получения коллоидных растворов.
1. Дисперсионный – измельчение частиц грубодисперсных систем до размеров, соответствующих коллоидам. При этом используются обычно физические методы с применением различных диспергаторов и коллоидных мельниц.
2. Конденсационный – укрупнение частиц истинных растворов (ионов, молекул) путем их ассоциации до размеров, соответствующих коллоидам. Применяются обычно химические методы: осаждение, гидролиз, окисления-восстановления, нейтрализации.
Например, в результате гидролиза солей железа (III) получают его гидроксид: Fe 3+ + 3H2O = Fe(OH)3 + 3H + .
Для повышения устойчивости коллоидов в раствор вводят стабилизаторы – поверхностно-активные вещества (ПАВ).
2.1. Строение и заряд коллоидной частицы. Мицелла.Коллоидная частица состоит из ядра, адсорбирующего из окружающей среды ионы одного вида. Эти ионы называют зарядообразующими, их химическая природа близка химической природе ядра коллоидной частицы.
Ядро коллоидной частицы с адсорбированными зарядообразующими ионами притягивает к себе из среды ионы противоположного знака (заряда). Зарядообразующие ионы и противоионы гидратированы. Весь этот комплекс и называют коллоидной частицей.
3. Свойства коллоидных растворов. Оптические свойства коллоидных растворов. При прохождении через дисперсную систему свет может поглощаться, отражаться или рассеиваться частицами. Поглощение света – явление избирательное. Одни вещества полностью поглощают свет, другие поглощают только лучи определенной части спектра. Отражение света поверхностью частиц возможно только в грубодисперсных системах. Отражение света проявляется в мутности таких дисперсных систем как в проходящем свете, так и при боковом их освещении.
Для типичных коллоидных систем наиболее характерным оптическим свойством является рассеивание света по всем направлениям. Размеры коллоидных частиц меньше длины световой волны, и поэтому рассеивание света обусловлено не отражением его от поверхности частиц, а дифракцией. Рассеивание света при освещении коллоидного раствора было исследовано Тиндалем. Это свечение было названо опалесценцией.
Электрические свойства коллоидных растворов. В 1909 г профессор Московского университета Р. Рейсе наблюдал воздействие постоянного электрического тока на диспергированную в воде глину, и на этом основании описал электрические свойства коллоидных растворов.
Движение частиц дисперсной фазы к одному из электродов при пропускании через него постоянного электрического тока получило название электрофореза, а движение частиц дисперсионной среды – электроосмоса.
Электрические свойства коллоидных растворов объясняют их агрегатную устойчивость, которая проявляется в том, что частицы дисперсной фазы в коллоидном растворе не укрупняются и не слипаются.
Коагуляция коллоидных растворов. Коагуляцией называют процесс соединения коллоидных частиц в крупные агрегаты с последующей потерей коллоидной системой кинетической устойчивости.
Коагуляцию коллоидных растворов можно вызвать нагреванием, охлаждением, интенсивным перемешиванием, а также добавлением различных электролитов.
4. Коллоидные растворы в природе и технике. В природной воде содержится часть примесей в коллоидном состоянии. Поэтому воду, используемую для коммунальных нужд, электростанций, строительства, подвергают обработке, вызывающей коагуляцию коллоидных частиц.
Коагуляцию широко используют при очистке воды для удаления взвешенных веществ. В качестве коагулянтов используют сульфаты алюминия или железа.
Дымовые газы электростанций, металлургических заводов представляют собой аэрозоли. Для их коагуляции применяется электрогазоочистка методом электрофореза при очень высоких напряжениях. В коллоидном состоянии находятся многие составные части живых организмов: кровь, лимфа, внутриклеточная жидкость.
Наибольшее практическое применение имеют твердые системы с газовой дисперсной фазой, называемые твердыми пенами.
ВОПРОС №44
Читайте также:
