Термические кривые охлаждения при кристаллизации чистых металлов
Обновлено: 05.07.2024
С увеличением степени переохлаждения расплава возрастает выигрыш в энергии (Δ F), связанный с переходом вещества из жидкого состояния в кристаллическое (на рис. 3.1. ΔF2ΔF1). Эту выделяющуюся при кристаллизации энергию называютскрытой теплотой кристаллизации. Скрытая теплота кристаллизации компенсирует отвод тепла от охлаждаемого жидкого металла пока идёт процесс его затвердевания. В результате температура металла при кристаллизации остается постоянной. Этот факт отражает теоретическая кривая охлаждения чистого металла, содержащая при температуреTSгоризонтальную площадку (рис. 3.2.).
Рис. 3.2. Кривые охлаждения
Т – температура, t– время.
Реальная кривая охлаждения металла выглядит несколько иначе. Она отражает факт переохлаждения расплава и поэтому здесь горизонтальная площадка располагается при температурах ниже TS. Кроме того, на площадке наблюдается выброс вверх, обусловленный бурным выделением скрытой теплоты кристаллизации в начальный момент затвердевания расплава. Выброс тем больше, чем большая масса металла кристаллизуется.
3.3 Механизм процесса кристаллизации
Процесс кристаллизации расплава состоит из двух одновременно протекающих подпроцессов - зарождения и роста кристаллов.
В жидком расплаве всегда случайным образом возникают скопления атомов с упорядоченной кристаллической структурой. В следующий момент времени эти зародыши кристаллов могут раствориться, а могут увеличиться в размерах. Существует некоторый критический размер зародышейrk. Все скопления атомов (т.е. зародыши) меньшего размера в дальнейшем растворяются, а большего - растут, становясь центрами кристаллизации.
И рост зародышей, и их растворение сопровождается понижением свободной энергии системы. Таким образом, наибольшей свободной энергией обладают зародыши критического размера (rk).
Число центров кристаллизации, образующихся в единицу времени, или, по-другому, скорость образования зародышей (С.О.З.), так же как и скорость роста кристаллов (С.Р.К.), зависят от степени переохлаждения расплава. Эту зависимость отражает следующий график:
Рис. 3.3. Зависимость С.Р.К. и С.О.З. от степени переохлаждения расплава.
С.Р.К. – скорость роста кристаллов;
С.О.З. – скорость образования зародышей.
При ΔТ = 0 (т.е. когда Т = ТS) скорость роста кристаллов и скорость образования зародышей равны нулю. Другими словами при температуре ТSпроцесс кристаллизации не идёт.
С увеличением ΔТ скорость роста кристаллов и скорость образования зародышей нарастают, а затем, достигнув максимума, начинают уменьшаться асимптотически до нуля. Нарастание скорости роста кристаллов и скорости образования зародышей связано с тем, что при увеличении степени переохлаждения расплава увеличивается выигрыш в энергии ΔF, обусловленный переходом металла из жидкого состояния в кристаллическое. Выигрыш в энергии расходуется на образование границы раздела между жидкой и твердой фазами. Чем крупнее зародыш, тем меньше отношение его поверхности к объему и поэтому выигрыш в энергии перекрывает затраты на образование границы раздела. Такой зародыш оказывается энергетически выгодным и в дальнейшем будет расти. У очень маленьких зародышей (меньшихrk) отношение поверхности к объему больше. В результате скрытой теплоты кристаллизации ΔFне хватает на образование поверхности раздела. Такой зародыш оказывается энергетически не выгодным и в дальнейшем будет растворен. С увеличением степени переохлаждения расплава и, следовательно, увеличением ΔF, всё более мелкие зародыши оказываются энергетически выгодными. Другими словами с повышением степени переохлаждения расплава растёт число зародышей способных к дальнейшему росту.
Уменьшение скорости роста кристаллов и скорости образования зародышей при дальнейшем увеличении степени переохлаждения расплава связано с уменьшением подвижности атомов при низких температурах.
При очень высоких степенях переохлаждения расплава процесс образования и роста зародышей оказывается подавленным из-за чрезвычайно низкой подвижности атомов. В результате формируется аморфное состояние материала.
При относительно невысоких степенях переохлаждения расплава ΔТ1 С.Р.К. преобладает над С.О.З. (рис. 3.3). Образуется относительно небольшое число зародышей, которые быстро растут, в результате чего формируется крупнозернистая структура металла. При больших степенях переохлаждения ΔТ2 С.О.З. преобладает над С.Р.К. Образуется много зародышей, которые не так быстро растут, в результате чего формируется мелкозернистая структура материала.
Таким образом, с увеличением степени переохлаждения расплава, зёрна затвердевшего металла уменьшаются в размере.
2. Процесс кристаллизации расплавов металлов
Кристаллизация — переход металла (сплава) из жидкого состояния в твердое — происходит в условиях, когда расплав переходит к термодинамически более устойчивому состоянию с меньшей свободной энергией (свободная энергия кристалла меньше свободной энергии жидкой фазы).
Влияние температуры на свободную энергию жидкой (Gж) и твердой фазы (Gт) показано на рис. 1а.
При температуре плавления Тпл жидкая и твердая фазы существуют одновременно. Реальный процесс кристаллизации протекает при переохлаждении металла ниже теоретической температуры кристаллизации Тпл. Величина ∆Т= Тпл - Ткр называется степенью переохлаждения.
Термические кривые, характеризующие процесс кристаллизации чистых металлов при охлаждении с разной скоростью, приведены на рис. 1 б (v— скорость охлаждения, v1 < v2 < v3).
Вначале, когда металл находится в жидком состоянии, температура системы уменьшается плавно. При достижении температуры Тпл на кривой охлаждения появляется горизонтальная площадка, так как отвод теплоты в окружающую среду компенсируется выделяющейся при кристаллизации скрытой теплотой кристаллизации.
По окончании кристаллизации температура вновь уменьшается плавно. При медленном охлаждении (v1) степень переохлаждения мала, и кристаллизация протекает при температуре, близкой к теоретической температуре кристаллизации Тпл. С увеличением скорости охлаждения степень переохлаждения возрастает, и кристаллизация происходит при более низких температурах.
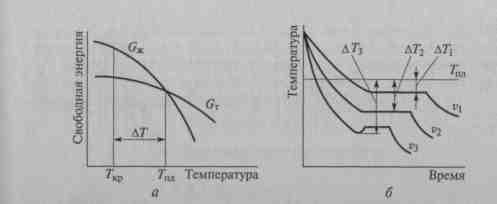
Рисунок 1. Охлаждение расплава и начало кристаллизации
а — изменение свободной энергии (G) в жидком (G Ж) и твердом (G т) состоянии в зависимости от температуры: Ткр — температура начала кристаллизации; Тпл — температура, при которой жидкая и твердая фазы существуют одновременно; ∆T — степень переохлаждения; б — кривые охлаждения металлов при кристаллизации: ∆T1, ∆T2, ∆T3 — степень переохлаждения при скорости охлаждения v1, v2, v3 соответственно.
Чем «чище» жидкий металл, тем выше температура переохлаждения. Процесс кристаллизации начинается с образования кристаллических зародышей (центров кристаллизации) и продолжается в процессе роста их числа и размеров. С повышением степени переохлаждения увеличиваются число зародышей и скорость кристаллизации. Но при дальнейшем повышении степени переохлаждения скорость роста зародышей и скорость кристаллизации уменьшаются.
Рост кристаллов заключается в присоединении к зародышам все новых атомов из жидкой фазы (рис. 2 а). Центры кристаллизации — зародыши (черные квадраты) — самопроизвольно возникают при переохлаждении металла. Очень маленькие зародыши неустойчивы, возникнув, они растворяются. Чем больше степень переохлаждения, тем устойчивее зародыши, тем меньше их критический размер. Далее зародыши увеличиваются в размере, одновременно появляются новые зародыши.
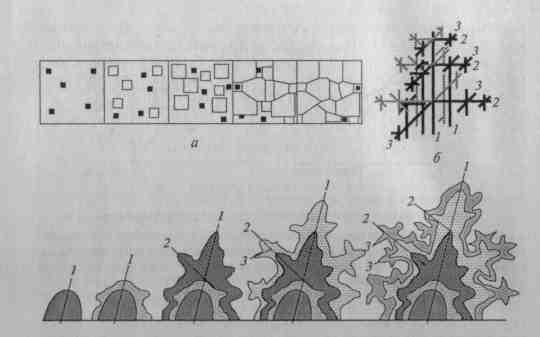
Пока число зародышей невелико, кристаллы растут свободно и сохраняют правильную геометрическую форму. В местах соприкосновения отдельных кристаллов рост их отдельных граней прекращается, развиваются грани в тех местах, где есть свободная жидкость. В результате кристаллы не имеют правильной геометрической формы. Такие кристаллы называются кристаллитами. Чем больше центров кристаллизации, тем больше образуется кристаллов в данном объеме, тем мельче окончательный размер кристаллов. Однако уменьшение скорости зарождения числа зародышей при критических температурах ограничивает возможность регулирования их размера повышением скорости охлаждения. Рис. 2. Схема кристаллизации металла
С целью регулирования размеров зерен часто применяют искусственное введение в расплав веществ, создающих центры кристаллизации (модифицирование). В технических металлах в качестве центров кристаллизации часто выступают инородные включения (например, шлаковые включения, частички футеровки печи, оксиды металлов).
а — схема роста кристаллов; б — структура дендрита; в — схема образования дендрита; ■ — зародыши; 1, 2, 3 — оси кристаллизации.
В большинстве случаев кристаллизация металлов происходит с большой скоростью (кристаллизация при заливке металла в изложницу, кристаллизация расплава при литье в металлические формы). При ускоренном охлаждении металла кристаллы растут неравномерно. Рост зародышей по одной из осей (в направлении наибольшего градиента температур) значительно опережает рост по другим осям, происходит так называемая дендритная кристаллизация.
Д.К.Чернов, описывая рост дендрита (рис. 2 б), ввел понятие «порядок осей кристаллизации». После образования зародыша его развитие (рис. 2 в) идет в направлении наибольшего градиента температур (ось первого порядка). Увеличение размеров осей первого порядка происходит не только в длину, одновременно увеличивается и ее ширина. В дальнейшем от осей первою порядка под определенными углами начинают расти новые оси, называемые осями второго и третьего порядка.
По мере роста осей более высокого порядка (четвертого, пятого и т.д.) постепенно заполняются все промежутки, ранее занятые жидким металлом, — дендритная кристаллизация замедляется.
Дендритная кристаллизация отчетливо выражена в условиях недостатка жидкого металла для заполнения пространства (поверхностные слои, усадочная раковина) и при наличии примесей и посторонних атомов в расплаве (кристаллизация реальных сплавов).
9.Термические кривые охлаждения и кристаллизации
Процесс кристаллизации металла можно рассматривать по кривым охлаждения, которые обычно получают опытным путем. Например, для чистого металла, охлаждаемого очень медленно, кривая охлаждения показывает, что, если металл находится в жидком состоянии, температура понижается почти равномерно. Если металл охладить до температуры плавления Тпл (точка а на кривой), то начинается кристаллизация и падение температуры прекращается, несмотря на непрерывную отдачу тепла окружающей атмосфере. Получаемый горизонтальный участок на кривой охлаждения показывает, что в металле происходит процесс образования кристаллов с выделением тепла, называемый теплотой кристаллизации. Кристаллизация протекает от точки а до точки б, где она заканчивается и металл затвердевает. Дальнейшее падение температуры на кривой указывает на охлаждение затвердевшего слитка (рис. А).

10.Понятие о температуре ликвидус и солидус
Температура ликвидуса - это максимальная температура насыщения первичной твёрдой фазой расплава данного валового состава. Выше этой температуры система полностью жидкая. Иными словами, это температура, при которой в равновесных условиях выпадает первый кристалл. Хотя при понижении температуры будет выпадать всё больше кристаллов, возможно получение однородного вещества путём достаточно быстрого охлаждения, т. е. с помощью кинетического ингибирования процесса кристаллизации.
В системе переменного состава ликвидус является геометрическим местом точек в координатах Температура-Состав, отвечающим максимальному насыщению твёрдой фазой расплавленной фазы.
В стекольной промышленности точка ликвидуса важна, потому что кристаллизация может привести к порче продукта во время плавления и формирования стекла.
Солидус (лат. solidus «твёрдый») — линия на фазовых диаграммах, на которой исчезают последние капли расплава, или температура, при которой плавится самый легкоплавкий компонент. Линия, ниже которой находится только твердая фаза. Противоположность ликвидусу
Проще говоря - Ликвидус-жидкое, когда твердое превращается в жидкое (плавится) Солидус-твердое, когда жидкое превращается в твердое
11. Величина зерна
12. Основы теории сплавов
Система – группа тел выделяемых для наблюдения и изучения. В металловедении системами являются металлы и металлические сплавы. Чистый металл является простой однокомпонентной системой, сплав – сложной системой, состоящей из двух и более компонентов.
Компоненты – вещества, образующие систему. В качестве компонентов выступают чистые вещества и химические соединения, если они не диссоциируют на составные части в исследуемом интервале температур.
Фаза – однородная часть системы, отделенная от других частей системы поверхностного раздела, при переходе через которую структура и свойства резко меняются.
Вариантность (C) (число степеней свободы) – это число внутренних и внешних факторов (температура, давление, концентрация), которые можно изменять без изменения количества фаз в системе.
13. Диаграмма состояния системы железо-углерод: компоненты, фазы и структурные составляющие в сплавах железа с углеродом

Диаграмма фазового равновесия (диаграмма состояния) железо-углерод — графическое отображение фазового состояния сплавов железа с углеродом в зависимости от их химического состава и температуры.
Компоненты
Железо — металл переходной группы серебристо-серого цвета, очень пластичный, с удельным весом 7,86 г/см 3 , температурой плавления 1539° С. Чистейшее железо содержит примесей до 0,01%. На практике применяется техническое железо, содержащее 0,1% примесей таких, как С, Mn, Si, S, Р, О2, Н2, N2 и др.
Углерод— относится к неметаллам, удельный вес 2,5 г/см 3 , атомный радиус 0,77 А; температура плавления 3500° С. Углерод имеет три аллотропические модификации: алмаза, графита и угля.
Цементит (Fe3C)– химическое соединение железа с углеродом (карбид железа), содержит 6,67 % углерода.
В системе железо-углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит, графит.
Жидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы.
Феррит — Твёрдый раствор внедрения углерода в α-железе с ОЦК (объёмно-центрированной кубической) решёткой.
Аустенит (γ) — твёрдый раствор внедрения углерода в γ-железе с ГЦК (гране-центрированной кубической) решёткой.
Цементит (Fe3C) — химическое соединение железа с углеродом (карбид железа), со сложной ромбической решёткой, содержит 6,67 % углерода.
Графит — фаза состоящая только из углерода со слоистой гексагональной решёткой.
Помимо четырех вышеназванных фаз в струтуре сплавов железа с углеродом выделяют еще две самостоятельные структурные составляющие: перлит и ледебурит.
Перлит (П) – механическая смесь феррита и цементита, содержащая 0,8% углерода. Перлит образуется из аустенита при охлаждении его до температуры ниже 727 °С.
Ледебурит (Л) – механическая смесь аустенита и цементита (Л = А+ Ц), содержащая 4,3% углерода.Ледебурит образуется из жидкого расплава при температуре 1147 °С.
Помимо перечисленных структурных составляющих, в железоуглеродистых сплавах могут быть нежелательные неметаллические включения: окислы, нитриды, сульфиды, фосфиды – соединения с кислородом, азотом, серой и фосфором.
Затвердевание металлических материалов. Термические кривые охлаждения при кристаллизации металлов.
Кристаллизацией называется переход из жидкого в твердое состояние с образованием кристаллических решеток или кристаллов. В реальных металлических телах кристаллизация расплавов заканчивается образованием структуры сложно переплетенных кристаллов -дендритов. Их морфология определяет свойства материалов. При образовании кристаллов их развитие идет в основном в направлении, перпендикулярном плоскостям с максимальной плотностью упаковки атомов. Это приводит к тому, что первоначально образуются длинные ветви, так называемые оси первого порядка. Одновременно с удлинением осей первого порядка на их ребрах зарождаются и растут перпендикулярные к ним такие же ветви второго порядка. в свою очередь на них растут оси третьего порядка и т.д. Образуются кристаллы древовидной -дендритной формы. Преимущественный рост кристалла происходит в направлении отвода тепла. Ветви дендритов разделены очень тонкими прослойками нерастворимых в жидком и особенно в твердом состоянии примесей и мельчайшими полостями и порами, возникшими в результате уменьшения объема при переходе металла из жидкого состояния в твердое. При tпл, определенной для каждого металла, твердый металл переходит в жидкий. Многие свойства при этом меняются незначительно. Например, плотность падает на 5-7% , электропроводность и теплопроводность возрастают. Характер внутренних сил не изменяется. Металлическая жидкость по своему строению близка к твердому телу. Кристаллическая решетка сохраняется до температуры плавления. После расплавления решетка разрушается, но сохраняется динамический ближний порядок. Затвердевание происходит при температуре tзатв, она меньше tпл. Существует переохлаждение и перенагрев рис. 6.

Рис. 6. Рис. 7. Рис. 8.
Рис. 6. Изменение свободной энергии F металла в жидком (F ж) и твердом состоянии (F т) в зависимости от температуры T.
Рис. 7. Кривые охлаждения полученные при кристаллизации металла.
Рис. 8. Зависимость скорости образования центров n и скорости роста кристаллов С от переохлаждения.
При температуре Тп величины свободных энергий жидкого и твердого состояния равны. Процесс кристаллизации протекает при температуре, меньшей Тп. Для начала затвердевания необходимо переохлаждение (разность энергий). Переохлаждение тем больше, чем больше скорость изменения температуры рис. 7.. В 1878 году русский ученый - металлург Д.К. Чернов установил, что процесс кристаллизации состоит из двух элементарных процессов: зарождения центров (скорость - n в сек -1* см-3) и роста кристаллов (скорость С в см*сек - 1). Установлено, что n и С зависят от переохлаждения рис. 8. Это определяет размер зерен : 3/4
N = a * (C / n) (3)
N - размер зерна ; коэффициент “а” приблизительно равен 1.
Практически кривые n и С располагаются друг относительно друга таким образом, что, чем больше переохлаждение, тем мельче получаются кристаллы, или чем больше скорость охлаждения, тем мельче кристаллы. Ниспадающие ветви кривых экспериментально не наблюдаются, поэтому проведены пунктирными линиями. Критический размер зародыша первичного кристалла находится из выражения:
Rk = (4*a) /AfD (4)
где а - поверхностное натяжение; A fО -разность объемных свободных энергий жидкого и твердого металлов.
ПРИМЕЧАНИЕ: Ф.4. справедлива для небольших значений AT
На образование зародыша требуется энергия, равная одной трети его поверхностной энергии.
Уменьшение объемной свободной энергии при переходе атомов в кристаллическое тело
недостаточно для образования зародыша. Образованию зародыша способствует неравномерное
распределение энергии между атомами - флюктуации.
При температуре близкой к Тпл , размер критического зародыша должен быть очень велик и
вероятность его образования мала. С увеличением степени переохлаждения Afu возрастает (см.
рис. 6), а поверхностное натяжение на границе раздела фаз изменяется не значительно. Чем
больше AT, тем меньше Rk,тоже самое для G.При небольшой степени переохлаждения
(малой скорости охлаждения) число зародышей мало. В этих условиях будет получено крупное
зерно. С увеличением степени переохлаждения скорость образования зародышей возрастает и
размер зерна в затвердевшем металле уменьшается.
Размер зерна влияет на свойства, особенно на вязкость, которая значительно выше у металлов с
Применение правила фаз.
Металлические материалы применяемые в технике в большинстве случаев являются сплавами. Сплавом называют вещество, полученное сплавлением нескольких (двух и более) элементов, преимущественно металлических. Строение сплавов более сложно, чем строение чистого металла. В сплаве могут наблюдаться зерна чистых металлов и других компонентов, твердых растворов и химических соединений. Твердыми растворами называют сплав, у которого ионы растворенного элемента расположены в кристаллической решетке растворителя. Твердые растворы разделяются на три типа: замещения, внедрения и вычитания, или твердые растворы на базе химических соединений. Существуют также упорядоченные твердые растворы.
Совокупность всех сплавов, которые могут быть составлены из заданных компонентов, называют системой сплавов.
Фазой называется однородная часть системы, имеющая одинаковый состав, одно и то же агрегатное состояние и отделяющееся от остальных частей системы поверхностями раздела. Фазы могут быть газообразными, жидкими и твердыми. В сплаве могут присутствовать несколько фаз. Вещества, образующие систему, называются компонентами. Число степеней свободы (вариантность) системы это число внешних и внутренних факторов (t, P и концентрация С%), которые можно изменять, не изменяя число фаз в системе. Оно определяется правилом фаз:
f = n - K + 2 (5)
где f- число степеней свободы; n- число компонентов; K- число фаз. Если давление не учитывать: f = n - K + 1
Правило фаз применяется при анализе процессов, совершающихся в сплавах при нагреве и охлаждении для расчета числа фаз в конкретных термодинамических условиях.
_ I Применим правило фаз для четырех точек
**^ ^ ^ однокомпонетного сппава: f = n-k+1
1. f = 1 -1 +1 =1 - это значит, что ситема оноварнантна; мы можем изменить температуру - сплав останется жидким. 2иЗЛ = 1-2 + 1=0- система безвариантна - любое изменение вызовет изменение числа фаз.
Затвердевание металлических материалов. Термические кривые охлаждения при кристаллизации металлов
Тема: ЗАТВЕРДЕВАНИЕ МЕТАЛЛИЧЕСКИХ МАТЕРИАЛОВ. ТЕРМИЧЕСКИЕ КРИВЫЕ ОХЛАЖДЕНИЯ ПРИ КРИСТАЛЛИЗАЦИИ МЕТАЛЛОВ. ПРИМЕНЕНИЕ ПРАВИЛА ФАЗ. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПРОЦЕСС КРИСТАЛЛИЗАЦИИ. МОДИФИЦИРОВАНИЕ ЖИДКОГО МЕТАЛЛА. МАТЕРИАЛЫ АМОРФНОГО СТРОЕНИЯ И ИХ ПРИМЕНЕНИЕ. ПОЛИМОРФНЫЕ ПРЕВРАЩЕНИЯ В МЕТАЛЛАХ. ЖИДКИЕ КРИСТАЛЛЫ
Кристаллизацией называется переход из жидкого в твердое состояние с образованием кристаллических решеток или кристаллов. В реальных металлических телах кристаллизация расплавов заканчивается образованием структуры сложно переплетенных кристаллов - дендритов. Их морфология определяет свойства материалов. При образовании кристаллов их развитие идет в основном в направлении, перпендикулярном плоскостям с максимальной плотностью упаковки атомов. Это приводит к тому, что первоначально образуются длинные ветви, так называемые оси первого порядка. Одновременно с удлинением осей первого порядка на их ребрах зарождаются и растут перпендикулярные к ним такие же ветви второго порядка. в свою очередь на них растут оси третьего порядка и т.д. Образуются кристаллы древовидной - дендритной формы. Преимущественный рост кристалла происходит в направлении отвода тепла. Ветви дендритов разделены очень тонкими прослойками нерастворимых в жидком и особенно в твердом состоянии примесей и мельчайшими полостями и порами, возникшими в результате уменьшения объема при переходе металла из жидкого состояния в твердое. При tпл, определенной для каждого металла, твердый металл переходит в жидкий. Многие свойства при этом меняются незначительно. Например, плотность падает на 5-7% , электропроводность и теплопроводность возрастают. Характер внутренних сил не изменяется. Металлическая жидкость по своему строению близка к твердому телу. Кристаллическая решетка сохраняется до температуры плавления. После расплавления решетка разрушается, но сохраняется динамический ближний порядок. Затвердевание происходит при температуре tзатв, она меньше tпл. Существует переохлаждение и перенагрев рис. 6.
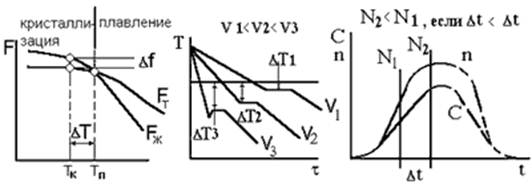
| Рис. 6 Изменение свободной энергии F металла в жидком (F ж) и твердом состоянии (F т) в зависимости от температуры T | Рис. 7 Кривые охлаждения полученные при кристаллизации металла | Рис. 8 Зависимость скорости образования центров n и скорости роста кристаллов С от переохлаждения |
При температуре Тп величины свободных энергий жидкого и твердого состояния равны. Процесс кристаллизации протекает при температуре, меньшей Тп. Для начала затвердевания необходимо переохлаждение (разность энергий). Переохлаждение тем больше, чем больше скорость изменения температуры рис. 7.. В 1878 году русский ученый - металлург Д.К. Чернов установил, что процесс кристаллизации состоит из двух элементарных процессов: зарождения центров (скорость - n в сек -1* см-3) и роста кристаллов (скорость С в см*сек - 1). Установлено, что n и С зависят от переохлаждения рис. 8. Это определяет размер зерен: 3/4
Практически кривые n и С располагаются друг относительно друга таким образом, что, чем больше переохлаждение, тем мельче получаются кристаллы, или чем больше скорость охлаждения, тем мельче кристаллы. Ниспадающие ветви кривых экспериментально не наблюдаются, поэтому проведены пунктирными линиями.
Критический размер зародыша первичного кристалла находится из выражения:
где σ - поверхностное натяжение; Δfv - разность объемных свободных энергий жидкого и твердого металлов.
ПРИМЕЧАНИЕ: Ф.4. справедлива для небольших значений ΔT. На образование зародыша требуется энергия, равная одной трети его поверхностной энергии. Уменьшение объемной свободной энергии при переходе атомов в кристаллическое тело недостаточно для образования зародыша. Образованию зародыша способствует неравномерное распределение энергии между атомами - флюктуации.
При температуре близкой к Тпл , размер критического зародыша должен быть очень велик и вероятность его образования мала. С увеличением степени переохлаждения Δfv возрастает (см. рис. 6), а поверхностное натяжение на границе раздела фаз изменяется не значительно. Чем больше ΔT, тем меньше Rk, тоже самое для σ. При небольшой степени переохлаждения (малой скорости охлаждения) число зародышей мало. В этих условиях будет получено крупное зерно. С увеличением степени переохлаждения скорость образования зародышей возрастает и размер зерна в затвердевшем металле уменьшается.
Размер зерна влияет на свойства, особенно на вязкость, которая значительно выше у металлов с мелким зерном.
Читайте также:
