Тест щелочные металлы 9 класс ответы
Обновлено: 07.05.2024
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
А 1. Щелочные металлы – это:
а) р-элементы б) f-элементы в) s-элементы
А 2. В ряду от лития к францию атомный радиус:
а) увеличивается б) уменьшается в) не изменяется
А 3. При сгорании лития пламя окрашивается в:
а) красный цвет б) желтый цвет в) фиолетовый цвет
А 4. Оксид калия обладает свойствами:
а) основными б) кислотными в) амфотерными
А 5. На внешнем энергетическом уровне атомы щелочных металлов имеют:
а) 1 электрон б) 2 электрона в) 3 электрона
А 6. В реакциях с неметаллами щелочные металлы являются:
а) окислителями б) восстановителями
А 7. Натрий получают способом:
а) пирометаллургическим б) гидрометаллургическим в) электролизом
А 8. При взаимодействии натрия с кислородом образуется:
а) оксид натрия б)гидроксид натрия в) пероксид натрия
А 9. Пищевая сода имеет формулу:
а) Na 2 SO 4 б)Na 2 CO 3 в) NaHCO 3 г) NaCl
а) растворимые основания б) при нагревании разлагаются
в) окрашивают лакмус в синий цвет г) жидкости
А 11. Гидроксид натрия реагирует с каждым из двух веществ:
а) CO 2 , KNO 3 б) Al(OH) 3 , CuCl 2
в) Cu(NO 3 ) 2 , K 2 SO 4 г) CaO, H 2 SO 4
А 12. В уравнении реакции натрия с водой коэффициент перед формулой водорода:
а) 1 б) 2 в) 3 г) 4
В 1. Расположите вещества по увеличению основных свойств:
а) LiOH б) KOH в) NaOH г) RbOH
В 2. Практически возможными являются реакции между:
а) гидроксидом калия и нитратом цинка б) оксидом натрия и гидроксидом бария
в) карбонатом натрия и соляной кислотой г) хлоридом натрия и нитратом серебра
С 1. Рассчитайте массу осадка, который образуется при взаимодействии 20 г 20%-го раствора гидроксида натрия с хлоридом меди (II).
А 1. На внешнем энергетическом уровне щелочные металлы содержат
А 2. В ряду от лития к францию восстановительные свойства:
А 3. При сгорании натрия пламя окрашивается в:
А 4. Оксид натрия обладает свойствами:
А 5. Вид химической связи в молекуле хлорида натрия:
а) ковалентная полярная б) ковалентная неполярная
в) ионная г) металлическая
А 6. Верны ли суждения: 1) Соли щелочных металлов твердые кристаллические вещества ионного строения. 2) Гидроксиды щелочных металлов – твердые белые вещества, очень гигроскопичны.
а) верны оба суждения б) верно только 1 в) верно только 2
А 7. Калий получают способом:
А 8. При взаимодействии калия с кислородом образуется:
а) оксид калия б)гидроксид калия в) пероксид калия
А 9. Кислая соль имеет формулу:
А 10. Для щелочей не характерны реакции:
а) с кислотами б) с основными оксидами
в) с амфотерными гидроксидами г) с кислотными оксидами
А 11. Оксид натрия реагирует с каждым из двух веществ:
в) Cu(NO 3 ) 2 , K 2 SO 4 г) CO 2 , H 2 SO 4
А 12. В уравнении реакции калия с водой коэффициент перед формулой водорода:
а) гидроксидом натрия и нитратом алюминия б) оксидом калия и гидроксидом кальция
в) карбонатом калия и серной кислотой г) оксидом калия и водой
С 1. Рассчитайте объем водорода (н.у.), который может быть получен при растворении 11,5 г натрия, содержащего 2% примесей.
По теме: методические разработки, презентации и конспекты
Конспект урока математики в классе- комплекте по теме: в 6 классе "Применение распределительного свойства умножения" (повторение), в 5-м классе "Упрощение выражений"(изучение нового материала)
Конспект разработан для проведения урока математики в классе- комплекте, где сидят учащиеся 5 и 6 классов.
"Географический КВН для учащихся 6-7 классов", "У нас в гостях Япония"для 9-11 классов, разработка урока "Африка" для 11 класса.
Данные методические разработки можно использовать во время проведения предметной недели географии в 6-11 классах. Разработка урока систематизирует знания учащихся по теме "Африка" в 11 классе.
Урок-игра в 5 классе по курсу « Природоведение, 5 класс» по теме: «Обобщение знаний по курсу «Природоведение, 5 класс»
Урок-игра-одна из современных образовательных технологий.На таких уроках у учащихся расширяется кругозор, развивается познавательная активность, формируются определенные умения и навыки, необходимые в.
Рабочие программы по математике 5 класс, алгебре 7,8 классы, геометрии 7,8 классы
Рабочие программы составлены согласно рекомендациям ЦРО г.Братска.

Программа содержит пояснительную записку, перечень мультимедийного обеспечения для использования на уроках географии, также содержит обязательный региональный компонент по географии Ростовской области.

Рабочие программы по математике для 5 класса, по алгебре для 8 класса. УМК А. Г. Мордкович. Рабочие программы по геометрии для 7 и 8 класса. Программа соответствует учебнику Погорелова А.В. Геометрия: Учебник для 7-9 классов средней школы.
Рабочая программа содержит пояснительную записку, содержание учебного материала, учебно - тематическое планирование , требования к математической подготовке, список рекомендованной литературы, календа.
Тест щелочные металлы 9 класс ответы
Тесты по химии 9 класс. Тема: "Щелочные металлы"
Правильный вариант ответа отмечен знаком +
1. К какой группе относятся щелочные металлы:
2. Какой элемент можно отнести к щелочным металлам:
3. Оксиды щелочных металлов при взаимодействии с водой образуют:
4. Какая степень окисления на внешнем энергетическом уровне у щелочных металлов:
5. Щелочные металлы являются:
- как восстановителями, так и окислителями
6. От лития к цезию:
+ увеличивается радиус атомов и уменьшается электроотрицательность
- уменьшается радиус атома и уменьшается электроотрицательность
- увеличивается радиус атома и увеличивается электроотрицательность
7. Какой цвет имеют щелочные металлы:
8. Кто впервые получил калий и натрий:
9. Формулой глауберовой соли является:
- KCl * MgCl2 * 6 H2O
тест 10. Каким путем получают щелочные металлы:
11. С галогенами щелочные металлы образуют:
12. При сгорании на воздухе какой металл образует оксид:
13. Какой металл образуется пероксид:
14. При взаимодействии металла с водородом образуется:
15. При каких условиях хранят натрий и калий:
+ под слоем керосина
- под слоем подсолнечного масла
- под слоем металлической пластинки
16. В какой цвет окрашивает катион лития пламя горелки:
17. Воздействие щелочи проявляется:
18. Поваренную соль используют:
+ для приготовления пищи
- для дезинфекции поверхностей
- в качестве анальгетического средства
19. Какая концентрация хлорида натрия содержится в физиологическом растворе:
тест-20. Главным внеклеточным ионом является:
21. Калийные удобрения используют в:
- в машинном производстве
- в пищевой промышленности
22. Температура плавления увеличивается:
+ от цезия к литию
- от лития к цезию
- от натрия к калию
23. Реакцией образования пероксида натрия является:
+ 2 Na + O2 = Na 2 O2
- 2 K + O2 = K2 O 2
- 4 Li + O2 = 2 Li O
24. Какая степень окисления в пероксидах:
25. Из пероксида натрия можно получить:
26. Реакцией получения пероксида натрия является:
+ Na2O2 + H2O = 2NaOH + H2O2
- 6 Li + N2 = 2Li3N
- 2Cs + 2H20 = 2CsOH + H2 (газ)
27. При взаимодействии лития с азотом образуется:
28. Каустической содой называют:
29. Гидроксид калия используется в:
- для очистки нефти и масел
- в производстве искусственных волокон
тест_30. Химические свойства щелочных металлов определяются:
- природой как катиона, так и аниона
31. На данной фотографии изображено пламя при горении металла. Какой металл горит в данном случае?

32. Электролизом хлорида натрия получают:
33. Из хлорида калия изготавливают:
34. Технической содой называют:
35. Питьевой содой можно назвать:
36. При нагревании гидрокарбонат разлагается на:
+ NaHCO3 = t = Na2CO3 + H20 + CO 2 (газ)
- NaHCO3 =t= H2CO3 + NaOH + O2 (газ)
- NaHCO3 = Na2CO3 + NaOH + CO2 (газ)
37. Гидрокарбонат натрия используют:
+ при изготовлении кондитерского блюда
- при производстве антидепрессантов
38. Карбонат калия обычно называют:
39. В каком году Иоганн Рудольф Глаубер открыл сульфат натрия:
Тесты по химии 9 класс. Тема: "Металлы"
1. В какой группе находится металл полоний:
2. К четвертой группе относится элемент:
3. Как проходит условная граница между металлическими и неметаллическими элементами:
4. Металлургический процесс включает в себя:
+ восстановление ионов металла
- окисление ионов неметалла
- восстановление ионов неметалла
5. Пирометаллургией является:
+ процесс получения металлов из их соединений при высокой температуре
- процесс получения неметаллов из их соединений при низкой температуре
- процесс получения неметаллов из их соединений при высокой температуре
6. В пирометаллургии используются:
- как восстановители, так и окислители
7. При алюмотермии используют металл:
8. В гидрометаллургии получают:
+ металлы из растворов их соединений
- неметаллы из растворов их соединений
- воду из растворов их соединений
9. В электрометаллургии используется процесс:
- обработка при предельно высокой температуре
- реакция замещения и соединения
тест 10. При электролизе восстановителем является:
11. Чем определяются физические свойства металлов:
+ типом кристаллической решетки
- количеством протонов, электронов, нейтронов
- расположением в определенной группе или подгруппе
12. Отличием атомов металлов от неметаллов можно назвать:
+ содержат небольшое количество электронов на внешнем уровне, большой радиус и низкая электроотрицательность
- содержат большое количество электронов на внешнем энергетическом уровне, маленький радиус и высокая электроотрицательность
- содержат большое количество электронов на внешнем энергетическом уровне, большой радиус и высокая электроотрицательность
13. Металлической является связь:
+ между ионами металлов
- между ионами неметаллов
- между ионами металла и неметалла
14. Для какого агрегатного состояния не характерна металлическая связь:
- для жидкого состояния
- для твердого состояния
15. Чем обусловлена электропроводность металлов?
+ наличием свободных электронов
- наличием свободных нейтронов
- наличием свободных протонов
16. С повышением температуры электропроводность:
- может как повышаться, так и понижаться
17. Электропроводность увеличивается от:
+ ртути к серебру
- алюминия к цинку
18. Максимальной теплопроводностью обладает:
19. Наиболее пластичным металлом называют:
тест-20. Твердым веществом при нормальных условиях не является:
21. Самым твердым металлом является:
- щелочно – земельные металлы
22. Самым тяжелым металлом является:
23. Самым тугоплавким металлом является:
24. К черным металлам можно отнести:
25. Какие степени окисления имеют металлы:
- как положительные, так и отрицательные
26. Металлы в соединениях проявляют свойства:
- окислительно – восстановительные свойства
27. Какая закономерность уменьшения восстановительных свойств металлов:
+ слева направо, снизу вверх
- справа налево, сверху вниз
28. Легкому окислению поддаются:
29. Чем левее находится металл в ряду, тем:
+ больше его восстановительная способность
- меньше его восстановительная способность
- больше его окислительная способность
тест_30. Лантаноиды на внешнем энергетическом уровне содержат по:
31. Сколько примерно имеются металлов в периодической системе Менделеева:
+ более девяти ста
- менее восьми ста
- менее двадцати ста
32. Во сколько раз литий легче осмия:
+ в сорок пять раз
- в шестьдесят раз
- в семьдесят раз
33. Провода высоковольтных изготавливают из:
34. Бронза является сплавом:
- железа и алюминия
- вольфрама и серебра
35. Кто изображен на данной фотографии:

36. При взаимодействии с кислородом металлы образуют:
37. При взаимодействии щелочноземельных металлов с водой образуются:
- альдегиды и кетоны
38. Оксидом железа можно назвать:
39. В алюминотермии используется:
тест*40. Взаимодействие металлов с оксидами является реакцией:
Тесты по химии 11 класс. Тема: "Металлы"
3. Как проходит условная граница между между металлическими и неметаллическими элементами:
+ слева направо, снизу-вверх
28. На данном изображении представлена:
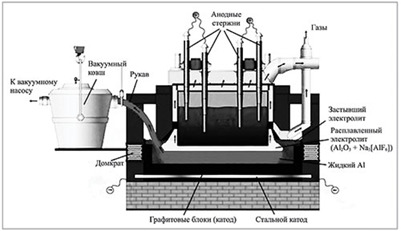
+ схема получения алюминия электролизом
- схема получения железа электролизом
- схема получения гидроксида алюминия электролизом
35. На данном рисунке представлена:
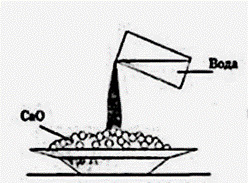
+ реакция гашения извести водой
- реакция соединения калия с хлором
- окисление перманганата калия
Тест по теме "Щелочные металлы"

Li, Na, Ag, Au, Ca, Ba – щелочным Ме относятся 7) Как можно распознать ионы щелочных Ме?
б) Li и Na 8)Какой объём кислорода (н.у) можно получить
в)Li, Na, Ag, Au из 39г пероксида натрия Na2O2 реакции:
а) высокие температуры плавления и кипения 1) 3,97л 2) 1л 3) 5,6л 4) 22,4л
б) низкие температуры плавления и кипения 9) Ионное уравнение реакции, описывающей в
в) высокие плотности взаимодействие натрия с водой, имеет
4) Щелочные металлы имеют: следующий вид.
а) высокие значения электроотрицательности 1) Na + +OH - = NaOH
б) высокие значения энергии ионизации 2)2 Na + + 2HO - = 2Na + + 2OH - + H2
в) низкие значения энергии сродства к электрону 3) Na + + H2O = NaH + OH -
5) Атомы щелочных металлов: 4) 2Na + + H2O -= Na2O + H2
а) являются сильными восстановителями 10) Растворы щелочей могут реагировать со
б) являются сильными окислителями 1)CaO, Cu 2) Si, CL2 3) BaO, K2CO3 4) Al,NaCL
в) практически не проявляют О-В свойств 11) Cокращенному ионному уравнению
6) Ионы щелочных металлов: CO 2- 3 + 2H + = CO2 + H2O соответствует молекулярное
а) являются сильными восстановителями уравнение:
б) являются сильными окислителями 1) Na2CO3 +2 HCl = 2NaCl + CO2 + H2O
в) практически не проявляют О-В свойств 2) NaHCO + HCl = NaCl + CO2 + H2O
7) В ряду от Li к Fr 3) CaCO3 + 2HCl = CaCl2 + CO2 + H2O
а) усиливаются Ме свойства 4) Ca(HCO3)2 + 2HCl = CaCl2 + 2CO2 + 2H2O
б) уменьшаются Ме свойства
в) уменьшается атомный радиус
8) Щел. Ме обычно хранят под слоем керосина, так как:
а) их плотность меньше плотности воды, но больше
б) керосин испаряется медленнее воды
в) для предотвращения взаимодействия Ме с
кислородом и водой
9) В ряду от Li к Fr основные свойства их гидроксидов:
в) остаются практически неизменными
Повышенный уровень:
1)Продукты взаимодействия Li с воздухом является преимущественно:
2) На воздухе металл натрий покрывается белой пленкой:
3) Степень окисления натрия в его пероксиде составляет:
4) Горение калия в кислороде приводит к образованию:
5) Если при проведении опыта металл натрий упал на стол, необходимо:
а) залить его большим количеством воды
б) залить его большим количеством спирта
в) аккуратно взять пинцетом и выбросить в ведро для мусора.
Ответы на тест «Щелочные металлы»: 9 класс
Читайте также:
