Токсичные металлы для человека
Обновлено: 05.10.2024
Мы обычно ассоциируем такие термины, как «токсичность» и «ядовитый», с изображениями опасных насекомых и рептилий. Но оказывается, металлы могут быть столь же опасны для человека. Вот самые токсичные металлы, воздействию которых следует избегать.
Мышьяк
Мышьяк, считающийся «ядом королей», на протяжении всей истории был причиной многих убийств. Отсутствие запаха и вкуса у мышьяка делает его смертельным ядом.
Мышьяк — это металл, который естественным образом встречается в окружающей среде в составе земной коры. Воздействие мышьяка в высоких концентрациях обычно происходит на рабочих местах на объектах с опасными отходами или вблизи них, а также в районах со значительными уровнями содержания мышьяка в горных породах, почве и воде.
Воздействие высокого уровня мышьяка может привести к смерти. При низких уровнях воздействие мышьяка в течение длительного периода времени может привести к обесцвечиванию кожи и появлению небольших мозолей или бородавок. Вы должны немедленно сообщать о любом риске воздействия мышьяка на вашем рабочем месте или в вашем районе.
Меркурий
Ртуть — чрезвычайно токсичный металл. Он блестящий и жидкий при комнатной температуре, за что получил прозвище «ртутное серебро». Ртуть использовалась людьми на протяжении веков, и свидетельства ее использования были обнаружены в древнем Китае, Индии и Египте, где ртуть была найдена в египетских гробницах, которым, как известно, более 3000 лет.
Воздействие ртути обычно происходит при добыче других металлов, таких как серебро и золото . Контакт с высоким содержанием ртути может привести к необратимому повреждению нервной системы и почек.
Хотя это чрезвычайно опасно, ртуть по-прежнему является ценным металлом. Он используется для изготовления научных инструментов, таких как термометры и барометры, из-за его высокой плотности. Ртуть также проводит электричество, что делает ее идеальной для использования в электрических выключателях термостатов и люминесцентных лампах, в которых используются пары ртути.
Кадмий
Голубоватый мягкий металл кадмий содержится в цинковых рудах. Большая часть кадмия, производимого сегодня, поступает из побочных продуктов цинка и перерабатывается из никель-кадмиевых аккумуляторов. Некоторые из ведущих производителей этого металла включают Китай, Японию, Мексику и Соединенные Штаты.
Кадмий можно найти на промышленных предприятиях, особенно там, где плавят или обрабатывают руды. Сварщики, которые по незнанию сжигали сплавы, содержащие кадмий, умирали от образующихся паров. Воздействие пыли кадмия также может вызвать боли в животе, сильную рвоту, рак и многое другое.
Кадмий может быть смертельным, но он также полезен. Это отличный электрический проводник, который часто применяется в гальванике и используется в таких устройствах, как сотовые телефоны, беспроводные электроинструменты, камеры, компьютеры и многое другое.
Вывод
Токсичные металлы
По вопросу металлических загрязнений существует несколько течек зрения. Согласно одной их них, все металлы периодической системы делят на группы:
-металлы, как незаменимые факторы питания (эссенциальные макро- и микроэлементы);
-неэссенциальные или необязательные для жизнедеятельности металлы; токсичные металлы.
Согласно другой точке зрения, все металлы необходимы для жизнедеятельности, но в определенных количествах. По воздействию на организм человека выработана следующая классификация микроэлементов:
-микроэлементы, имеющие значение в питании человека и животных (Co, Cr, Ce, F, Fe, I, Mo, Mn, Ni, Se, Si, V, Zn);
-микроэлементы, имеющие токсикологическое значение (As, Be, Cd, Co, Cr, F, Hg, Mn, Mo, Ni, Pb, Pd, Se, Sn, Ti, V, Zn).
При этом следует лтметить, что 10 их перечисленных элементов отнесены в обе группы.
Биологически эссенциальные металлы имеют пределы доз, определяющие их дефицит, оптимальный уровень и уровень токсического действия. Токсические металлы на этой же шкале в низких дозах не оказывают вредного действия и не несут биологических функций. Однако в высоких дозах они оказывают токсическое действие. Таким образом не всегда можно установить различие между жизненно необходимыми и токсичными металлами. Все металлы могут проявить токсичность, если они потребляются в избыточном количестве. Кроме того, токсичность металлов проявляется в их взаимодействии друг с другом. Тем не менее, существуют металлы, которые проявляют сильно выраженные токсикологические свойства при самых низких концентрациях и не выполняют кокой либо полезной функции. К таким токсичным металлам относят ртуть, кадмий, свинец, мышьяк.
Ртуть, кадмий, свинец, мышьяк, медь, стронций, цинк, железо Объединенная комиссия ФАО и ВОЗ по пищевому кодексу (Codex Alimehtarius) включила в число компонентов, содержание которых контролируется при международной торговле продуктами питания. В России и СНГ подлежат контролю еще 7 элементов (сурьма, никель, хром, алюминий, фтор, йод, олово), а при наличии показаний могут контролироваться и некоторые другие металлы.
В России гигиеническими требованиями определены критерии безопасности для следующих токсических веществ: свинец, мышьяк, кадмий. Ртуть, медь, цинк, железо, олово (для консервов в сборной жестяной таре), хром (для консервов в хромированной таре).
Свинец относится к наиболее известным ядам и среди современных токсикантов играет весьма заметную роль. Свинец находится в микроколичествах почти повсеместно. В почвах обычно содержится от 2 до 200 мг/кг свинца. Свинец, как правило сопутствует другим металлам, чаще всего цинку, железу, кадмию и серебру. В наше время в роли токсикантов окружающей среды выступают прежде всего алкильные соединения свинца, такие как тетраэтилсвинец.
В радиусе нескольких километров от свинцеперерабатывающих предприятий концентрация этого металла в некоторых овощах и фруктах варьируется в пределах (мг/кг): в помидорах – 0,6. 1,2, в огурцах – 0,7. 1,1, в перце – 1,5. 4.5, в картофеле – 0,7. 1,5. При обработке продуктов основным источником поступления свинца является жестяная банка, которая используется для упаковки от 10 до 15 % пищевых изделий.
Свинец токсически действует на 4 системы органов: кроветворную, нервную, желудочно-кишечную и почечную. Экспертами ФАО и ВОЗ установлена величина ПДК (допустимая суточная доза) свинца для взрослого человека, которая составляет 0,007 мг/кг массы тела, а ПДК (предельно допустимая концентрация) в питьевой воде – 0,05 мг/л.
Мышьяк.Природный мышьяк находится в элементном состоянии, в виде арсенидов и арсеносульфидов тяжелых металлов. Содержится во всех объектах биосферы: в морской воде – около 5 мкг/кг, в земной коре – 2 мг/кг, рыбах и ракообразных – в наибольших количествах.
Мышьяк в зависимости от дозы, может вызвать острое и хроническое отравление. Хроническая интоксикация возникает при длительном употреблении питьевой воды с 0,3. 2.2 мг/л мышьяка. Разовая доза мышьяка в 30 мг смертельна для человека. Допустимая суточная доза мышьяка – 0,05 мг/кг массы тела, что для взрослого человека составляет около 3 мг/сут.
Кадмий. Кадмий представляет собой один из самых опасных токсикантов из внешней среды. В природной среде кадмий встречается в очень малых количествах, именно поэтому его отравляющее действие было выявлено лишь недавно. В последние 30 – 40 лет он все больше применяется в промышленности. Кадмий опасен в любой форме – принятая внутрь доза в 30 – 40 мг уже может оказаться смертельной. Поглощенное количество кадмия выводится из организма очень медленно (0,1 % в сутки), легко может происходить хроническое отравление. В организме кадмий в первую очередь накапливается в почках. Кадмий почти невозможно изъять из природной среды, поэтому он все больше накапливается в ней и попадает различными путями в пищевые цепи человека и животных. Больше всего кадмия мы получаем с растительной пищей.
Эксперты ФАО полагают, что взрослый человек с рационом получает 30. 150 мкг кадмия в сутки. Допустимая суточная доза кадмия составляет 1 мкг/кг массы тела.
Ртуть.Один из самых опасных и высокотоксичных элементов, обладающий способностью накапливаться в организме растений, животных и человека. В пищевых продуктах ртуть может присутствовать в 3-х видах: атомарная ртуть, окисленная ртуть и алкилртуть – соединения ртути с алкилирующими соединениями.
Токсичность ртути зависит от вида ее соединений, которые по разному всасываются, метаболизируются и выводятся из организма. С токсикологической точки зрения ртуть наиболее опасна, когда она присоединена к углеродному атому метиловой, этиловой или пропиловой группы – это алкильные соединения с короткой цепью. Процесс метилирования ртути является ключевым звеном ее биокумуляции по пищевым цепям водных экосистем. Механизм токсического действия ртути связывают с ее взаимодействием с белками. Ртуть изменяет свойства белков или инактивирует ряд жизненно важных ферментов. Неорганические соединения ртути нарушают обмен аскорбиновой кислоты, пиридоксина, кальция, меди, цинка, селена; органические – обмен белков, цистеина, аскорбиновой кислоты, токоферолов, железа, меди, марганца, селена. Ртуть, проникнув в клетку, может включиться в структуру ДНК, что сказывается на наследственности человека.
Допустимое недельное поступление не должно превышать 0,3 мг на человека, в том числе метилртути не более 0,2 мг, что эквивалентно 0,005 мг/кг и 0,003 мг/кг массы тела за неделю. В питьевой воде до 0,001 мг/л, а для других прочих продуктов – около 0,05 мг.
Медь.Медь присутствует почти во всех пищевых продуктах. Суточная потребность взрослого человека в меди 2,0 – 2,5 мг, то есть 35 – 40 мкг/ кг массы тела, для детей – 80 мкг/ кг массы тела. Однако при нормальном содержании в пище молибдена и цинка – физиологических антагонистов меди – по оценке экспертов ФАО, суточное потребление меди может составлять не более 0,5 мкг/кг массы тела. В организме человека присутствуют механизмы биотрансформации меди. При длительном воздействии высоких доз меди наступает «поломка» механизмов адаптации, переходящая в интоксикацию и специфическое заболевание.
Цинк. Цинк присутствует во многих пищевых продуктах и напитках, особенно в продуктах растительного происхождения. Суточная потребность в цинке взрослого человека составляет 15 мг. Содержание цинка в пищевых продуктах составляет, мг/кг: мясо – 20-40, рыбопродукты – 15-30, устрицы – 60-1000, яйца – 15-20, фрукты и овощи – 5, зерновые – 25-30, молоко – 2-6 мг/л. В суточном рационе взрослого человека содержание цинка составляет 13 – 25 мг. Цинк и его соединения малотоксичны. Однако избыток цинка вызывает токсическое действие на организм. Токсические дозы солей цинка действуют на желудочно-кишечный тракт.
ПДК цинка в питьевой воде – 5 мг/л, для водоемов рыбохозяйственного значения – 0,01 мг/л.
Олово.Пищевые продукты содержат этот элемент до 1 – 2 мг/кг. Неорганические соединения олова малотоксичны, органические – более токсичны, находят применение в сельском хозяйстве в качестве фунгицидов, в химической промышленности. Основным источником загрязнения пищевых продуктов оловом являются консервные банки, фляги. Опасность отравления оловом увеличивается при постоянном присутствии его спутника – свинца. Не исключено взаимодействие олова с отдельными веществами пищи и образование более токсичных органических соединений.
Высокая концентрация олова в пище может привести к острому отравлению. Показано, что для человека токсичная доза олова составляет 5 – 7 мг/кг массы тела. Отравление оловом может вызвать признаки острого гастрита, оно отрицательно влияет на активность пищеварительных ферментов.
Токсичные элементы
Токсичные элементы (в частности, некоторые тяжелые металлы) составляют обширную и весьма опасную в токсикологическом отношении группу веществ. Обычно рассматривают 14 элементов: Hg (ртуть), Pb (свинец), Cd (кадмий), As (мышьяк), Sb (сурьма), Sn (олово), Zn (цинк), Al (алюминий), Be (бериллий), Fe (железо), Cu (медь), Ba (барий), Cr (хром), Tl (таллий). Разумеется, не все перечисленные элементы являются ядовитыми, некоторые из них необходимы для нормальной жизнедеятельности человека и животных. Поэтому часто трудно провести четкую границу между биологически необходимыми и вредными для здоровья человека веществами.
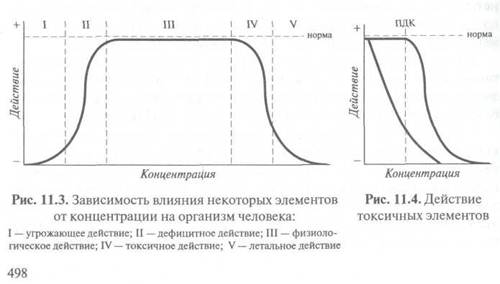
В большинстве случаев реализация того или иного эффекта зависит от концентрации. При повышении оптимальной физиологической концентрации элемента в организме может наступить интоксикация, а дефицит многих элементов в пище и воде может привести к достаточно тяжелым и трудно распознаваемым явлениям недостаточности.
Зависимость вредного или полезного действия некоторых элементов от концентрации показана на рис. 11.3.
Для веществ, относящихся к так называемым супертоксикантам, плато, характеризующее норму, отсутствует (или очень короткое), а крутизна нисходящей ветви характеризует токсичность вещества (рис. 11.4).
Загрязнение водоемов, атмосферы, почвы, сельскохозяйственных растений и пищевых продуктов токсичными металлами происходит за счет:
- выбросов промышленных предприятий (особенно угольной, металлургической и химической промышленности);
- выбросов городского транспорта (имеется в виду загрязнение свинцом от сгорания этилированного бензина);
- применения в консервном производстве некачественных внутренних покрытий и при нарушении технологии припоев;
- контакта с оборудованием (для пищевых целей допускается весьма ограниченное число сталей и других сплавов).
Для большинства продуктов установлены предельно-допустимые концентрации (ПДК) токсичных элементов, к детским и диетическим продуктам предъявляются более жесткие требования.
Наибольшую опасность из вышеназванных элементов представляют ртуть (Hg), свинец (РЬ), кадмий (Cd).
Ртуть — один из самых опасных и высокотоксичных элементов, обладающий способностью накапливаться в растениях и в организме животных и человека, т. е. является ядом кумулятивного действия.
Токсичность ртути зависит от вида ее соединений, которые по-разному всасываются, метаболизируются и выводятся из организма. Наиболее токсичны алкилртутные соединения с короткой цепью — метилртуть, этилртуть, диметилртуть. Механизм токсического действия ртути связан с ее взаимодействием с сульфгидрильными группами белков. Блокируя их, ртуть изменяет свойства или инактивирует ряд жизненно важных ферментов. Неорганические соединения ртути нарушают обмен аскорбиновой кислоты, пиридоксина, кальция, меди, цинка, селена; органические — обмен белков, цистеина, аскорбиновой кислоты, токоферолов, железа, меди, марганца, селена.
Защитным эффектом при воздействии ртути на организм человека обладают цинк и, особенно, селен. Предполагают, что защитное действие селена обусловлено деметилированием ртути и образованием нетоксичного соединения — селено-ртутного комплекса.
О высокой токсичности ртути свидетельствуют и очень низкие значения ПДК: 0,0003 мг/м 3 в воздухе и 0,0005 мг/л в воде. Безопасным уровнем содержания ртути в крови считают 50—100 мкг/л. Человек получает с суточным рационом около 0,05 мг ртути, что соответствует рекомендациям ФАО/ВОЗ.
В организм человека ртуть поступает в наибольшей степени с рыбопродуктами, в которых ее содержание может многократно превышать ПДК. Мясо рыбы отличается наибольшей концентрацией ртути и ее соединений, поскольку активно аккумулирует их из воды и корма, в который входят различные гидробионты, богатые ртутью. Например, хищные пресноводные рыбы могут содержать от 107 до 509 мкг/кг, нехищные пресноводные рыбы от 78 до 200 мкг/кг, а океанские нехищные рыбы от 300 до 600 мкг/кг Hg.
Организм рыб способен синтезировать метил-ртуть, которая накапливается в печени. У некоторых видов рыб в мышцах содержится белок — металлотионеин, который с различными металлами, в том числе и с ртутью, образует комплексные соединения, способствуя тем самым накапливанию ртути в организме и передаче ее по пищевым цепям. У таких рыб содержание ртути достигает очень высоких концентраций: рыба-сабля содержит от 500 до 20 000 мкг/кг, а тихоокеанский марлин от 5000 до 14 000 мкг/кг. Для других продуктов характерно следующее содержание ртути (мкг/кг).
Свинец - один из самых распространенных и опасных токсикантов. История его применения очень древняя, что связано с относительной простотой его получения и большой распространенностью в земной коре (1,6х10 -3 %). Соединения свинца — Рb3О4 и PbSO4 — основа широко применяемых пигментов: сурика и свинцовых белил. Глазури, которые используются для покрытия керамической посуды, также содержат соединения Рb.
Металлический свинец со времен Древнего Рима применяют при прокладке водопроводов. В настоящее время перечень областей его применения очень широк: производство аккумуляторов, электрических кабелей, химическое машиностроение, атомная промышленность, производство эмалей, замазок, лаков, хрусталя, пиротехнических изделий, спичек, пластмасс и т. п.
Мировое производство свинца составляет более 3,5х10 6 т в год. В результате производственной деятельности человека в природные воды ежегодно попадает 500-600 тыс. т, а в атмосферу в переработанном и мелкодисперсном состоянии выбрасывается около 450 тыс. т, подавляющее большинство которого оседает на поверхности Земли. Основным источником загрязнения атмосферы свинцом являются выхлопные газы автотранспорта (260 тыс. т) и сжигание каменного угля (около 30 тыс. т).
В тех странах, где использование бензина с добавлением тетраэтилсвинца сведено к минимуму, содержание свинца в воздухе удалось многократно снизить. Следует подчеркнуть, что многие растения накапливают свинец, который передается по пищевым цепям и обнаруживается в мясе и молоке сельскохозяйственных животных, особенно активное накопление свинца происходит вблизи промышленных центров и крупных автомагистралей.
Ежедневное поступление свинца в организм человека с пищей — 0,1-0,5 мг, с водой — 0,02 мг. Содержание свинца (в мг/кг) в различных продуктах таково: фрукты 0,01-0,6; овощи 0,02-1,6; крупы 0,03-3,0; хлебобулочные изделия 0,03-0,82; мясо и рыба 0,01-0,78; молоко 0,01-0,1. В организме человека усваивается в среднем 10% поступившего свинца, у детей — 30-40%. Из крови свинец поступает в мягкие ткани и кости, где депонируется в виде трифосфата.
Механизм токсического действия свинца имеет двойную направленность. Во-первых, блокада функциональных SH-групп белков и, как следствие, — инактивация ферментов, во-вторых, проникновение свинца в нервные и мышечные клетки, образование лактата свинца, затем фосфата свинца, которые создают клеточный барьер для проникновения ионов Са 2+ . Основными мишенями при воздействии свинца являются кроветворная, нервная и пищеварительная системы, а также почки.
Свинцовая интоксикация может приводить к серьезным нарушениям здоровья, проявляющимся в частых головных болях, головокружениях, повышенной утомляемости, раздражительности, ухудшении сна, мышечной гипотонии, а в наиболее тяжелых случаях к параличам и парезам, умственной отсталости. Неполноценное питание, дефицит в рационе кальция, фосфора, железа, пектинов, белков (или повышенное поступление кальциферола) увеличивают усвоение свинца, а следовательно — его токсичность. Допустимая суточная доза (ДСД) свинца составляет 0,007 мг/кг; величина ПДК в питьевой воде — 0,05 мг/л.
Мероприятия по профилактике загрязнения свинцом сырья и пищевых продуктов должны включать государственный и ведомственный контроль за промышленными выбросами свинца в атмосферу, водоемы и почву. Необходимо существенно снизить или полностью исключить применение тетраэтилсвинца в бензине, свинцовых стабилизаторах, изделиях из поливинилхлорида, красителях, упаковочных материалах и т. п.
Кадмий широко применяется в различных отраслях промышленности. В воздух кадмий поступает вместе со свинцом при сжигании топлива на ТЭЦ, с газовыми выбросами предприятий, производящих или использующих кадмий. Загрязнение почвы кадмием происходит при оседании кадмий-аэрозолей из воздуха и дополняется внесением минеральных удобрений: суперфосфата (7,2 мг/кг), фосфата калия (4,7 мг/кг), селитры (0,7 мг/кг).
Заметно содержание кадмия и в навозе, где он обнаруживается в результате следующей цепи переходов: воздух - почва - растения - травоядные животные - навоз. В некоторых странах соли кадмия применяют в качестве антисептических и антигельминтных препаратов в ветеринарии. Все это определяет основные пути загрязнения кадмием окружающей среды, а следовательно, продовольственного сырья и пищевых продуктов.
В одной сигарете содержится 1,5-2,0 мкг Cd. Подобно ртути и свинцу, кадмий не является жизненно необходимым металлом. Попадая в организм, кадмий проявляет сильное токсическое действие, главной мишенью которого являются почки. Механизм токсического действия кадмия связан с блокадой сульфгидрильных групп белков; кроме того, он является антагонистом цинка, кобальта, селена, ингибирует активность ферментов, содержащих указанные металлы. Известна способность кадмия нарушать обмен железа и кальция.
Все это может привести к широкому спектру заболеваний: гипертоническая болезнь, анемия, ишемическая болезнь сердца, почечная недостаточность и другие. Отмечены канцерогенный, мутагенный и тератогенные эффекты кадмия. По рекомендациям ВОЗ допустимая суточная доза (ДСД) кадмия — 1 мкг/кг массы тела.
Большое значение в профилактике интоксикации кадмием имеет правильное питание (включение в рацион белков, богатых серосодержащими аминокислотами, аскорбиновой кислоты, железа, цинка, селена, кальция), контроль за содержанием кадмия (полярографический, атомно-абсорбционный анализы) и исключение из рациона продуктов, богатых кадмием.
Алюминий. Первые данные о токсичности алюминия были получены в 70-х гг. XX в., и это явилось неожиданностью для человечества. Будучи третьим по распространенности элементом земной коры (8,8% массы земной коры составляет А1) и обладая ценными качествами, металлический алюминий нашел широкое применение в технике и быту. Поставщиками алюминия в организм человека является алюминиевая посуда, если она контактирует с кислой или щелочной средой, вода, которая обогащается ионами А1 3+ при обработке ее сульфатом алюминия на водоочистительных станциях.
Существенную роль в загрязнении окружающей среды ионами А1 3+ играют и кислотные дожди. Не следует злоупотреблять содержащими гидроксид алюминия лекарствами: противогеморроидальными, противоартритными, понижающими кислотность желудочного сока. Как буферную добавку вводят гидроксид алюминия и в некоторые препараты аспирина и в губную помаду. Среди пищевых продуктов наивысшей концентрацией алюминия (до 20 мг/г) обладает чай.
Поступающие в организм человека ионы А1 3+ в форме нерастворимого фосфата выводятся с фекалиями, частично всасываются в кровь и выводятся почками. При нарушении деятельности почек происходит накапливание алюминия, которое приводит к нарушению метаболизма Са, Mg, P, F, сопровождающееся ростом хрупкости костей, развитием различных форм анемии. Кроме того, были обнаружены и более грозные проявления токсичности алюминия: нарушение речи, провалы в памяти, нарушение ориентации и т. п. Все это позволяет приблизить «безобидный», считавшийся нетоксичным до недавнего времени алюминий к «мрачной тройке» супертоксикантов: Hg, Pb, Cd.
Мышьяк как элемент в чистом виде ядовит только в высоких концентрациях. Он принадлежит к тем микроэлементам, необходимость которых для жизнедеятельности организма человека не доказана, а его соединения, такие как мышьяковистый ангидрид, арсениты и арсенаты, сильно токсичны. Мышьяк содержится во всех объектах биосферы (в земной коре — 2 мг/кг, в морской воде — 5 мкг/кг). Известными источниками загрязнения окружающей среды мышьяком являются электростанции, использующие бурый уголь, медеплавильные заводы; он используется при производстве полупроводников, стекла, красителей, инсектицидов, фунгицидов и др.
Нормальный уровень содержания мышьяка в продуктах питания не должен превышать 1 мг/кг. Так, например, фоновое содержание мышьяка (мг/кг): в овощах и фруктах 0,01-0,2; в зерновых 0,006-1,2; в говядине 0,005-0,05; в печени 2,0; яйцах 0,003-0,03; в коровьем молоке 0,005-0,01. Повышенное содержание мышьяка отмечается в рыбе и других гидробионтах, в частности в ракообразных и моллюсках. По данным ФАО/ВОЗ, в организм человека с суточным рационом поступает в среднем 0,05-0,45 мг мышьяка. ДСД — 0,05 мг/кг массы тела.
В зависимости от дозы мышьяк может вызывать острое и хроническое отравление, разовая доза мышьяка 30 мг — смертельна для человека. Механизм токсического действия мышьяка связан с блокированием SH-групп белков и ферментов, выполняющих в организме самые разнообразные функции.
Проект по химии «Токсическое действие тяжелых металлов"
Как известно, для жизни человека необходимы различные элементы. В нашем организме их очень много. Они называются биогенные элементы. Но есть элементы, не имеющие никакой ценности для организма. Они являются ядовитыми в любых количествах. Это тяжелые или токсичные металлы. К тяжелым металлам (ТМ) относится относительно большая группа химических элементов с плотностью выше 5 г/см3 и относительной атомной массой более 50 атомных единиц. Эту группу составляют медь, цинк, марганец, железо, никель и другие металлы, в небольших количествах необходимые как животным, так и растениям.
Существует более 50 элементов, которые могут быть отнесены к тяжелым металлам, 17 из них считаются очень токсичными, но довольно широко распространенными. Токсичная концентрация зависит от металла, его биологической роли и вида организма, который подвергается его воздействию. Анализируя химический состав человеческого организма, ученые пришли к выводу, что тяжелые металлы оказывают влияние не только на физиологическое, но и на психическое состояние человека. Например, известно, что при стрессе в крови возрастает содержание цинка, а вероятность инфаркта можно определить по повышенному содержанию никеля и марганца. Методом масс-спектроскопии было обнаружено, что у агрессивных людей в волосах обнаруживается повышенное содержание свинца, железа, кадмия, меди и пониженное - цинка, кобальта. Металлы даже в очень малых количествах жизненно важны для организма человека, и падение концентрации ниже допустимого уровня ведет к тяжелым расстройствам. Это объясняется тем, что многие металлы выполняют главным образом функции катализаторов.
Актуальность темы исследования: состоит в том, что что многие металлы являются биогенными элементами, поэтому необходимо изучить потребность в них организма человека и способы возмещения потерь, поскольку их недостаток приводит к нарушению жизнедеятельности организма и приводит к различным заболеваниям.
Гипотеза: если металлы содержатся в организме человека, то они способны влиять на физическое здоровье человека.
Цель исследования: изучение специфических свойств тяжелых металлов, их биологической роли, степени токсичности и воздействия на здоровье человека.
Задачи исследования:
1. Изучить литературу по проблеме исследования;
2.Выявить влияние количественного содержания металлов на функционирование органов человека;
3. Узнать, в каких продуктах питания содержатся те или иные металлы.
4. Выработать перечень полезных советов, которые помогут снизить воздействие тяжелых металлов на организм человека.
2.1.Характеристика тяжелых металлов.
На сегодня не существует единого мнения относительно количества токсичных металлов, поскольку нет общих критериев, относящих металлы к тяжёлым. Тем не менее, список тяжёлых металлов может быть сформирован в зависимости от различных свойств металлов и их признаков. К ним относят:
Атомный вес. Исходя из этого критерия, к названным принадлежат более 40 элементов с атомной массой, превышающей 50 а.е.м (г/моль).
Плотность. Исходя из этого критерия, тяжёлыми считаются те металлы, у которых плотность равна или превосходит плотность железа.
Биологическая токсичность объединяет тяжёлые металлы, негативно влияющие на жизнедеятельность человека и живых организмов. В их списке порядка 20 элементов.
Большинство названных веществ оказывают негативное воздействие на все живые организмы. Ввиду значительной атомной массы, они плохо транспортируются и накапливаются в тканях человека, вызывая различные заболевания. Так, для человеческого организма кадмий, ртуть и свинец признаны как самые опасные и самые тяжёлые металлы.
Список токсичных элементов группируется по степени опасности по так называемым правилам Мертца, согласно которым наиболее токсичные металлы имеют наименьший диапазон экспозиции:
Кадмий, ртуть, таллий, свинец, мышьяк (группа самых опасных металлических ядов, превышение допустимых норм которых способно привести к серьёзным психофизиологическим нарушениям и даже к летальному исходу).
Это, однако не означает, что ни один из элементов, сгруппированных выше, по правилам Мертца, не должен присутствовать в человеческом организме. Напротив, список тяжёлых металлов насчитывает в нем эти и ещё более 20 элементов, небольшая концентрация которых не только не опасна дляжизнедеятельности человека, но и необходима в метаболических процессах, особенно железо, медь, кобальт, молибден и даже цинк.
2.2.1. Металлы в организме человека
В организме человека обнаружено 86 элементов периодической системы Менделеева, которые постоянно присутствуют, из них 25 необходимы для нормальной жизнедеятельности, 18 из которых абсолютно, а 7 полезны. Профессор Василий Робертович Вильямс назвал их элементами жизни. В состав веществ, участвующих в реакциях, связанных с жизнью клетки, входят все известные химические элементы, но большинство из них это кислород (65 - 75%), углерод (15 - 18%), водород (8 - 10%) и азот (1,5 - 3,0%). Остальные элементы делятся на 2 группы: макроэлементы (около 1,9%) и микроэлементы (около 0,1%). Макроэлементы - это сера, фосфор, хлор, калии, натрий, магний, кальций и железо, к микроэлементам - цинк, медь, йод, фтор, марганец, селен, кобальт, стронций, никель, хром, ванадий и др. Микроэлементы хоть и малочисленные, но играют важную роль - влияют на обмен веществ. Без них невозможна нормальная жизнедеятельность каждой клетки в отдельности и организма как целого.
2.2.2. Биологическая роль некоторых металлов в организме человека.
Золото. В средневековье алхимики считали золото совершенством, а остальные металлы – ошибкой в акте творения и, как известно, прикладывали большие усилия для ликвидации этой ошибки. Идею введения золота в медицинскую практику приписывают Парацельсу, который провозгласил, что целью химии должно быть не превращение металлов в золото, а приготовление лекарств. Лекарственные препараты из золота и его соединений пытались применять при многих заболеваниях. Им лечили волчанку, туберкулез. У людей, чувствительных к золоту, оно может вызвать нарушение состава крови, реакцию со стороны почек, печени, влиять на настроение, рост зубов, волос.
Алюминий. Алюминиевую посуду называют посудой бедняков, так как этот металл способствует развитию старческого атеросклероза. При приготовлении пищи в такой посуде алюминий частично переходит в организм, где и накапливается.
Цинк. Оптимальная интенсивность поступления цинка в организм 15 мг/сут, суточная потребность составляет 50 мг. Дефицит цинка может развиваться при недостаточном поступлении этого элемента в организм (1 мг/сут и менее), а порог токсичности составляет 600 мг/сут. В организм человека 99 % цинка попадает с пищей. Особенно много цинка содержится в говядине, печёнке, устрицах (400 мг в 100 г продукта), пшеничных зародышах.
В медицине цинкосодержащий препарат сульфат цинка используется при дефиците цинка, для лечения болезней кожи, волос, ногтей, цирроза печени и при заживлении ран. Препарат несовместим с карбонатами, сульфитами –осаждение нерастворимых солей цинка; с восстановленным магнием выпадает осадок цинка.
Медь . Среднее содержание меди в человеческом организме 150 мг на 70кг. В организм медь поступает в основном с пищей. Много меди содержится в морских продуктах, бобовых, капусте, картофеле, крапиве. Суточная потребность организма в меди – 2 мг. При ожогах кожи фосфором её обильно смачивают 5 %-ным раствором сульфата меди (II).
Марганец. Соединения марганца в основном поступают в организм с пищей. Много марганца содержится в ржаном хлебе, пшеничных и рисовых отрубях, сое, горохе, свёкле (содержание марганца в 100 г свёклы составляет 0,65 мг). Оптимальная интенсивность поступления марганца в организм 5-9 мг/сут; уровень, приводящий к дефициту, и порог токсичности оцениваются в 1 и 40 мг/сут соответственно. В медицинской практике для промывания ран применяют раствор перманганата калия.
Калий содержащий препарат перманганат калия несовместим в жидких лекарственных формах с восстановителями – происходит взаимное разложение; с бромидами, иодидами, хлоридами – выделяются галогены; с солями двухвалентного железа – образуется трёхвалентное железо; с соляной кислотой и её солями образует свободный хлор, с аммиаком – нитраты.
Железо. В организме содержится 3г железа, из них 2 г в крови. Железо входит в состав гемоглобина. Недостаточное содержание железа приводит к головной боли, быстрой утомляемости. Академик Ферсман говорил, что железо – не только основа всего мира, самый главный металл окружающей нас природы. Оно основа культуры и промышленности. Оно орудие войны и мирного труда, и во всей таблице Менделеева невозможно найти другой такой элемент, который был бы так связан с прошлыми, настоящими и будущими судьбами человечества.
2.3. Влияние концентрации металла на состояние здоровья человека
Нарастающее производство металлов имеет далеко идущие последствия.
Человечество затрачивает колоссальные усилия и энергию на то, чтобы выделить и сконцентрировать металлы, но при этом вступает в противоречие с направленностью геохимических процессов и законной химии. Однако в процессе хозяйственного использования металла восстанавливается равновесие, нарушенное человеком.
Помимо этого, огромное количество железа истирается, распыляется во время работы различных машин. Люди борются с этим, возвращая часть испорченного металла на переплавку, но при этом также происходят невосстанавливаемые потери.
В результате сжигания больших масс каменного угля микропримеси металлов поступают с дымом в атмосферу и разносятся по всей поверхности земного шара. Если рассеяние металлов, производящиеся горно-металлургической промышленностью, протекает с умеренной скоростью, то распыление металлов через атмосферу посредством сотен тысяч дымовых труб происходит очень быстро. Каждый год сотни тысяч тонн металлов рассеиваются в атмосфере.
При сжигании угля распространённые металлы в значительно меньшем количестве, чем они добываются из недр.
Токсическими свойствами обладают практически все тяжелые металлы, когда их содержание превышает верхний порог концентрации. Ниже представлена таблица, в которой отражены биологическая роль металлов и их токсическое действие.
2.4. Содержание тяжелых металлов в продуктах питания
Обычно рассматриваются 8 основных токсичных химических элементов в пище: ртуть, свинец, кадмий, мышьяк, цинк, медь, олово и железо. Первые три наиболее опасны. Токсические элементы могут попасть в опасных для человека концентрациях в пищевые продукты из сырья и в процессе технологической обработки только при нарушении соответствующих технологических инструкций. Так, в растительном сырье они могут появиться при нарушении правил применения ядохимикатов, содержащих в своем составе такие токсические элементы, как ртуть, свинец, мышьяк и др. Повышенное количество токсических элементов может появиться в зоне вблизи промышленных предприятий, загрязняющих воздух и воду недостаточно очищенными отходами производства.
В таблице приведено содержание предельно допустимых концентраций тяжелых металлов.
В концентрированных растительных и животных продуктах (сушеных, сублимированных и т. д.) предельно допустимая концентрация тяжелых металлов определяется, как правило, при пересчете на исходный продукт.
В домашнем питании тоже необходим контроль, который заключается в предупреждении загрязнения консервированных продуктов свинцом. Рекомендуется вскрытые консервы из сборных жестяных банок, даже для кратковременного хранения помешать в стеклянную или фарфоровую посуду, так как под влиянием кислорода воздуха коррозия банок резко увеличивается и буквально через несколько дней содержание свинца (и олова) в продукте многократно возрастает. Нельзя также хранить маринованные, соленые и кислые овощи и фрукты в оцинкованной посуде во избежание загрязнения продуктов цинком и кадмием (цинковый слой также содержит некоторое количество кадмия).
Для приготовления и хранения продуктов следует использовать только посуду, специально предназначенную для пищевых целей. То же самое относится к красивым пластмассовым пакетам и пластмассовой посуде.
В них можно хранить и то непродолжительное время только сухие продукты.
Например, свинец, представляет собой яд высокой токсичности. Его естественное содержание в большинстве растительных и животных продуктов обычно не превышает 1,0 мг/кг. Но большое количество свинца может содержаться в хищных рыбах (в тунце, например, до 2,0 мг/кг), моллюсках и ракообразных (до 10 мг/кг). Повышенное содержание свинца наблюдается в консервах, находящихся в так называемой сборной жестяной таре.
При сгорании этилированного бензина образуется тетраэтилсвинец, который легко попадает в почву и вызывает загрязнение выращенных на ней пищевых продуктов. Именно по этой причине в растениях, выращенных вдоль автострад, содержится повышенное количество свинца.
Обезопасить себя от свинца можно отказавшись от употребления (или употребляя в пищу редко) хищных рыб, моллюсков и ракообразных, использования консервов в жестяной таре и покупки продуктов, выращенных вдоль автодорог.
Повышенные концентрации кадмия наблюдаются в таких продуктах, как какао-порошок (до 0,5 мг/кг), почки животных (до 1,0 мг/кг) и рыба (до 0,2 мг/кг). Содержание свинца, как и кадмия, увеличивается в консервах из сборной жестяной тары. Очень большое количество кадмия могут содержать грибы из экологически грязных районов: 0,1–5,0 мг/кг.
Ртуть представляет собой весьма токсичный яд кумулятивного (накопительного) действия. Из-за этой особенности в молодых животных его содержание меньше, чем в старых, а в хищниках его содержится большее количество, нежели в их жертвах. В особенной степени этим отличаются хищные рыбы. Например, в организме тунца ртути может накапливаться до 0,7 мг/кг и более. Другими активными природными «накопителями» ртути из животных продуктов являются почки животных. Содержание ртути в них может достигать 0,2 мг/кг.
2.5. Курение как фактор экологической опасности.
Известно, что 90% онкологических заболеваний связано с курением: вместе с дымом в организм попадает формальдегит, бензол и другие высокотоксичные вещества – канцерогены. Основными компонентами табачного дыма из твердой фазы одной сигареты являются: никотин (1800мкг), свинец (0,24мкг), алюминий (0,22мкг), кадмий (0,12мкг), никель (0,08мкг), железо (0,042мкг), ртуть (0,0014мкг) и другие.
За последние десятилетия ученые выяснили, что у людей не курящих стали обнаруживаться болезни, присущие курильщикам. Причина? Некурящие люди длительное время находились в помещении с курильщиками. При курении в организм человека проникает 20-25% ядовитых веществ, а 50% вместе с выдыхаемым дымом поступает в воздух. А им дышат окружающие. Получается, что не курящие «курят». Появился даже специальный термин «пассивное курение».
Токсичные металлы 1 группы опасности
Среди этих металлов наиболее широко распространён свинец Pb. Отравление его соединениями занимает первое место по частоте среди всех соединений металлов. Свинец принадлежит к 14 группе 6-го периода. В соединениях проявляет степень окисления +2 и +4. Уникальной особенностью Pb среди элементов 14 группы является образование оксида Рb3О4 («сурик»), в молекулах которого сосуществуют обе указанные валентности. При этом Рb 2+ (r = 132 пм) обладает повышенным сродством к S в любых ее формах, тогда как Рb 4+ (г = 84 пм) к S практически индифферентен. Рb 2+ образует устойчивые комплексы с карбоксильными и фосфатными группами биополимеров; в частности, отмечена высокая устойчивость его комплексов с пиримидинами, особенно с цитидином. Это свойство проявляется в ингибировании пиримидин-5-нуклеотидазы, которая в физиологических условиях дефосфорилирует пиримидин-5-рибозо-монофосфат; в результате накопления этого субстрата в лейкоцитах крови появляется базофильная зернистость.
Как токсичное вещество Рb известен почти пять тысяч лет. Впервые его токсическое действие («сатурнизм») описали греческие и арабские ученые. Высокая частота отравлений Рb описана у древних римлян, которые пили воду из свинцового водопровода и хранили вино в сосудах из свинец-содержащих сплавов. Посудное олово, из которого изготовляли тарелки и пивные кружки, содержало 10-20% Pb. В современных условиях наибольшее загрязнение среды обитания свинцом вызывают выхлопы бензиновых двигателей автомашин, поскольку в бензин для повышения октанового числа добавляют тетраэтилсвинец Рb(С2Н5)4.
Отравление свинцом проявляется поражением ЦНС (клинически сопровождающимся агрессивностью), почек и печени, анемией, подагрой. У мужчин снижается воспроизводительная функция. Согласно одной из гипотез, именно свинцовое отравление явилось причиной физического вымирания римлян и падения Римской империи.
На субклеточном уровне повреждающее действие Pb зависит от его распределения среди органелл клетки. Например, в гепатоцитах 85% металла находится в митохондриях, около 5% — в эндоплазматическом ретикулуме, лизосомах и ядре, еще 8% связано с фосфолипидами, белками, АТФ и другими компонентами цитозоля, остальное — в плазматической мембране. Показано, что Pb блокирует активные центры ионных насосов клеток, кардинальным образом изменяя проницаемость мембран, а также резко снижает их устойчивость к осмотическому шоку и увеличивает механическую жесткость из-за связывания SH-, ОН- и РО3Н- групп мембран. Кроме того, Pb подавляет энергетическую функцию мембран, как клеточных, так и субклеточных (митохондриальных, ядерных и других).
Pb препятствует одной из ступеней биосинтеза гема, ингибируя в митохондриях порфобилиногенсинтазу (дегидратазу δ-аминолевулиновой кислоты) и прекращая синтез порфобилиногена. Поэтому при остром отравлении свинцом в крови и моче обнаруживают повышенную концентрацию 5-аминолевулината. Кроме того, ионы Pb 2+ препятствуют включению ионов Fe 2+ в молекулы протопорфирина IX, ингибируя феррохелатазу, что блокирует образование хелатной структуры гема. Отметим, что спирт EtOH является синергистом ионов свинца.
Хроническое отравление Pb постепенно приводит к нарушениям функций почек (аминоацидурия, гипофосфатемия), нервной системы (полинейропатия, энцефалопатия), развитию микроцитарной анемии, кардиомиопатии. Токсичность Pb увеличивается при недостатке в организме Са и Fe.
Pb блокирует SH-группы белков, образует комплексы с фосфатными группами рибозы у нуклеотидов (особенно у цитидина) и тем самым быстро разрушает РНК, ингибирует ферменты, в частности, карбоксипептидазу. Большую роль в токсических проявлениях действия свинца играет его накопление в костной ткани, в частности, в остеокластах. Они значительно быстрее и активнее, чем остеобласты, абсорбируют ионы Pb из питательной среды, в результате чего метаболизм Са в организме нарушается. Классификация степени отравления в зависимости от уровня Pb в крови у человека приведена в табл. 1.
Таблица 1. Классификация степеней накопления свинца в организме человека, предложенная CDC (США)
Степень (класс) накопления
Уровень свинца в крови (мкг/дл)
Отравления свинцом нет
Рекомендуются частое проведение повторных анализов и профилактические меры
Диетические и воспитательные меры
Оценка состояния окружающей среды, проведение терапии хелатами
Предотвращение неблагоприятного воздействия факторов окружающей среды, терапия хелатами
Неотложная медицинская помощь
ПДК свинца в крови равно 25 мкг/дл. При анализе крови у примерно 300 пациентов-москвичей обнаружена тесная связь среднего содержания Pb (7,96 мкг/дл) с наличием артериальной гипертонии (АГ); в контрольной группе содержание Pb составило 5,49 мкг/дл.
Таллий Tl — очень токсичный металл 13 группы 6 периода. Из-за высокой токсичности получил прозвище «химический СПИД». Отравление Tl поражает нервную систему, вызывает гастроэнтериты, периферическую нефропатию, а при дозах 6-10 мг/кг массы тела может быть смертельным. Через 2-3 недели после контакта с небольшим количеством металла у человека выпадают волосы.
В природе Tl содержится главным образом в виде одновалентного иона, хотя может находиться и в форме менее токсичного Tl 3+ . По размеру ионы Тl + близки к К + (соответственно, 149 и 133 пм), аналогична и их проницаемость для клеточных мембран, но Tl вчетверо более поляризуем. При попадании в организм животных он нарушает электролитный гомеостаз, ионный баланс между Na + и К + , что приводит к ингибированию натриевого ионного насоса и энергетики клеток. Отмечено выраженное сродство Tl к сульфгидрильным группам, незначительное — к карбоксильным, амино- и фосфатным группам. Хотя Тl + считают слабым комплексообразователем, с рибофлавином, например, он образует нерастворимый комплекс, нарушая метаболизм S и функции иммунной системы. В молекуле пируваткиназы он взаимодействует с центральным атомом фермента Мп, блокируя перенос концевой фосфорильной группы от АТФ к молекуле акцептора.
Из металлов 12 группы наиболее токсичны Cd (5 период) и Hg (6 период).
Ртуть Hg, как более тяжёлый элемент, во всех формах оказывается токсичнее. Токсическая доза для человека равна 0,4 мг, порог токсичности 50 мкг, а летальная доза 150-300 мг. Токсичность ртути зависит от химической формы, в которой она попадает в организм. В Южной Японии отравление этим металлом описано как «болезнь Минамото» (меркуриализм). Минамото — это залив, жители которого питались рыбой, содержавшей большое количество металла из сбросов находящегося на берегу завода уксусной кислоты. Технологически ртуть использовали в этом процессе как катализатор. Использование ртутных реагентов в терапии (например, бензоата для лечения сифилиса и гонореи), а также в качестве инсектицидов и фунгицидов привело к отравлениям тысяч людей. Поэтому ртутное загрязнение считается всемирно значимой проблемой.
Hg образует прочные комплексы с большинством лигандов, обладающих единственным донорным атомом (особенно с N и S). Молекулярный механизм токсического действия Hg 2+ связан с его взаимодействием с сульфгидрильными группами, а также с С5-атомами в молекулах пиримидинов. Ртуть блокирует ряд важнейших ферментов, в частности, карбоангидразу, карбоксипептидазу, щелочную фосфатазу. Она легко замещает Со в корриноидах, извращая метаболические реакции, связанные с витамином В12 (мутазы аминокислот, диол- и глицерин-дегидратазы, этаноламиндезаминазы, ацетатсинтетазы, метилтрансферазы и др.). Нарушение синтеза ДНК при недостаточности витамина В12 приводит к дегенеративным изменениям в нервной системе и развитию мегалобластной анемии (в том числе ее наиболее распространенной формы — пернициозной анемии).
В природных условиях металлическая Hg быстро превращается в летучее высокотоксичное соединение — хлорид метилртути CH3HgCl и метилртуть Hg(СН3)2. В организме ионы метилртути CH3Hg + быстро поступают в эритроциты, печень и почки, а также оседают в головном мозге, вызывая тяжелые необратимые кумулятивные изменения в центральной нервной системе (ЦНС, вплоть до общего и церебрального паралича), деформацию конечностей, особенно пальцев, нарушения глотания, судороги, смерть. Метилртуть (канцероген и нейротоксикант) накапливается в гидросфере и по пищевым цепям попадает в рыбу. В Финляндии беременным женщинам запрещено питаться рыбой, так как в её мясе содержание Hg превышает европейские ПДК (0,5 мг/кг). Здоровым людям при потреблении такой рыбы не рекомендовано употреблять её чаще 1 раза в неделю.
Отмечена связь аутизма, акродинии и болезни Альцхаймера с содержанием металла в организме (Haley, 2005). Антагонистами Hg являются пепсин, аминокислоты, Se, Zn и витамин С. Поэтому при его незначительном накоплении в организме больным можно назначать мочегонные средства и препараты, содержащие эти антагонисты. Лечение комплексонами, как правило, неэффективно.
Кадмий Cd — мягкий ковкий серебристый металл 5 периода с высокой токсичностью. Растворимые соединения Cd после всасывания в кровь поражают ЦНС, печень и почки, нарушают фосфорно-кальциевый обмен. Является кумулятивным ядом, вызывает отравление, описанное в Японии как болезнь «итай-итай» (в переводе — «ох-ох»). Название болезни связано с сопровождающими ее болями в спине и ногах вследствие остеомаляции (декальцификации) костей. При этом заболевании увеличивается ломкость костей; описан пациент с 72 переломами одновременно.
Cd содержится в организме здоровых людей. Он легко накапливается в быстроразмножающихся клетках, например, в опухолевых или половых, что привлекло к нему внимание, как к возможному антиканцерогенному препарату. Однако он повреждает цитоплазматический и ядерный материал клеток, легко связываясь с сульфгидрильными группами многих гормонов и ферментов, с металлотионеином и с α2 глобулином крови. Cd накапливается в почках (30-60%) и печени (20-25%).
Хроническое отравление Cd приводит к анемии и разрушению костей, повреждает ткань печени и почек, вызывая почечную недостаточность. Избыток Cd нарушает метаболизм металлов, особенно Fe и Са, действие цинксодержащих и иных металлоферментов, синтез ДНК. Cd легко замещает другие металлы (главным образом, Zn 2+ , Fe 2+ и Мо 2+ ) в составе металлофлавопротеиновых комплексов, нарушая движение электронов от металла к лиганду, и останавливая двухстадийный процесс окисления. Среди важнейших Fe-содержащих флавиновых ферментов, блокируемых Cd, можно назвать сукцинат-, глицерофосфат-, дигидрооротат-, холин-, НАДН-дегидрогеназы, сульфат- и сульфитредуктазы. Среди Мо-содержащих флавиновых ферментов — ксантин- и альдегид-оксидазы, а также нитратредуктазу.
Одним из наиболее значимых источников поступления Cd в организм людей оказывается табачный дым. Вместе с Sr, присутствующим в дыме, он, по законам межэлементного взаимодействия, замещает ковалентно-связанный Са 2+ (r = 174 пм) в костях. Поскольку радиус ковалентно-связанных атомов Cd 2+ (141 пм) меньше радиуса Са 2+ , а радиус Sr 2+ (192 пм) больше него, кристаллическая решетка костей чисто механически разрыхляется. Результатом становится декальцификация костей и остеомаляция, с одной стороны. С другой — ковалентно-связанный Са 2+ , вытесненный из костей, в ионной форме резко уменьшается в размерах до 106 пм. Этот ион цитотоксичен, и в условиях отсутствия в костной ткани гормонов гомеостаза Са вызывает нарушения метаболизма, которые могут приводить, в конечном счёте, к раку.
Алюминий Аl — легкий элемент 13 группы 3 периода, наиболее распространённый металл и третий по распространённости элемент на Земле. В земной коре больше содержится лишь O2 и Si. Аl связан диагональным соотношением с Be. Авцын и др. (1991) относят Аl к токсическим элементам. Он «недружелюбен» ко всем формам жизни. Широкое распространение алюминия в результате промышленного развития человечества чревато неблагоприятными последствиями для жизни. Вероятно, механизм вовлечения Аl в биохимические реакции связан с его способностью легко формировать гидроксилалюмосиликаты с имеющимися во всех биологических средах слабыми кремниевыми кислотами.
Единственный стабильный изотоп 27 Аl имеет некомпенсированный ядерный спин + 5 /2. Возбуждение атомов и ионов этого парамагнитного изотопа слабыми магнитными полями (например, от мобильных телефонов), гипотетически может резко снизить гематоэнцефалический барьер, что приводит к проникновению Аl 3+ внутрь клеток. Увеличение концентрации Аl в ткани мозга (особенно в ядрах мозга, где велико число нейронов, формирующих нейрофибриллярные клубочки) сопровождается его нейротоксическим действием, по-видимому, связанным с образованием устойчивых комплексов с биомолекулами нервных волокон. Al легко координирует функциональные группы с О и F, образуя комплексные соединения, которые нарушают нормальные биохимические процессы. Кумулятивный эффект накопления металла зависит от того, что в нервные клетки проникает Аl 3+ , имеющий радиус 51 пм. Ион, вступая в реакции с присутствующими органическими лигандами, образует комплекс с ковалентными (или донорно-акцепторными) связями. В этом случае размер иона увеличивается до 118 пм. Для его изъятия из нервной ткани, таким образом, возникает стерическое препятствие, которое из-за гематоэнцефалического барьера почти непреодолимо.
Показано, что при нейродегенеративном заболевании — болезни Альцхаймера - концентрация Al в головном мозге повышена, и этот факт позволяет предполагать наличие причинной связи (Гладких, Сернов, 2002). Хотя эта гипотеза подвергается сомнению (Rondeau, 2002), свойства Аl и его накопление в височных долях мозга у больных все же не позволяют отвергнуть наличие такой связи.
В костной ткани высокое содержание Аl сопровождается образованием АlРО4 и истощением запаса фосфатов, что нарушает образование кристаллов гидроксилапатита при костной минерализации и приводит к остеомаляции. Поглощенный Аl 3+ подавляет активность кислой и щелочной фосфатаз, снижая скорость образования кости, ингибирует синтез коллагена и гема, а в клетках печени соединяется с ДНК, запуская, по-видимому, механизм нарушения синтеза порфирина, подобно порфирии.
В кислых растворах Аl может абсорбироваться в кишечнике, концентрируясь в головном и в костном мозге, а также в ретикулярных клетках островков эритробластов. Вдыхаемый в аэрозоле элементарный Аl вызывает выраженный фиброз легочной ткани (Kerr, Ward, 1993).
В жидкости, используемой для гемодиализа, отмечали наличие Аl. Поэтому у больных, находящихся на гемодиализе (например, при диабете с почечной недостаточностью) уровень Аl в крови повышается, что приводит к заболеванию, называемому «диализной энцефалопатией». Накопление Al в организме при гемодиализе может вызывать также «диализную остеодистрофию» (Wills, Savory, 1993). Оба диализных заболевания представляют собой классические примеры хелатной патологии. При использовании для диализа деионизированной воды, полученной без Al-содержащих ионообменных смол, они не развиваются. Отравление проявляется запорами, неврологическими нарушениями, гипофункцией околощитовидных желез, микроцитарной гипохромной анемией.
Обзор токсичности других элементов, вероятно, не имеет особого смысла, кроме того, по токсикологической химии имеется обширная литература (Ершов, Плетенёва, 1989, Авцын и др., 1991, Плетенёва, 2006, Калетина, 2007). Можно повторить, что все галогены, в том числе I, в свободной форме токсичны. То же относится к ряду соединений углерода, азота, фосфора и серы. Немалую угрозу представляют анионы азотсодержащих кислот в силу их распространённости. Например, в плодах накапливаются нитраты из азотных удобрений в почве. Избыток нитратов в овощах или фруктах может привести в случае однократного употребления к отравлению, проявляющемуся по-разному — от лёгкой тошноты и крапивницы до коматозного состояния, например, в случае употребления ранних арбузов. Если же нитраты попадают в организм длительно, может развиться хроническая интоксикация, чреватая развитием злокачественных опухолей ЖКТ, почечной и сердечной недостаточности, инфаркта миокарда, поражений печени, мозга и иммунной системы.
Проявления токсичности всех элементов и их форм подчиняются правилам Мертца и различаются только деталями. Подчеркнём, что все металлы в свободной форме, то есть в комплексах с обычными неорганическими лигандами, в той или иной степени токсичны.
Читайте также:
