Восстановление металлов из оксидов водородом
Обновлено: 04.10.2024
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Модуль 1. ВОССТАНОВЛЕНИЕ ВОДОРОДОМКомплексные цели: знать лабораторные способы получения и очистки водорода; его физические и химические свойства; знать теоретические основы его использования для получения металлов из их оксидов; знать свойства получаемых металлов; уметь работать с аппаратом Киппа, проверять водород на чистоту, собирать установку для восстановления оксидов водородом при высокой температуре. Теоретическая часть Получение и очистка водорода Водород в лаборатории получают либо электролизом растворов щелочей, либо взаимодействием металлов с кислотами. В особых случаях пользуются действием некоторых металлов или их сплавов на воду, а также взаимодействием алюминия и кремния с водными щелочными растворами. При получении водорода вторым способом в качестве исходных веществ применяют цинк в виде гранул и раствор 20%-ной серной кислоты. Наиболее удобно получать водород в аппарате Киппа (рис. 1). Цинк помещают в среднюю часть аппарата Киппа, она отделена от нижней пористой перегородкой, через которую может проникать раствор кислоты. Кислота вливается через отверстие в верхней части аппарата Киппа и протекает в нижний резервуар по стеклянной трубке. В средней части аппарата Киппа происходит реакция между цинком и кислотой, выделятся водород, который выходит через отверстие с краном. Если кран закрыт, то в средней части аппарата Киппа создается избыточное давление водорода, и кислота вытесняется в нижний резервуар, а затем по стеклянной трубке – в верхний, ее контакт с цинком прекращается. Если же кран открыт, то избыточное давление в среднем резервуаре снимается, и кислота через пористую перегородку устремляется к цинку. Если цинк очень чистый, то реакция будет идти очень медленно. Для ускорения реакции добавляют несколько миллилитров раствора медного купороса. За счет взаимодействия сульфата меди с цинком на поверхности цинка осаждается медь, образуя микрогальванопару, благодаря чему выделение водорода значительно ускоряется. Полученный водород не бывает достаточно чистым, содержит небольшое количество примесей: пары воды, углеводороды (из углерода, находящегося в цинке), следы сернистого и углекислого газа, водородные соединения фосфора, мышьяка, серы (из включений в цинке), а также следы воздуха. Для окисления различных водородных соединений (сероводорода, мышьяковистых соединений и др.) и сернистого газа водород пропускают через 2-3 промывалки с концентрированным щелочным раствором перманганата калия. Удобнее и эффективнее для очистки (из-за большей поверхности) применять колонки, наполненные битым стеклом или стеклянными бусами, смоченными соответствующим раствором. После очистки водород осушают. Сначала его пропускают через промывалку с концентрированной серной кислотой, которая в то же время служит счетчиком пузырьков. Для более тщательной осушки водород пропускают последовательно через осушительные колонки с обезвоженным хлористым кальцием, едким кали и фосфорным ангидридом. Чтобы водород мог свободно проходить через колонки, их не следует набивать слишком плотно. Для наполнения колонок фосфорным ангидридом нужно истолочь стекло или мелко нарезать узкие стеклянные трубки на кусочки диаметром и длиной в 3-4 мм, быстро перемешать их в фарфоровой чашке с сухим фосфорным ангидридом и пересыпать эту смесь в колонку. Необходимо учесть, что осушители по мере поглощения ими влаги постепенно теряют свою активность. Для окончательного осушения водород можно пропустить через расплавленный натрий. Столь тщательная очистка и осушка водорода требуется не всегда. Так, при получении металлов из оксидов достаточно очистить водород от примесей водородных соединений фосфора, мышьяка, серы путем пропускания его через одну промывалку с раствором окислителя и осушить с помощью концентрированной серной кислоты (рис. 2). Получение же гидридов металлов, напротив, требует очень тщательной очистки и осушки водорода. Получение металлов из оксидов действием водородаО способности оксидов восстанавливаться водородом, можно судить в первом приближении по термодинамическим данным (табл. 1). Термодинамические расчеты и эксперимент подтверждают, что водород наиболее легко восстанавливает металлы из тех оксидов, которые образуются с выделением небольшого количества тепла (оксиды меди, железа, кобальта). Металлы, оксиды которых имеют большие теплоты образования по абсолютному значению (оксиды алюминия, магния, титана, циркония), с помощью водорода практически не получаются. Восстановление металлов из оксидов водородом - гетерогенный равновесный процесс, выгодно отличающийся от металлотермических реакций тем, что пары воды можно легко удалить из реакционного пространства, сместив тем самым равновесие в сторону продукта. Изучение кинетики реакции восстановления металлов из их оксидов показало, что процесс этот заключается в адсорбции водорода на активных центрах оксида с последующей десорбцией паров воды. Роль этих активных центров могут выполнять следы различных примесей, всегда имеющиеся в исходных оксидах, например, оксиды легко восстанавливаемых металлов или примеси некоторых металлов. Наличие этих примесей может менять характер восстановления: например, ускорять его, или даже изменять константу равновесия. При решении вопроса о том, возможно ли восстановление металла из данного оксида, следует учитывать также скорость установления равновесия, особенно при невысоких температурах.Чем медленнее устанавливается равновесие, тем больше времени потребуется затратить для получения металла.
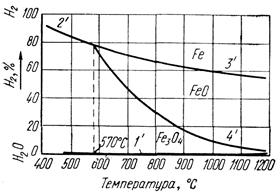
Иногда получить металл совсем не удается, хотя с термодинамической точки зрения реакция вполне вероятна. Так, оксиды меди, кобальта, никеля (теплота образования которых не превышают 750 кДж/моль по абсолютному значению), легко восстанавливаются при температуре 350-500°С. Некоторые оксиды этого ряда (СrО3, МоО3, MnO2, WO3) при этой температуре не восстанавливаются водородом до металла. Объясняется это тем, что восстановление водородом элементов, которые могут существовать в различных степенях окисления, протекает ступенчато. Сначала из высших оксидов сравнительно легко образуются оксиды в промежуточной степени окисления, а затем при более высоких температурах из них получаются соответствующие металлы. Однако этого не всегда можно добиться. В частности, при восстановлении марганца из двуокиси можно получить лишь оксид марганца (II), из которого получить металл очень трудно. Как правило, с уменьшением степени окисления металла прочность оксидов возрастает, а их способность к восстановлению уменьшается. Количество водорода, необходимое для восстановления металла из его оксида, нужно вычислять не по стехиометрическому уравнению, а на основании константы равновесия, которую устанавливают экспериментально и по которой определяют процент использования водорода. Как правило, при высоких температурах для восстановления металла требуется водорода несколько больше, чем при низких температурах. На практике при низких температурах восстановление не проводят, потому что скорость реакции очень мала. Применение избыточного количества водорода с целью смещения равновесия дает незначительный эффект и приводит к непроизводительным затратам водорода. Необходимо также учитывать величину поверхности соприкосновения оксида с водородом. Сильно прокаленные оксиды, имеющие крупнокристаллическую структуру, вступают в реакцию с водородом труднее, чем мелкодисперсные. При малой поверхности соприкосновения водород, для более полного его использования, следует пропускать медленнее. Большинство металлов, получаемых описанным методом, прочно удерживает следы растворенного кислорода; его остатки удаляются с большим трудом и часто только при сплавлении металла в атмосфере сухого водорода. Однако после такой переплавки в металле обычно содержится некоторое количество растворенного водорода, удалить который можно только повторной длительной выдержкой расплавленного металла в глубоком вакууме. Физические свойства и химическая активность получаемых металлов зависят от температуры восстановления. Металлы, получаемые при низких температурах, имеют большую поверхность и очень реакционноспособны. Некоторые из них получаются пирофорными и на воздухе часто самовозгораются. Повышение температуры восстановления приводит к укрупнению частичек металла и уменьшение их поверхности; внутренняя структура частичек металла делается упорядоченной, дефектность уменьшается, в результате чего химическая активность металла сильно снижается. Если температура восстановления близка к температуре плавления, металлы получаются в виде плотной губки. В сплавленном состоянии металлы получаются при более высоких температурах, чем их температуры плавления. Если температура восстановления выше 600 – 650 о С, то реакцию проводят в трубчатых электрических печах. В этом случае оксиды помещают в фарфоровую или кварцевую лодочку, которую вставляют в реактор (фарфоровая или кварцевая трубка). Концы трубки закрывают резиновыми или хорошими корковыми пробками, в которые вставляют с одного конца трубку, подводящую водород, а с другого – трубку, отводящую пары воды и непрореагировавший водород. При температуре 550-600 о С и ниже реакцию можно вести не в лодочке, а прямо в стеклянной трубке или трубке с перетяжками. Окончание реакции восстановления оксидов определить довольно трудно. Об этом можно судить по изменению цвета или по уменьшению массы оксида, но только в том случае, если он имеет постоянный и известный состав. Практически водород пропускают в избытке в течение 20 – 30 мин, после чего реакцию считают доведенной до конца. Когда восстановление проводят в прозрачных трубках и при температуре, несколько превышающей точку плавления металла, об окончании реакции можно судить по образованию металлических корольков (особенно хорошо это видно при получении свинца, висмута, сурьмы). Если восстанавливаются малостойкие оксиды, то в конце трубки собираются капельки воды, что также можно считать признаком окончания реакции. Малостойкие оксиды, например платины, могут при нагревании в атмосфере водорода быстро разлагаться, при этом в реакторе образуется гремучая смесь, что иногда приводит к взрыву. Для измерения температур ниже 500 о С можно использовать термометр, для более высоких температур применяют термопару. Так как при восстановлении водородом не требуется очень точного соблюдения температурного режима, термопару можно поместить вне реакционной трубки, с ее наружной стороны, но в непосредственной близости от лодочки. Собранную установку необходимо обязательно проверить на герметичность. Для этого через установку пропускают ток водорода, а трубку, отводящую водород, погрузить на 3-4 см в воду. Если водород пробулькивает через слой воды, то прибор герметичен. Другой способ проверки герметичности (лучший в том случае, когда водород получают в аппарате Киппа). Через установку пропускают водород, а затем закрывают выходное отверстие газоотводной трубки. При полной герметичности прибора ток водорода скоро прекращается, об этом можно судить, наблюдая за счетчиком пузырьков. Восстановление оксидов железа водородомВторым восстановителем НВ в доменной печи, является водород. Он образуется в горне при разложении влаги дутья и природного газа, если последний вдувают в доменную печь, а также летучих кокса. Количество водорода в газе составляет 1 – 2% если печь работает на увлажненном дутье. При вдувании природного газа содержание водорода в газе повышается до 6 – 12% и роль его в восстановительных процессах значительно возрастает. Восстановление оксидов железа водородом протекают по уравнениям: при температуре ниже 570° С при температуре выше 570° С FeO + n'H2 = Fe + (n' - l)H2 + H2O - 6620 ккал. (61) Реакция восстановления Fe2О3 до Fe3О4 идет необратимо, т. е. до полного использования Н2 или Fe2О3. Реакции восстановления Fe3О4 и FeO обратимы. Направление протекания реакции зависит от отношения Н2/Н2Огаз в газе и от температуры. Равновесный состав газовой смеси для реакций (57) – (61) зависит только от температуры, так как они идут без изменения объема газообразных веществ. На рисунке 26 показано равновесие газовых смесей Н2 и Н2Огаз с оксидами железа и железом в зависимости от температуры. Равновесные кривые делят диаграмму на три поля: Fe, FeO и Fe3О4. Рисунок 26 - Кривые равновесия газовых смесей Н2 и Н2Огаз с оксидами железа и железом Отличие диаграммы на рисунке 26 от диаграммы на рисунке 25 состоит в том, что равновесные кривые 2' и 3' с повышением температуры изображены нисходящими линиями, т. к. восстановление водородом Fe3О4 до Fe по реакции (58) и FeO до Fe по реакции (61) идет с поглощением тепла в отличие от аналогичных реакций восстановления оксидом углерода, где реакция восстановления FeO до Fe идет с выделением тепла. Для сопоставления восстановительной способности СО и Н2 совместим диаграммы равновесных газовых смесей Н2 - Н2Огаз и СО – СО2 с оксидами железа и железом. При температуре 810° С равновесные кривые 3 и 4 диаграммы на рисунке 25 пересекаются с соответствующими равновесными кривыми 3' и 4' на рисунке 26 (см. рисунок 27). В точках пересечения равновесных кривых отношение Н2/Н2Огаз равно отношению СО/СО2, т. е. восстановительная способность Н2 и СО, или их химическое сродство к кислороду, одинакова. При температуре ниже 810°С отношение Н2/Н2Огаз в равновесной смеси выше отношения СО/СО2, следовательно, для восстановления оксидов железа и железа водородом, его концентрация в газовой смеси должна быть выше, чем концентрация окиси углерода при восстановлении оксидом углерода. Это значит, что при температурах ниже 810° С химическое сродство водорода к кислороду выражено слабее, чем у оксида углерода, и он обладает меньшей восстановительной способностью.
Рисунок 27 - Кривые равновесия газовых смесей Н2 – Н2Огаз и СО – СО2 с оксидами железа и железом При температуре выше 810 °С, наоборот, отношение Н2/Н2Огаз в равновесной смеси ниже отношения СО/СО2, т. е. восстановительная способность водорода выше, чем восстановительная способность окиси углерода. В связи с тем что ниже 810° С сродство к кислороду у окиси углерода больше, чем у водорода, СО может взаимодействовать с водяным паром, образующимся при восстановлении, например: FeО +CO→ Fe + CО2 . (62) Аналогичные реакции можно написать для Fe2O3 и Fe3О4. Выше 810° С сродство к кислороду у окиси углерода меньше, чем у водорода, однако взаимодействие водорода с СО не получает развития по той причине, что при 900– 1000 °С и водяной пар, и диоксид углерода активно взаимодействуют с углеродом, превращаясь в водород и оксид углерода. Таким образом, водород в доменной печи как при умеренных, так и при высоких температурах является промежуточным реагентом или переносчиком кислорода от оксидов железа к оксиду углерода или углероду. AcetylЧитайте также:
|