Все щелочные металлы реагируют с кислородом только при повышенной температуре
Обновлено: 04.10.2024
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы. Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием. В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами.
Все элементы IIA группы относятся к s-элементам, т.е. содержат все свои валентные электроны на s-подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns 2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме 0 – 2e — → Ме +2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO. Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
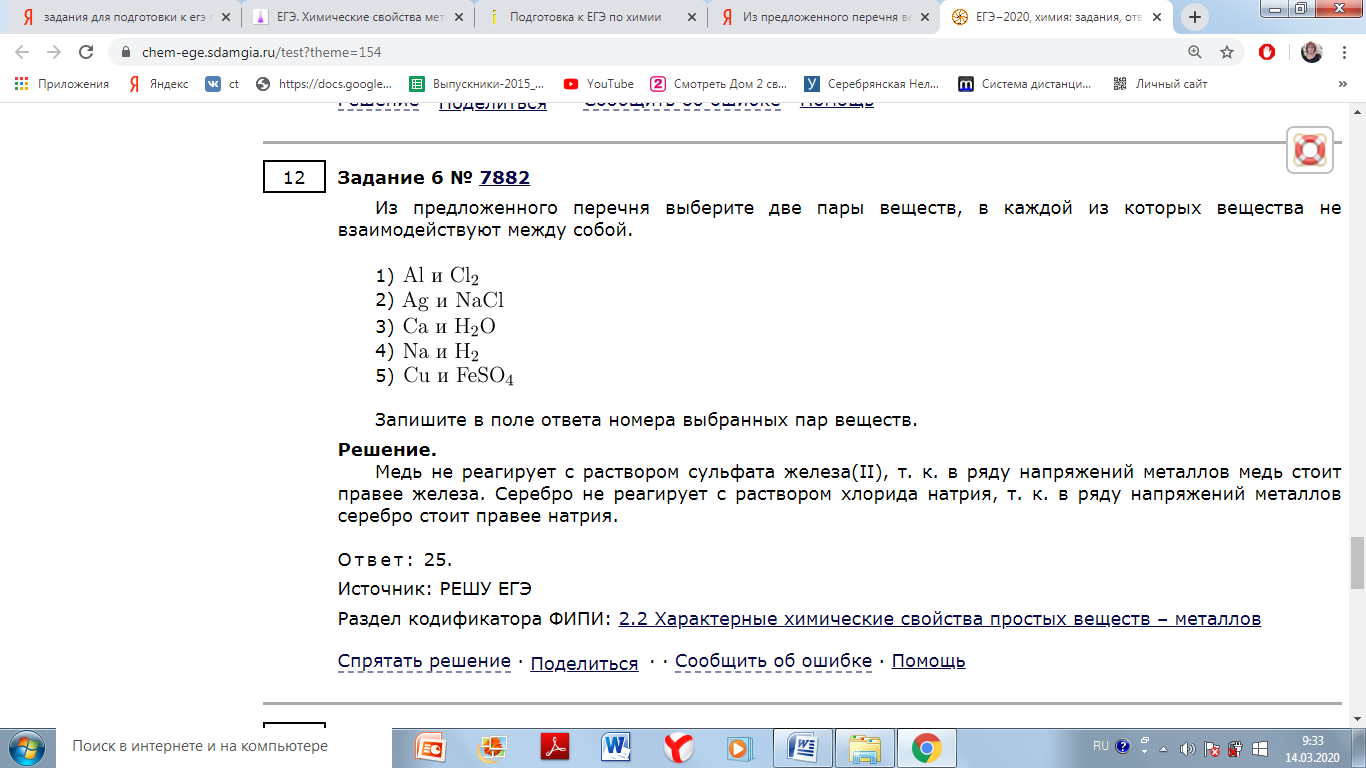
с галогенами
Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл. Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C2 2- , фактически являющийся фрагментом молекулы ацетилена. Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла. С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода. Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO. В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
c кислотами-окислителями
− разбавленной азотной кислотой
С разбавленной азотной кислотой реагируют все металлы IIA группы. При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы происходит преимущественно до сероводорода:
с щелочами
Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении. При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
с оксидами
Щелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.
Все щелочные металлы реагируют с кислородом только при повышенной температуре
Задания Д2 № 3769Верны ли следующие суждения о металлах?
А. Все металлы IА и IIА групп образуют щёлочи.
Б. Все металлы IА–IIIА групп являются s-элементами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А. Все металлы IА и IIА групп образуют щёлочи. Нет, например, гидроксид магния - не щелочь.
Б. Все металлы IА–IIIА групп являются s-элементами. Нет, металлы IIIа группы - p-элементы.
Задания Д2 № 2801Верны ли следующие суждения об элементах IIIА группы?
А. Общая формула высших оксидов элементов IIIА группы .
Б. Все высшие оксиды элементов IIIА группы проявляют только основные свойства.
Общая формула высших оксидов элементов IIIА группы не , а .
Некоторые высшие оксиды элементов IIIА группы проявляют амфотерные свойства.
Задания Д2 № 3811Верны ли следующие суждения о металлах и их соединениях?
А. Для металлов IIА группы характерны восстановительные свойства.
Б. Для оксидов металлов IА группы характерны основные свойства.
А. Для металлов IIА группы характерны восстановительные свойства. Да, эти металлы характерные восстановители.
Б. Для оксидов металлов IА группы характерны основные свойства. Да, для оксидов этих металлов характерны основные свойства.
Правильный ответ указан под номером: 3.
А как же бериллий?
В вопросе не сказано, что все оксиды должны быть именно основными, а основные свойства проявляют и амфотерные оксиды.
Задания Д2 № 2715Верны ли следующие суждения о металлах главных подгрупп?
А. Все металлы I-IIIA групп являются p-элементами.
Б. Химическая активность натрия выше, чем алюминия.
Металлы I и IIA групп являются s-элементами, поэтому первое утверждение неверно.
Да, химическая активность натрия выше чем алюминия (достаточно вспомнить что натрий окисляется на воздухе, а алюминий стабилен).
Задания Д2 № 3231А. Восстановительные свойства у калия выражены сильнее, чем у магния.
Б. Высшие оксиды металлов IA группы имеют состав .
Калий находится левее и ниже магния в Периодической системе, поэтому его восстановительные свойства выражены сильнее, чем у магния.
Высшие оксиды металлов IA группы действительно имеют состав .
Задания Д2 № 3853А. Высшие оксиды элементов IIA группы имеют состав .
Б. Восстановительные свойства у кальция выражены сильнее, чем у бария.
А. Высшие оксиды элементов IIA группы имеют состав . Нет, их формула .
Б. Восстановительные свойства у кальция выражены сильнее, чем у бария. Нет, восстановительная активность усиливается по группе сверху вниз.
Утверждение Б тоже верно, по таблице по группе Са выше, чем Ва
Восстановительная активность усиливается по группе сверху вниз.
Задания Д2 № 190Верны ли следующие суждения об элементах IIA группы?
А. Барий более активный металл, чем стронций.
Б. Основный характер оксидов в ряду ослабевает.
Верны оба суждения, т. к. в группах металлические свойства элементов и основные свойства их соединений возрастают с увеличением порядкового номера элемента.
Согласно пояснению "Верны оба суждения, т. к. в группах металлические свойства элементов и основные свойства их соединений возрастают с увеличением порядкового номера элемента." А значит, так как Ва имеет меньший порядковый номер чем Sr, а Ba
У Бария порядковый номер 56, а у стронция - 38.
Что же больше, 56 или 38?
В задаче говорится о том что воостановительные св-ва ослабевают а не усиливаются. Поддерживаю замечание гостя: правильный ответ - 4
Из фразы "В группах металлические свойства элементов и основные свойства их соединений возрастают с увеличением порядкового номера элемента" можно сделать вывод, что с уменьшением порядкового номера элемента указанные свойства ослабевают.
правильный ответ - 3
Здесь явная ошибка. Ответ 1. Тк Mq более сильный металл, чем Ba
Нет, здесь нет ошибки - барий обладает более выраженными металлическими свойствами чем магний.
правильный ответ: 1.
В группах сверху вниз возрастают металлические свойства элементов,
усиливаются основные свойства их соединений
В остальном Вы правы.
(в пункте Б оксиды указаны "снизу вверх")
если следовать правилу, что в группах сверху вниз возрастают МЕ свойства,то ДА, действительно в предложенном заданием ряду основные свойства ослабевают.(по крайней мере так рассуждал я) но вот вопрос, во всех ли заданиях такого типа можно рассуждать по вышеописанному правилу или есть свои нюансы?
Это общая закономерность для главных подгрупп. В побочных всё значительно сложнее ( там одни сплошные "исключения"). Но в вопросах ЕГЭ они обычно не встречаются
Задания Д2 № 1265А. Барий — более активный металл, чем бериллий.
Б. Основный характер оксидов в ряду возрастает.
Суждение А верно т. к. более активным металлом является элемент с большим количеством энергетических уровней т. к. радиус его атома больше — это барий.
Суждение В неверно т. к. элемент, проявляющий более сильные металлические свойства, образует оксид с более выраженными основными свойствами.
Задания Д2 № 2629Верны ли следующие суждения о свойствах щелочных металлов и их соединений?
А. Все щелочные металлы реагируют с кислородом только при повышенной температуре.
Б. Оксиды щелочных металлов проявляют амфотерные свойства.
Не все щелочные металлы реагируют с кислородом только при повышенной температуре - в зависимости от степени измельченности и активности, они с разной скоростью реагируют с кислородом.
Оксиды щелочных металлов проявляют только основные свойства.
Задания Д2 № 3102Верны ли следующие суждения о строении атомов и свойствах щелочных металлов?
А. Атомы щелочных металлов в основном состоянии имеют электронную конфигурацию внешнего энергетического уровня ns 1 .
Б. Все щелочные металлы способны взаимодействовать с водой при обычной температуре.
Атомы щелочных металлов в основном состоянии действительно имеют электронную конфигурацию внешнего энергетического уровня ns 1 .
2.2.1. Характерные химические свойства щелочных металлов.
У атомов ЩМ на внешнем электронном уровне находится только один электрон на s-подуровне, легко отрывающийся при протекании химических реакций. При этом из нейтрального атома ЩМ образуется положительно заряженная частица – катион с зарядом +1:
Семейство ЩМ является наиболее активным среди прочих групп металлов в связи с чем в природе обнаружить их в свободной форме, т.е. в виде простых веществ невозможно.
Простые вещества щелочные металлы являются крайне сильными восстановителями.
Взаимодействие щелочных металлов с неметаллами
Щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их требуется хранить под слоем какого-либо углеводородного растворителя, такого как, например, керосина.
Взаимодействие ЩМ с кислородом приводит к разным продуктам. С образованием оксида, с киcлородом реагирует только литий:
Натрий в аналогичной ситуации образует с кислородом пероксид натрия Na2O2:
а калий, рубидий и цезий – преимущественно надпероксиды (супероксиды), общей формулы MeO2:
Щелочные металлы активно реагируют с галогенами, образуя галогениды щелочных металлов, имеющих ионное строение:
2Li + Br2 = 2LiBr бромид лития
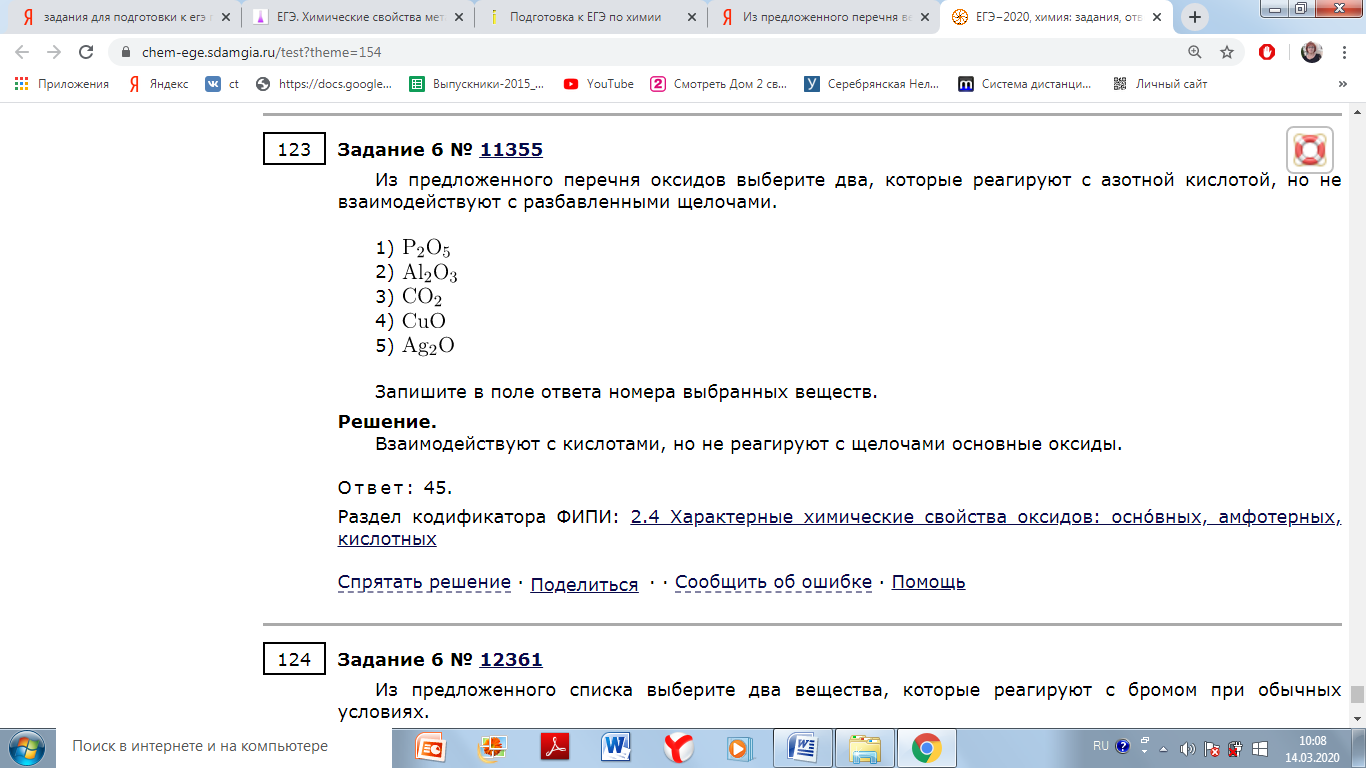
2Na + I2 = 2NaI иодид натрия
2K + Cl2 = 2KCl хлорид калия
с азотом
Литий реагирует с азотом уже при обычной температуре, с остальными же ЩМ азот реагирует при нагревании. Во всех случаях образуются нитриды щелочных металлов:
с фосфором
Щелочные металлы реагируют с фосфором при нагревании, образуя фосфиды:
3Na + P = Na3Р фосфид натрия
3K + P = K3Р фосфид калия
Нагревание щелочных металлов в атмосфере водорода приводит к образованию гидридов щелочных металлов, содержащих водород в редкой степени окисления – минус 1:
Н2 + 2K = 2KН -1 гидрид калия
Н2 + 2Rb = 2RbН гидрид рубидия
с серой
Взаимодействие ЩМ с серой протекает при нагревании с образованием сульфидов:
S + 2Na = Na2S сульфид натрия
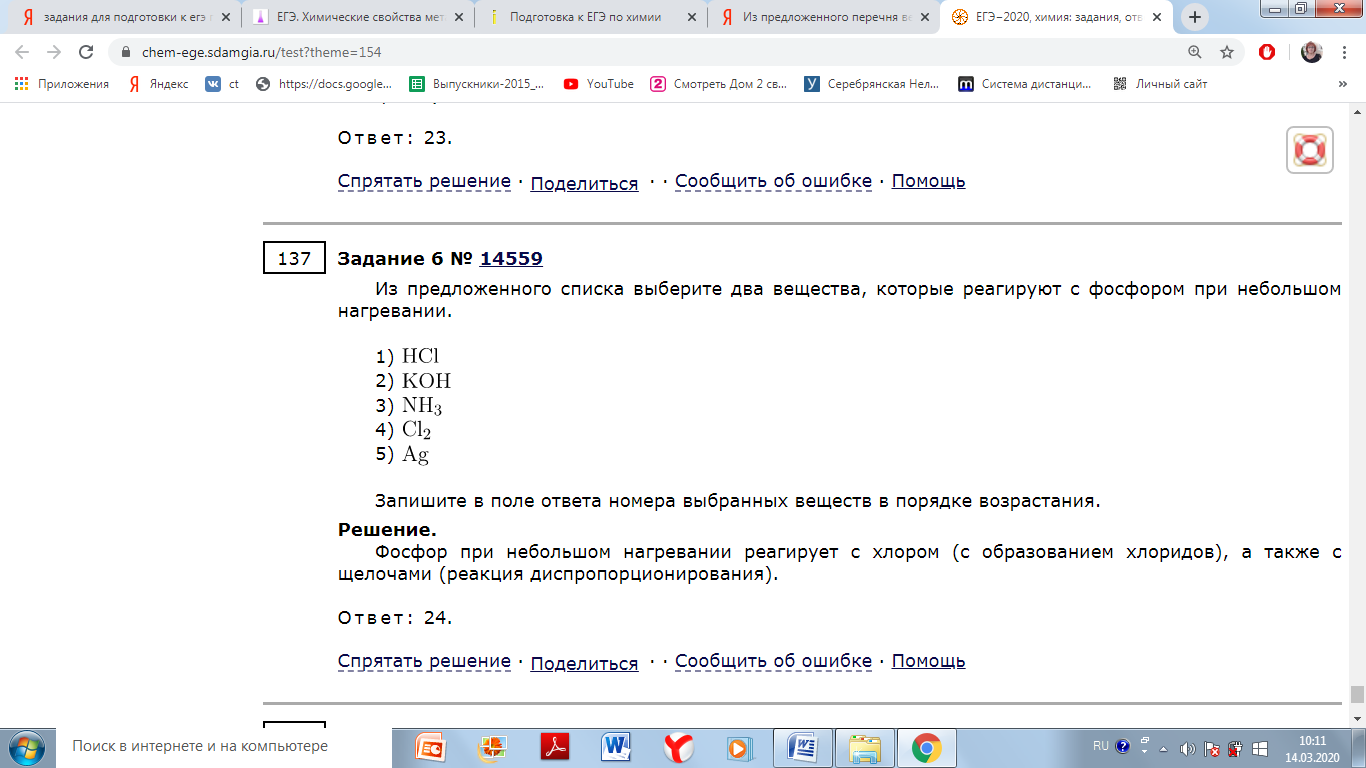
Взаимодействие щелочных металлов со сложными веществами
Все ЩМ активно реагируют с водой с образованием газообразного водорода и щелочи, из-за чего данные металлы и получили соответствующее название:
2HOH + 2Na = 2NaOH + H2↑
2K + 2HOH = 2KOH + H2↑
Литий реагирует с водой довольно спокойно, натрий и калий самовоспламеняются в процессе реакции, а рубидий, цезий и франций реагируют с водой с мощным взрывом.
с галогенпроизводными углеводородов (реакция Вюрца):
со спиртами и фенолами
ЩМ реагируют со спиртами и фенолами, замещая водород в гидроксильной группе органического вещества:
ОВР СО ЩЕЛОЧНЫМИ МЕТАЛЛАМИ И ИХ СОЕДИНЕНИЯМИ
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам - и азотной, и азотистой.
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
Подобная схема универсальная для брома и для йода. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO + NaI + H2O (без нагревания)
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)
Металл – восстановитель, отдаёт электроны
Пероксид, надпероксид окислители
4KO2 + 2CO2 → 2K2CO3 + 3O2 с кислотными оксидами образуются соли
Na2O2 + 2H2O → 2NaOH + H2O2 вода превращается с перекись, образуется щелочь
Соли калия – хроматы и бихроматы- сильные окислители – используются в ОВР
Взаимопревращение хроматов и дихроматов
Оксиду хрома (VI) соответствуют сразу две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7, Хромат калия K2CrO4и дихромат калия K2Cr2O7– соли этих кислот. Хроматы – желтого цвета, дихроматы – оранжевого. В кислой среде хромат-ион превращается в дихромат-ион. В присутствии щелочи дихроматы снова становятся хроматами. Хромат калия превращаем в дихромат, добавляя кислоту. Желтый раствор становится оранжевым.
В стакан с дихроматом калия добавляем щелочь, оранжевый раствор становится желтым – дихроматы превращаются в хроматы.
1. При пропускании сероводорода через подкисленный серной кислотой раствор дихромата оранжевая окраска раствора переходит в зелёную и одновременно жидкость становится мутной вследствие выделения серы:
2. При действии концентрированной соляной кислоты на дихромат калия выделяется хлор и получается зелёный раствор, содержащий хлорид хрома (III):
3. Если пропускать диоксид серы через концентрированный раствор дихромата калия, содержащий достаточное количество серной кислоты, то образуются эквимолекулярные количества сульфатов калия и хрома (III):
Вопросы и задания
А. Калий обладает более выраженными металлическими свойствами, чем магний.
Б. Оксид натрия проявляет более выраженные основные свойства, чем оксид алюминия.
Решение.
Основные свойства оксидов и гидроксидов и металлические свойства элементов усиливаются по периоду справа налево и по группе сверху вниз, поэтому оба утверждения верны.
Все щелочные металлы взаимодействуют с водой при обычной температуре.
Б. Высшие оксиды металлов IA группы имеют состав .R2O
Высшие оксиды металлов IA группы действительно имеют состав.

Из предложенного перечня выберите две пары веществ, которые взаимодействуют с водой при обычной температуре.
1) магний и углерод
2) фтор и натрий
3) калий и стронций
4) азот и алюминий
5) железо и серебро
Натрий и калий — щелочные металлы, стронций — щелочноземельный, при обычных условиях взаимодействуют с водой с образованием щелочи и водорода. Фтор активно реагирует с водой с образованием кислорода.
Из предложенного перечня выберите два вещества, которые реагируют с серой и азотом.
Азот — малореакционоспособное соединение. Среди представленных вариантов он реагирует только с магнием и литием при нагревании с образованием нитрида магния.
Из предложенного перечня выберите два вещества, при взаимодействии которых с водой образуется щёлочь.
Только гидроксид бария и натрия растворимы в воде, поэтому только при взаимодействии воды с барием или натрием образуется щелочь.
Из предложенного перечня выберите два вещества, которые при взаимодействии с водой не образуют щёлочь.
Гидроксид магния малорастворим, поэтому не является щелочью, а серебро с водой не реагирует.
Из предложенного перечня выберите два вещества, которые с щелочами не взаимодействуют.
Алюминий — амфотерный металл, реагирует со щелочами.
Натрий — щелочной металл с щелочами не реагирует.
Бром — диспропорционирует в щелочи.
Сера также диспропорционирует с образованием сульфита и сульфида металла.
Магний — типичный металл, со щелочью не реагирует.
Из предложенного перечня выберите два вещества, которые взаимодействуют с щелочами.
Среди перечисленных веществ со щелочью реагирует только сера и алюминий — сера диспропорционирует с образованием сульфита и сульфида металла, а алюминий является амфотерным металлом, который реагирует со щелочами.







Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид цинка.
1) гидроксид натрия
2) оксид серы (VI)
3) оксид азота (II)
5) сульфат калия
Оксид цинка как амфотерный оксид будет реагировать с щелочами и кислотными оксидами.
Из предложенного перечня простых веществ выберите два, которые реагируют c щелочами при обычных условиях.
Хлор (2) реагирует с щелочами с образованием смеси солей хлорноватистой и соляной кислот.
Алюминий (3) — амфотерный металл — легко реагирует с щелочами.
Из предложенного списка реактивов выберите два, которые способны растворить фосфор.
2) разбавленная соляная кислота
3) концентрированная азотная кислота
4) концентрированная щёлочь
5) насыщенный раствор хлорида натрия
В воде фосфор не растворяется. Но его легко растворяют концентрированная азотная кислота и концентрированная щелочь.
Из предложенного списка выберите два вещества, которые реагируют с бромом в обычных условиях.
2) раствор гидроксида калия
4) соляная кислота
5) углекислый газ
Бром при обычных условиях реагирует с сероводородом, так как является активнее серы, а так же реагирует с растворами щелочей.
Из предложенного перечня выберите два простых вещества, которые реагируют с щелочами.
Фтор, хлор и другие галогены, реагируют со щелочами, состав продуктов зависит от температуры.
Из предложенного перечня выберите два вещества, которые могут реагировать и с соляной кислотой, и с раствором гидроксида натрия.
Алюминий и цинк — амфотерные металлы, поэтому реагируют и с кислотами и со щелочами.
Из предложенного перечня выберите два вещества, которые взаимодействуют с раствором гидроксида лития.
С этой щелочью будет реагировать цинк и алюминий.
Из предложенного перечня простых веществ выберите два, которые реагируют с раствором щёлочи при обычных условиях.
Разберём каждый вариант.
1. Бром реагирует с щелочами, как и другие галогены, с образованием соли.
2. Азот химически инертен.
3. С щелочами категорически не вступает в реакцию.
4. Медь малоактивный металл, не являющийся амфотерным, реагирует с концентрированными кислотами, но не с щелочами.
5. Алюминий амфотерный, вступает в реакцию с щелочами, образуя комплексную соль.
Из предложенного списка простых веществ выберите два, которые реагируют с разбавленными растворами щелочей при обычных условиях.
С разбавленными растворами щелочей реагируют амфотерные металлы, их оксиды и гидроксиды, также галогены, кислотные оксиды и кислоты, соли (если образуется газ, вода или осадок).
Из предложенного перечня выберите два вещества, которые образуют щёлочь при взаимодействии с водой.
Только гидроксид калия и кальция растворимы в воде, поэтому только при взаимодействии воды с калием или кальцием образуется щелочь.
Цинк — металл, соединения которого проявляют амфотерные свойства, реагирует со щелочами.
Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

- Li - 2s 1
- Na - 3s 1
- K - 4s 1
- Rb - 5s 1
- Cs - 6s 1
- Fr - 7s 1
Природные соединения
- NaCl - галит (каменная соль)
- KCl - сильвин
- NaCl*KCl - сильвинит

Получение
Получить такие активные металлы электролизом водного раствора - невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно - безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий - пероксид, калий, рубидий и цезий - супероксиды.
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда - взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH - натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: ". в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет". Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий - в желтый, калий - в фиолетовый, рубидий - синевато-красный, цезий - синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание - реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание - мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам - растворимым основаниям. Наиболее известные представители: NaOH - едкий натр, KOH - едкое кали.
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде - хлор)

Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке - получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке - получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 - получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 - получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов - смешанных оксидов (при высоких температурах - прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел - смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
