Вытеснение металла из раствора соли
Обновлено: 18.09.2024
Металлы в химических реакциях всегда восстановители. Восстановительную активность металла отображает его положение в электрохимическом ряду напряжений.
На основании ряда можно сделать следующие выводы:
1. Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
2. Каждый металл способен вытеснять из солей в растворе те металлы, которые стоят правее
3. Металлы, находящиеся в ряду напряжений левее водорода способны вытеснять его из кислот.
Zn + 2HCl → ZnCl2 + H2
4. Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные) в любых водных растворах прежде сего реагируют с водой.
Восстановительная способность металла, определённая по электрохимическому ряду не всегда соответствует его положению в периодической системе т.к в ряду напряжений учитывается не только радиус атома, но и энергия отрыва электронов.
Альдегиды, их строение и свойства. Получение, применение муравьиного и уксусного альдегидов.
Альдегиды – это органические соединения, в состав молекулы которых входит карбонильная группа, соединённая с водородом и углеводородным радикалом.
Физические свойства
Метаналь – газообразное вещество, водный раствор – формалинь
Химические свойства
Реактивом на альдегиды является Cu(OH)2
Применение
Наибольшее применение имеют метаналь и этаналь. Большое количество метаналя используется для получения фенолформальдегидной смолы, которую получают при взаимодействии метаналя с фенолом. Эта смола необходима для производства различных пластмасс. Пластмассы изготовлены для из фенолформальдегидной смолы в сочетании с различными наполнителями, называются фенопластами. При растворении фенолформальдегидной смолы в ацетоне или спирту получают различные лаки. При взаимодействии метаналя с карбамидом CO(NH2)2 получают карбидную смолу, а из нее – аминопласты. Из этих пластмасс изготавливают микропористые материалы для нужд электротехники.Метаналь идёт так же на производство некоторых лекарственных веществ и красителей. Широко применяется водный раствор, содержащий в массовых долях 40% метаналя. Он называетсяформалином. Его использование основано на свойстве свёртывать белок.
Получение
Альдегиды получают окислением алканов и спиртов. Этаналь получают гидротациейэтина и окислением этена.
Билет №12
Высшие оксиды химических элементов третьего периода. Закономерности в измерении их свойств в связи с положением химических элементов в периодической системе. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых является кислород со степенью окисления «-2»
С увеличением степени окисления элементов, увеличиваются кислотные свойства оксидов.
Na2O, MgO – основные оксиды
Al2O3 – амфотерный оксид
Основные оксиды реагируют с кислотами с образованием соли и воды.
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием щёлочи.
Na2O + HOH → 2NaOH
Основные оксиды реагируют с кислотными оксидами с образованием соли.
Na2O + SO2 → Na2SO3
Кислотные оксиды реагируют со щелочами с образованием соли и воды
Реагирует с водой, с образованием кислоты
Амфотерные оксиды реагируют с кислотами и щелочами
Жиры, их свойства и состав. Жиры в природе, превращение жиров в организме. Продукты технической переработки жиров, понятие о синтетических моющих средствах. Защита природы от загрязнения СМС.
Жиры – это сложные эфиры глицерина и карбоновых кислот.
Общая формула жиров:
Твёрдые жиры образованы преимущественно высщими предельными карбоновыми кислотами – стеариновой C17H35COOH, пальмитиновой C15H31COOH и некоторыми другими. Жидкие жиры образованы главным образом высшими непредельными карбоновыми кислотами – олеиновойC17H33COOH, ленолевойC17H31COOH
Жиры наряду с углеводородами и белками входят в состав организмов животных и растений. Они являются важной составной частью пищи человека и животных. При окислении жиров в организме выделяется энергия. Когда в органы пищеварения поступают жиры, то под влиянием ферментов они гидролизуются на глицерин и соответствующие кислоты.
Продукты гидролиза всасываются ворсинками кишечника, а затем синтезируется жир, но уже свойственный организм. Потоком крови жиры переносятся в другие органы и ткани организма, где накапливаются или снова гидролизуются и постепенно окисляются до оксида углерода (IV) и воды.
Физические свойства.
Животные жиры в большинстве случаев твёрдые вещества, но встречаются и жидкие (рыбий жир). Растительные жиры чаше всего жидкие вещества – масла; известны и твёрдые растительные жиры – кокосовое масло.
Химические свойства.
Жиры в животных организмах в присутствии ферментов гидролизуются. Кроме реакций с водой, жиры взаимодействуют со щелочами.
В состав растительных масел входят сложные эфиры непредельных карбоновых кислот, то их можно подвергнуть гидрированию. Они превращаются в предельные соединения
Пример: Из растительного масла в промышленности получают маргарин.
Применение.
Жиры в основном применяют в качестве пищевого продукта. Раньше жиры использовали для получения мыла
Синтетические моющие средства.
Синтетические моющие средства оказывают вредное действие на окружающую среду, т.к. они устойчивы и с трудом подвергаются разрушению.
Химические свойства металлов
Металлы занимают в Периодической таблице левый нижний угол. Металлы относятся к семействам s-элементов, d-элементов, f-элементов и частично – р-элементов.
Самым типичным свойством металлов является их способность отдавать электроны и переходить в положительно заряженные ионы. Причём металлы могут проявлять только положительную степень окисления.
1. Взаимодействие металлов с неметаллами.
а) Взаимодействие металлов с водородом.
С водородом непосредственно реагируют щелочные и щелочноземельные металлы, образуя гидриды.
Например:
Образуются нестехиометрические соединения с ионной кристаллической структурой.
б) Взаимодействие металлов с кислородом.
Все металлы за исключением Au, Ag, Pt окисляются кислородом воздуха.
Пример:
в) Взаимодействие металлов с галогенами.
Все металлы реагируют с галогенами с образованием галогенидов.
Пример:
В основном это ионные соединения: MeHaln
г) Взаимодействие металлов с азотом.
С азотом взаимодействуют щелочные и щелочноземельные металлы.
д) Взаимодействие металлов с углеродом.
Соединения металлов и углерода – карбиды. Они образуются при взаимодействии расплавов с углеродом. Активные металлы образуют с углеродом стехиометрические соединения:
Металлы – d-элементы образуют соединения нестехиометрического состава типа твердых растворов: WC, ZnC, TiC – используются для получения сверхтвёрдых сталей.
2. Взаимодействие металлов с водой.
С водой реагируют металлы, имеющие более отрицательный потенциал, чем окислительно-восстановительный потенциал воды.
Активные металлы более активно реагируют с водой, разлагая воду с выделением водорода.
Менее активные металлы медленно разлагают воду и процесс тормозится из-за образования нерастворимых веществ.
3. Взаимодействие металлов с растворами солей.
Такая реакция возможна, если реагирующий металл активнее, чем находящийся в соли:
Металл, обладающий более отрицательным или менее положительным стандартным электродным потенциалом, вытесняет другой металл из раствора его соли.
4. Взаимодействие металлов с растворами щелочей.
Со щелочами могут взаимодействовать металлы, дающие амфотерные гидрооксиды или обладающие высокими степенями окисления в присутствии сильных окислителей. При взаимодействии металлов с растворами щелочей, окислителем является вода.
1 Zn 0 + 4OH – – 2e = [Zn(OH)4] 2– окисление
Zn 0 – восстановитель
1 2H2O + 2e = H2 + 2OH – восстановление
Металлы, обладающие высокими степенями окисления, могут взаимодействовать со щелочами при сплавлении:
5. Взаимодействие металлов с кислотами.
Это сложные реакции, продукты взаимодействия зависят от активности металла, от вида и концентрации кислоты и от температуры.
По активности металлы условно делятся на активные, средней активности и малоактивные.
Кислоты условно делятся на 2 группы:
I группа – кислоты, обладающие невысокой окислительной способностью: HCl, HI, HBr, H2SO4(разб.), H3PO4, H2S, окислитель здесь H + . При взаимодействии с металлами выделяется кислород (H2↑). С кислотами первой группы реагируют металлы, обладающие отрицательным электродным потенциалом.
II группа – кислоты, обладающие высокой окислительной способностью: H2SO4(конц.), HNO3(разб.), HNO3(конц.). В этих кислотах окислителями являются анионы кислоты: . Продукты восстановления аниона могут быть самыми разнообразными и зависят от активности металла.
H2S↑ – c активными металлами
H2SO4 +6е S 0 ↓ – с металлами средней активности
SO2↑ – c малоактивными металлами
HNO3 +4,5e N2O, N2 – с металлами средней активности
NO – c малоактивными металлами
HNO3(конц.) – NO2↑ – c металлами любой активности.
Если металлы обладают переменной валентностью, то с кислотами I группы металлы приобретают низшую положительную степень окисления: Fe → Fe 2+ , Cr → Cr 2+ . При взаимодействии с кислотами II группы – степень окисления +3: Fe → Fe 3+ , Cr → Cr 3+ , при этом никогда не выделяется водород.
Некоторые металлы (Fe, Cr, Al, Ti, Ni и др.) в растворах сильных кислот, окисляясь, покрываются плотной оксидной плёнкой, которая защищает металл от дальнейшего растворения (пассивация), но при нагревании оксидная плёнка растворяется, и реакция идёт.
Малорастворимые металлы, обладающие положительным электродным потенциалом, могут растворяться в кислотах I группы, в присутствии сильных окислителей.
Металлы в растворе собственной соли.
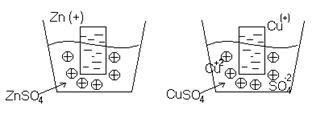
Количество ионов, которые будут взаимодействовать с раствором соли, будет меньше, т.к. соль уже содержит некоторое количество ионов этого металла.
Т.е. имеет большое значение какой металл и какая концентрация металла в соли, поведение металла.
Например: медь из раствора соли перейдет в электрод, т.е. имеются в виду положительные ионы.
Гальванический элемент – любое устройство, позволяющее получать электрический ток, за счет протекания химических реакций.
Гальваническая цепь – последовательная совокупность скачков потенциала на границе раздела фаз.
Максимальная разность потенциалов, отвечающая обратимому протеканию химической реакции – ЭДС (Е)
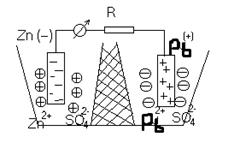 |
Каждые два металла, будучи погруженными в растворы их солей, которые сообщаются между собой посредством сифона, заполненного электролитом, образуют гальванический элемент. Пластинки металлов, погруженные в растворы, называются электродами элемента.
Если соединить наружные концы электродов (полюсы элемента) проволокой, то от металла, у которого величина потенциала меньше, начинают перемещаться электроны к металлу, у которого она больше (например, от Zn к Pb). Уход электронов нарушает равновесие, существующее между металлом и его ионами в растворе, и вызывает переход в раствор нового количества ионов – металл постепенно растворяется. В то же время электроны, переходящие к другому металлу, разряжают у его поверхности находящиеся в растворе ионы - металл выделяется из раствора.
Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление, называется катодом.
В свинцово-цинковом элементе цинковый электрод является анодом, а свинцовый – катодом.
Таким образом, в замкнутом гальваническом элементе происходит взаимодействие между металлом и раствором соли другого металла, не соприкасающимися непосредственно друг с другом. Атомы первого металла, отдавая электроны, превращаются в ионы, а ионы второго металла, присоединяя электроны, превращаются в атомы. Первый металл вытесняет второй из раствора его соли. Например, при работе гальванического элемента, составленного из цинка и свинца, погруженных соответственно в растворы Zn(NO3)2 и Pb(NO3)2 у электродов происходят следующие процессы:
Суммируя оба процесса, получаем уравнение Zn + Pb 2+ ↔ Pb + Zn 2+ , выражающее происходящую в элементе реакцию в ионной форме. Молекулярное уравнение той же реакции будет иметь вид:
Электродвижущая сила гальванического элемента равна разности потенциалов двух его электродов. При определении его всегда вычитают из большего потенциала меньший. Например, электродвижущая сила (Э.д.с.) рассмотренного элемента равна:
| Э.д.с. = | -0,13 | – | (-0,76) | = 0,63 v |
| EPb | EZn |
Такую величину она будет иметь при условии, что металлы погружены в растворы, в которых концентрация ионов равна 1 г-ион/л. При других концентрациях растворов величины электродных потенциалов будут несколько иные. Их можно вычислить по формуле:
E = E 0 + (0,058 / n) • lgC уравнение Нернста
или E = E 0 + • lgC
где E - искомый потенциал металла (в вольтах)
E 0 - его нормальный потенциал
n - валентность металла (зарядность иона)
С - концентрация ионов в растворе (г-ион/л)
F – число Фарадея
R – универсальная газовая постоянная
Т – температура по абсолютной шкале
Пример:
Найти электродвижущую силу элемента (э. д. с.) образованного цинковым электродом, опущенным в 0,1 М раствор Zn(NO3)2 и свинцовым электродом, опущенным в 2 М раствор Pb(NO3)2.
Решение:
Вычисляем потенциал цинкового электрода:
EZn = -0,76 + (0,058 / 2) lg 0,1 = -0,76 + 0,029 • (-1) = -0,79 v
Вычисляем потенциал свинцового электрода:
EPb = -0,13 + (0,058 / 2) lg 2 = -0,13 + 0,029 • 0,3010 = -0,12 v
Находим электродвижущую силу элемента:
Э. д. с. = -0,12 – (-0,79) = 0,67 v
Электролиз
Совокупность окислительно-восстановительных реакций, которые протекают на электродах в растворах или расплавах электролитов при пропускании через них электрического тока, называют электролизом.
Сущность электролиза заключается в том, что при пропускании тока через раствор электролита (или расплавленный электролит) положительно заряженные ионы перемещаются к катоду, а отрицательно заряженные – к аноду. Достигнув электродов, ионы разряжаются, в результате чего у электродов выделяются составные части растворенного электролита или водород и кислород из воды.
Для перевода различных ионов в нейтральные атомы или группы атомов требуется различное напряжение электрического тока. Одни ионы легче теряют свои заряды, другие труднее. Степень легкости, с которой разряжаются (присоединяют электроны) ионы металлов, определяется положением металлов в ряду напряжений.
На катоде источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является “восстановителем”. На аноде происходит отдача электронов анионами, поэтому анод является “окислителем”.
При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы.
При проведении электролиза с использованием инертного (нерасходуемого) анода (например, графита или платины), как правило, конкурирующими являются два окислительных и два восстановительных процесса:
на аноде — окисление анионов и гидроксид-ионов,
на катоде — восстановление катионов и ионов водорода.
При проведении электролиза с использованием активного (расходуемого) анода процесс усложняется и конкурирующими реакциями на электродах являются:
на аноде — окисление анионов и гидроксид-ионов, анодное растворение металла — материала анода;
на катоде — восстановление катиона соли и ионов водорода, восстановление катионов металла, полученных при растворении анода.
При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии. При использовании инертных электродов используют следующие правила:
1. На аноде могут образовываться следующие продукты:
а) при электролизе растворов, содержащих в своем составе анионы F - , SO4 2- , NО3 - , РО4 3- (если электролизу подвергается соль кислородсодержащей кислоты или сама кислота, то разряжаются гидроксильные ионы, а не ионы кислородных остатков), а также растворов щелочей выделяется кислород Образующиеся при разряде гидроксильных ионов нейтральные группы ОН - тотчас же разлагаются по уравнению:
4OH- ® 2H2O + O2В результате у анода выделяется кислород.
б) при окислении анионов Сl - , Вr - , I - выделяются соответственно хлор, бром, иод;
в) при окислении анионов органических кислот происходит процесс:
2. При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений левее Аl 3+ , на катоде выделяется водород; если ион расположен в ряду напряжений правее водорода, то на катоде выделяется металл. Чем левее стоит металл в ряду напряжений, чем больше его отрицательный потенциал (или меньше положительный потенциал), тем труднее при прочих равных условиях разряжаются его ионы (легче всего разряжаются ионы Аu 3+ , Ag + ; труднее всегоLi + , Rb + , K + ).
Если в растворе одновременно находятся ионы нескольких металлов, то в первую очередь разряжаются ионы того металла, у которого отрицательный потенциал меньше (или положительный – больше). Например, из раствора, содержащего ионы Zn 2+ и Cu 2+ , сперва выделяется металлическая медь. Но величина потенциала металла зависит также и от концентрации его ионов в растворе; точно также изменяется и легкость разряда ионов каждого металла в зависимости от их концентрации: увеличение концентрации облегчает разряд ионов, уменьшение – затрудняет. Поэтому при электролизе раствора, содержащего ионы нескольких металлов может случиться, что выделение более активного металла будет происходить раньше, чем выделение менее активного (если концентрация ионов первого металла значительна, а второго – очень мала).
3. При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений между Al + и Н + , на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода. Только при электролизе солей натрия, кальция и других металлов до алюминия включительно разряжаются ионы водорода и выделяется водород.
Рассмотрим в качестве примера электролиз водного раствора хлорида меди на инертных электродах. В растворе находятся ионы Сu 2+ и 2Сl - , которые под действием электрического тока направляются к соответствующим электродам:
На катоде выделяется металлическая медь, на аноде — газообразный хлор.
Если в рассмотренном примере электролиза раствора CuCl2 в качестве анода взять медную пластинку, то на катоде выделяется медь, а на аноде, где происходят процессы окисления, вместо разрядки ионов Сl - и выделения хлора протекает окисление анода (меди). В этом случае происходит растворение самого анода, и в виде ионов Си он переходит в раствор. Электролиз CuCl2 с растворимым анодом можно записать так:
Электролиз растворов солей с растворимым анодом сводится к окислению материала анода (его растворению) и сопровождается переносом металла с анода на катод. Это свойство широко используется при рафинировании (очистке) металлов от загрязнений.
Электролиз раствора хлорида никеля NiCl2
Раствор содержит ионы Ni 2+ и Cl - , а также в ничтожной концентрации ионы Н + и ОН - . При пропускании тока ионы Ni 2+ перемещаются к катоду, а ионы Cl - – к аноду. Принимая от катода по два электрона, ионы Ni 2+ превращаются в нейтральные атомы, выделяющиеся из раствора. Катод постепенно покрывается никелем.
Ионы хлора,достигая анода, отдают ему электроны и превращаются в атомы хлора, которые, соединяясь попарно, образуют молекулы хлора. У анода выделяется хлор.
Таким образом, у катода происходит процесс восстановления, у анода – процесс окисления.
Разделение и осаждение металлов, получение конечных продуктов
Наиболее распространенные методы разделения и выделения металлов и их соединений из растворов — осаждение (электролиз, цементация, перевод в нерастворимые соединения, кристаллизация), сорбция, экстракция. Выбор наиболее рационального метода должен производиться в каждом отдельном случае с учетом ряда факторов, из которых первостепенное значение имеют состав поступающего на осаждение раствора и требования, предъявляемые к чистоте конечной продукции. Например, в медной промышленности применяют электролиз для переработки богатых растворов и цементацию меди — для осаждения меди при концентрации менее 15 г/л [20, 76].
Осаждение металлов производят электролизом, цементацией, восстановлением соединений до металла водородом, разложением комплексных солей.
Электролиз используют для извлечения металлов из очищенных растворов после выщелачивания (электроосаждение) и для получения чистых металлов из черновых продуктов (электрорафинирование). Этот метод получил широкое применение в гидрометаллургии меди, цинка, кадмия и марганца.
При цементации вытеснение ионов одного металла из растворов его солей производя ионами другого металла, расположенного выше в ряду напряжений (более электроотрицательного). Медь цементируют железом; или чугунной стружкой, железным скрапом губчатым железом, обезоловяненными консервными банками; золото — цинковой стружкой, цинковой и алюминиевой пылью; кадмий — цинковой пылью, никель —
кобальтовым порошком. Цементацию металлов производят в различных. аппаратах периодического или непрерывного действия (конусах барабанах, желобах, чанах, ваннах, аппаратах кипящего слоя).
Кроме того, никель, кобальт и медь осаждают из аммиачных растворов восстановлением их до металла водородом под давлением 3,5—5 МПа.
Осаждение меди или никеля из аммиачных растворов производят также разложением образовавшихся при выщелачивании комплексных углеаммониевых солей этих металлов. Медь осаждается в виде черной окиси меди, а никель — в виде карбоната. В результате дистилляции получают газообразный амиак и углекислоту, которые улавливают и вновь используют в процессе.
Часто металлы осаждаются в виде нерастворимых соединений: гидроокисей, сульфидов, ксантогенатов, карбонатов, вольфраматов, молибдатов и др. При оптимальном рН среды можно практически полностью отделить молибден от вольфрама в виде сульфида из растворов, содержащих вольфрамат натрия тиосоединения молибдена. Большое распространение в гидрометаллургических процeccax получил гидролиз, при котором возможно селективное осаждение некоторых металлов в виде гидроокисей иди основных шей.
При кристаллизации значительная часть извлекаемого металла осаждается в результате упарки и охлаждения раствора или изменения рН среды. Таким образом выделяют из раствора сульфат натрия при хлорирующем обжиге пиритных огарков и сульфат марганца при сернокислотном выщелачивании марганцевых руд. В вольфрамовой и молибденовой промышленности кристаллизацию применяют для получения чистых вольфрамата и молибдата аммония, содержание вредных примесей в которых не должно превышать тысячных долей процента.
В некоторых случаях, особенно при получении полупроводниковых соединений редких металлов, требуется, чтобы суммарное содержание всех примесей не превышало 0,05—0,1%. Поэтому полученные соединения перечищают (растворяют или разлагают их, затем повторно осаждают, часто завершающей стадией осаждения является электролиз, кристаллизация или восстановление до металла водородом).
Сорбционные и экстракционные методы извлечения металлов из растворов для значительного повышения концентрации их и очистки от вредных примесей получили широкое распространение в технологии урановых, золотосодержащих, вольфрамовых, молибденовых, медных и редко-метальных руд [20, 46, 92].
В качестве сорбентов применяют иониты— вещества, способные к обмену ионами с окружающим раствором и практически не растворимые в применяемых в гидрометаллургии растворителях. В зависимости от характера обмениваемых ионов эти вещества делят на катиониты и аниониты.
Наибольшее распространение получила сорбция осветленных растворов в колонках с неподвижным слоем ионита. Однако в урановой и золотодобывающей промышленности успешно внедрена сорбция металла ионитами из жидкой фазы пульпы — бесфильтрационная сорбция. Возможность применения такого способа определяется значительной разницей в крупности ионита и выщелачиваемого материала, что позволяет отделить ионит пропусканием пульпы через сито с отверстиями соответствующего размера. При осуществлении такого варианта ионообменного процесса значительно упрощается и делается более экономичной технологическая схема вследствие исключения операций предварительного фильтрования пульпы. Весьма эффективно совмещение йоннообменной сорбции с выщелачиванием из руды полезных компонентов (ионообменное выщелачивание), позволяющее значительно повысить технико-экономические показатели гидрометаллургического процесса.
Для последующей десорбции металлов из ионитов (элюирование) применяют растворы различных реагентов — нитрата аммоний или натрия, хлористого натрия, аммиака, едкого натра, углекислого натрия, минеральных кислот и др.
Во многих случаях сорбция металлов характеризуется высокими технологическими показателями. Так, емкость анионита по урану составляет 30—50 кг/м 3 смолы в набухшем состоянии, извлечение металла из раствора достигает 98—99,8 %, На 1 м 3 загруженной смолы сорбируется 12—23 кг урана в сутки. Еще более высокая емкость получена по вольфраму и молибдену — до 160 кг/м 3 анионита.
Продолжительность использования ионообменных сорбентов во многих случаях определяется постепенным снижением их емкости вследствие частичного «отравления» ионитов, образования инертных пленок и разрушения обменных групп. Кроме того, неизбежны механические потери ионитов. Например, после двух лет работы опытной установки, на которой уран извлекался непосредственно из пульпы, общие потери ионита вследствие истирания составили 23 %, а емкость уменьшилась на 10 %. Скорость поглощения и элюирования осталась прежней.
В качестве сорбента применяют также активированный уголь, главным образом для сорбции золота и серебра из цианистых растворов.
Очистка растворов от мышьяка и сурьмы, коллоидальной серы и некоторых других вредных примесей осуществляется сорбцией их гидратом окиси железа.
Все большее значение в гидрометаллургии приобретают экстракционные процессы, при которых водный раствор солей металлов вступает в контакт с несмешивающейся с водой органической жидкостью, извлекающей определенные металлы из исходного раствора в виде комплексных соединений. Эффективность экстракционного процесса количественно характеризуется коэффициентом распределения извлекаемого металла
где Y — концентрация металла в органической фазе; X — то же, в водной фазе.
Практически процесс экстракции может быть реализован при коэффициенте распределения металла не менее 0,3—0,5. Высокое извлечение или практически полное разделение металлов достигается при условии противоточного осуществления процесса, когда операция экстракции повторяется многократно.
В ряде случаев при экстракции достигается высокая селекция металлов из растворов, позволяющая осуществить разделение весьма близких по химическим свойствам элементов.
В качестве экстрагентов используют амины, кетоны, карбоновые кислоты, спирты, эфиры, фосфорсодержащие соединения.. В качестве растворителей экстрагентов (разбавителей) применяют углеводороды и их хлорпроизводные.
После отделения органической фазы от водной производится реэкстракцкя металла обработкой органической фазы щелочным или кислым раствором, а иногда только водой. В реэкстракте можно получить концентрацию извлекаемых элементов во много раз выше, чем в исходном растворе.
Экстракцию широко применяют в урановой промышленности. В настоящее время значительные успехи по экстракции достигнуты также в технологии извлечения и очистки многих редких и некоторых цветных металлов — меди, никеля, кобальта, тантала, ниобия, вольфрама, молибдена, рения, индия, германия, гафния и др.
В промышленности для экстракции применяют смесители, отстойники, колонны с насадкой, тарельчатые колонны с пульсацией, центробежные экстракторы и т. д.

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Читайте также:
