Явление полиморфизма в металлах
Обновлено: 08.05.2024
В металловедении под полиморфизмом понимают любые изменения в кристаллографической форме решётки материала. Поэтому аллотропическое или полиморфное превращение играет важную роль в свойствах и использовании металлов, склонных к подобным изменениям.
Суть явления
Полиморфные превращения происходят в ответ на изменения внешних факторов – температуры, давления, либо того и другого вместе.
Так, например, происходит с углеродом, который встречается в двух различных полиморфных формах- графита с гексагональной структурой и алмаза - с изометрической. Вещество FeS2 чаще всего встречается в виде пирита с изометрической структурой, но оно также может иметь ромбическое внутреннее расположение, и тогда его называют марказитом. Существуют и другие примеры.
Свойства вещества определяются не только его химическим составом, но и геометрией составляющих атомов и ионов, а также природой связывающих их электрических сил.
Большинство минералов представляют собой соединения, состоящие из двух или более элементов; их формулы получены на основе количественного химического анализа и указывают относительные пропорции составляющих элементов. Поэтому наблюдаются значительные вариации в ионах, которые занимают определенные атомные позиции в их структуре. Например, содержание железа в родохрозите (MnCO3) может варьироваться в широких пределах, поскольку двухвалентное железо (Fe 2+ ) замещает катионы марганца (Mn 2+ ) в структуре родохрозита.
Поэтому формула данного минерала может быть дана в более общих терминах, а именно (Mn, Fe) CO3. Она показывает, что, хотя количество марганца и железа меняется, но отношение катиона к отрицательно заряженной анионной группе остается фиксированным: один атом Mn 2+ или Fe 2+ к одной группе CO3. Такое изменение является результатом замены одного иона или ионной группы другим в конкретной структуре. Это явление называется ионным замещением или твердым раствором. Возможны три типа твердого раствора:
- замещающий;
- промежуточный;
- упущенный.
Замещающий твердый раствор является наиболее распространенной разновидностью: пример с родохрозитом это подтверждает. Однако на степень замещения могут влиять и другие факторы, наиболее важным из которых является размер иона. Ионы двух разных элементов могут свободно заменять друг друга, только если их ионные радиусы различаются примерно на 15 процентов или меньше.
На аллотропические превращения влияет также температура, соответствующая началу роста кристаллов. Чем выше температура, чем более обширен термический беспорядок в кристаллической структуре и тем менее требовательны требования к пространству. В результате ионное замещение, которое не могло произойти в кристаллах, выращенных при низких температурах, может присутствовать в кристаллах, выращенных при более высоких температурах. Так, высокотемпературная форма KAlSi3O8 (санидин) может содержать больше натрия вместо калия, чем низкотемпературные аналоги данного минерала.
Дополнительным фактором, влияющим на ионное замещение, является поддержание баланса между положительными и отрицательными зарядами в структуре. Замена одновалентного иона (например, Na + ) двухвалентным ионом (например, Ca 2+ ) требует дополнительных замен, чтобы структура оставалась электрически нейтральной.
Условия для полиморфного превращения
Стабильность химических связей атомов и ионов металлов определяют электрические силы. Физические и химические свойства минералов по большей части объясняются типами этих связывающих сил, среди которых:
- твёрдость:
- температура начала плавления;
- электропроводность;
- теплопроводность;
- коэффициент теплового расширения.
Твёрдость и температура плавления кристалла увеличиваются (а коэффициент теплового расширения уменьшается) пропорционально прочности такой связи. Чем сильнее электрические связи, тем большее количество тепла потребуется для их разделения.
Электрические силы, называемые химическими связями, можно разделить на пять типов:
- ионные;
- ковалентные;
- металлические;
- ван-дер-ваальсовы;
- водородные.
Такая классификация в значительной степени обусловлена целесообразностью, поскольку химические связи в данном металле могут фактически обладать характеристиками более чем одного типа связи.
Ионные связи проявляются в тенденции атомов металлов приобретать или терять электроны, пока их внешние орбитали не станут стабильными; Обычно это достигается за счет заполнения этих орбиталей максимально допустимым числом валентных электронов.
Кристаллы с ионной связью обычно обладают умеренной твёрдостью и удельным весом, довольно высокими температурами плавления и плохой теплопроводностью и электропроводностью.
Ковалентные связи образуются только между резко полярными веществами, которых среди металлов практически не встречается. В отличие от солей, металлы обладают высокой пластичностью, прочностью, пластичностью и проводимостью. Многие из них характеризуются более низкой твёрдостью и более высокими температурами плавления и кипения, чем, например, материалы с ковалентной связью. Все эти свойства являются результатом металлического механизма связи, который можно представить как набор положительно заряженных ионов, погруженных в облако валентных электронов. Притяжение между катионами и электронами удерживает кристалл вместе.
Электроны не связаны с каким-либо конкретным катионом и, таким образом, могут свободно перемещаться по структуре. У некоторых металлов (натрий, цезий, рубидий и калий) лучистая энергия света может вызвать полное удаление электронов с их поверхностей Этот результат известен как фотоэлектрический эффект. Подвижность электронов отвечает за способность металлов проводить тепло и электричество.
Самородные металлы - единственные минералы, демонстрирующие чистую металлическую связь.
Связи Ван-дер-Ваальса и водородные связи характерны для газов, органических жидкостей и некоторых твёрдых тел, поэтому здесь не рассматриваются.
Механизм превращения
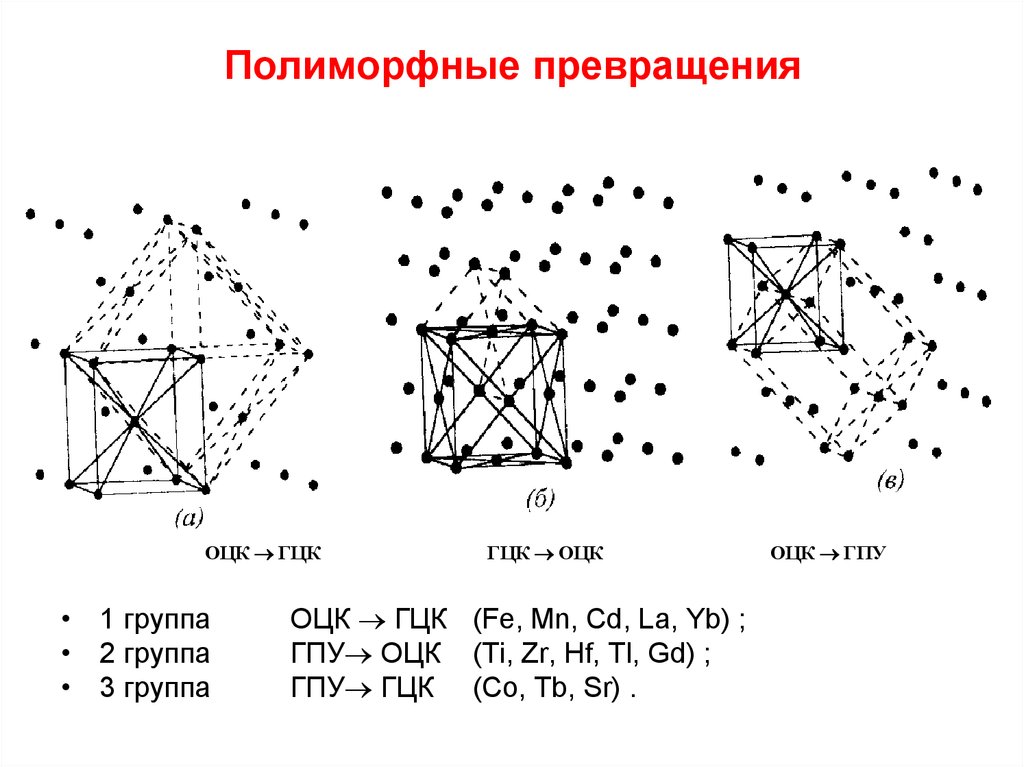
Наибольшей интенсивностью полиморфных превращений обладают самородные металлы, которые объединяются в три группы:
- Группа золота, состоящая из золота, серебра, меди и свинца;
- Платиновая группа, состоящая из платины, палладия, иридия и осмия;
- Группа железа, содержащая железо и никель.
Гораздо слабее полиморфизм выявляется у ртути, тантала, олова и цинка.
Золото, серебро и медь являются членами одной группы (столбца) периодической таблицы элементов и, следовательно, имеют схожие химические свойства. В некомбинированном состоянии их атомы соединены довольно слабой металлической связью. поэтому атомы расположены в простом кубическом расположении с плотной упаковкой. И золото, и серебро имеют атомный радиус 1,44 × 10 –7 мм, что позволяет твёрдому раствору полностью образовываться между ними. Радиус меди значительно меньше (1,28 Å), и поэтому медь только в ограниченной степени заменяет золото и серебро. Из-за схожей кристаллической структуры металлы группы золота обладают схожими физическими свойствами, поэтому хорошо кристаллизуются в изометрической системе и имеют высокую плотность упаковки.
Аналогичен механизм аллотропного превращения у металлов платиновой группы..
Металлы группы железа изометричны и имеют простую кубическую упакованную структуру, чем объясняется лёгкость происходящих полиморфных превращений.
Почему полиморфное превращение также называют перекристаллизацией?
Полиморфизм - это способность вещества кристаллизоваться в различные кристаллические формы, которые называются кристаллическими модификациями. Полиморфы имеют одинаковое жидкое или газообразное состояние, но в твёрдом состоянии ведут себя по-разному.
Для всех металлов, испытывающих аллотропические превращения, кристаллические структуры подвижны и могут видоизменяться в нескольких разных пропорциях.
Некоторые полиморфные формы могут быть стабильными только в том случае, когда при кристаллизации присутствует небольшое количество растворителя.
Таким образом, перекристаллизация – процесс перестройки одной кристаллической решётки в другую – обязательно сопровождается и определёнными полиморфными превращениями.
Полиморфизм металлов: суть, определение, примеры

Когда один элемент может существовать в виде нескольких простых веществ с разными свойствами и характеристиками, это называется аллотропией, или полиморфизмом. У металлов такая способность тоже имеется. Некоторые из них могут изменять свою структуру и качества под действием определенных факторов, что порой очень полезно в промышленности и других сферах. О том, какие металлы обладают полиморфизмом и как это проявляется, мы и расскажем.
Разные формы одного
Аллотропия – это явление, при котором один химический элемент может образовывать несколько разновидностей простых веществ. Они могут существенно отличаться друг от друга по своим физическим и химическим свойствам, но при этом состоять они будут из атомов одно и того же вида. Например, графит и алмаз совершенно не похожи: они имеют разный цвет, твердость, структуру, но оба состоят из атомов углерода.

Такие варианты называются аллотропными модификациями, а появляются они благодаря различному порядку расположения частиц в кристаллических решетках или различному строению молекул. Так, молекула из двух атомов оксигена (О2) образует простое вещество кислород, но если атомов оксигена в ней будет три (О3), то возникнет вещество озон.
Понятие «аллотропия» в научную терминологию ввел Йенс Якоб Берцелиус в 1841 году, после того как обнаружил, что винная и виноградная кислоты имеют одинаковый состав, но отличаются свойствами. Сегодня известно больше 400 модификаций, среди которых есть как неметаллы, так и металлы. Термин «аллотропия» применяют ко всем простым веществам, не привязываясь к их агрегатному состоянию. В отношении твердых веществ, причем как простых, так и сложных, употребляется термин «полиморфизм».
Явление полиморфизма металлов
Аллотропия – это распространенное явление, но характерно оно далеко не для всех элементов. Способность образовывать модификации зависит от внутреннего строения самого атома, и присуща тем элементам, которые изменяют свою валентность под действием внешних условий.
У металлов полиморфизм проявляется преимущественно под воздействием температур. Если нагреть вещество до определенного значения, ионы и атомы в его кристаллической решетке начнут перестраиваться, изменяя свое положение относительно друг друга. В итоге вещество приобретет иные свойства и перейдет в другую модификацию.

Каждая новая форма обозначается строчной буквой греческого алфавита, которая через дефис присоединяется к названию элемента. Чем ниже температура, при которой образуется модификация, тем раньше в алфавите стоит буква.
Полиморфизм металлов нашел широкое применение в промышленности. Нередко это свойство веществ используется для создания прочных сплавов. К аллотропии склоны около 30 металлов. Температурная аллотропия характерна для олова, железа, урана, бериллия, титана, кобальта. Цинк, сурьма, цезий, ртуть, галлий, литий и кадмий переходят в другие формы под действием давления.
Железо
Fe, или железо, – один из самых распространенных элементов в земной коре. В таблице Менделеева он стоит под 26-м номером. В качестве простого вещества железо является светлым пластичным металлом с сильными магнитными свойствами. Оно часто применяется в различных сферах жизни, но в большинстве случаев используется в виде сплавов с углеродом, хромом, никелем, марганцем и другими металлами.

Полиморфизм железа проявляется в четырех формах:
- Феррит (α-Fe) - до температуры в 769 °C. Обладает объемноцентрированной кубической решеткой и ферромагнетическими свойствами.
- β-Fe – выше 769 °C. Обладает ведет себя как парамагнетик и отличается от феррита только некоторыми параметрами кубической решетки. Не всегда выделяется в отдельную модификацию и рассматривается как α-Fe.
- Аустенит (γ-Fe) – выше 917 °C. Имеет гранецентрированную кубическую решетку, хуже феррита проводит ток и тепло, ведет себя как парамагнетик.
- δ-Fe – выше1394 °C. Объемноцетрированная кубическая решетка.
Олово

В периодической таблице олово, или Sn, стоит под номером 50. Это легкий, блестящий, серебристо-белый металл, который хорошо поддается плавлению и ковке. Полиморфизм металла также проявляется при разных температурных режимах:
Полиморфизм металлов
Полиморфизм это такое явление, когда материал в одном интервале температур или давлений имеет одну кристаллическую структуру, а в других интервалах – другую. Иными словами с изменением температуры или давления наблюдается изменение кристаллической структуры материала. Температуру и давление, при которых происходит смена кристаллической структуры материала, называют соответственно температурой и давлением полиморфного или аллотропического превращения.
Различные кристаллографические модификации одного материала принято обозначать буквами греческого алфавита α, β, g, δ, ε, σ и т.д. Модификацию, наблюдаемую при самых низких температурах, обозначают буквой α, при более высоких температурах – β, и т.д.
Ярким примером полиморфизма у неметаллических материалов является наличие двух кристаллографических модификаций чистого углерода, известных как алмаз и графит. Оба материала являются идентичными по химическому составу и отличаются лишь кристаллической структурой. В результате свойства алмаза и графита оказываются существенно различными. Графит это мягкий, хрупкий и непрозрачный материал, в то время как алмаз является одним из наиболее твёрдых минералов, встречающихся в природе, и, как правило, прозрачен.
Полиморфизм достаточно распространённое явление в мире металлов. Многие из металлов обладают полиморфизмом. Например, у Со с повышением температуры ГПУ-структура перестраивается в ГЦК-структуру, а у Ti ГПУ-структура перестраивается в ОЦК-структуру.
Наиболее ярко полиморфизм проявляется у железа, которое при нагреве два раза меняет свою кристаллическую структуру (рис. 11).
ОЦК ГЦК ОЦК жидкость
α-Fe β-Fe γ-Fe δ-Fe
768 911 1392 1539 Т, °С.
Рис. 11. Кристаллографические модификации железа.
При температурах ниже 768°С железо является ферромагнитным материалом, а при температурах выше 768°С – парамагнитным. Ранее считали, что изменение магнитных свойств железа связано с изменением его кристаллической структуры и поэтому ферромагнитное железо стали обозначать α-Fe, а парамагнитное – β-Fe. Позже выяснилось, что это не так. И то и другое железо имеют одинаковую ОЦК-структуру. Однако исторически сложившееся подразделение железа на α-Fe и β-Fe сохранили. В настоящее время железо с ОЦК-структурой, наблюдаемое в интервале температур до 911 ° С, называют α-железом.
В интервале температур от 911 до 1392 °С железо имеет ГЦК-структуру. Такое железо обозначают γ-Fe. ГЦК-структура отличается от ОЦК-структуры более высокой плотностью упаковки атомов. Поэтому при нагреве железа до температур выше 911°С наблюдается уменьшение размера (объёма) образца.
В интервале температур от 1392 до 1539°С железо вновь имеет ОЦК-структуру. Однако период кристаллической решётки этого железа чуть больше чем у α-железа. Такое железо обозначают δ-Fe.
При температурах выше 1539°С чистое железо плавиться и превращается в жидкий расплав.
Другим ярким примером полиморфизма металлов является полиморфизм олова. При температурах ниже -30°С белое и пластичное β-олово (β –Sn) превращается в свою α-модификацию, т.е. в α-Sn, которое является серым порошком. Не имея никакого представления о природе данного явления, его, в своё время, назвали «оловянной чумой».
Явление полиморфизма в очередной раз подчёркивает, что свойства материалов определяются не только их химическим составом, но и в значительной степени их структурой.
3. ФОРМИРОВАНИЕ МИКРОСТРУКТУРЫ МЕТАЛЛОВ
И СПЛАВОВ ПРИ ЗАТВЕРДЕВАНИИ
Процесс перехода вещества из жидкого состояния в твёрдое кристаллическое состояниеназывают кристаллизацией. Обратный процесс называют плавлением. Рассмотрим подробно процесс кристаллизации металлов.
Превращения в твердом состоянии. Полиморфизм
Образование новых кристаллов в твердом кристаллическом веществе называется вторичной кристаллизацией. Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах или разных модификациях. Существование одного металла в нескольких кристаллических формах носит название полиморфизма.
В результате полиморфного превращения атомы кристаллического тела, имеющие решетку одного типа, перестраиваются таким образом, что образуется кристаллическая решетка другого типа. Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать буквой α, а при более высокой – β, γ и т. д.
Кристаллическая структура полиморфных металлов
| Металл | Кристаллическая структура | Температура существования модификации, ºС |
| Титан | ГП ОЦК | До 882 882–1668 |
| Цирконий | ГП ОЦК | До 862 862–1852 |
| Олово | Алмазная ТОЦ | До 13 13–232 |
| Уран | Ромбическая ТОЦ ОЦК | До 663 663–764 764–1130 |
| Кобальт | ГП ГЦК | До 447 477–1490 |
При переходе металла из одной полиморфной модификации в другую происходит фазовая перекристаллизация, вследствие образования новых зерен в структуре металла. Можно считать, что процесс перекристаллизации при полиморфном превращении подчиняется тем же законам, что и процесс перекристаллизации. Полиморфное превращение прежде всего развивается в тех участках структуры, в которых уровень свободной энергии повышен. Такими участками являются границы зерен и приграничные области. Чем меньше размер зерна, тем больше межзеренная поверхность и тем больше возникает зародышевых центров. Температура, при которой осуществляется переход из одной модификации в другую, носит название температуры полиморфного превращения.
Переход металла из одной полиморфной модификации в другую в условиях равновесия протекает при постоянной температуре и сопровождается выделением тепла, если превращение идет при охлаждении, и поглощением тепла – при нагреве. На кривых охлаждения и нагрева переход из одного состояния в другой характеризуется остановкой (для чистых металлов) или изменением характера кривой (для сплавов).
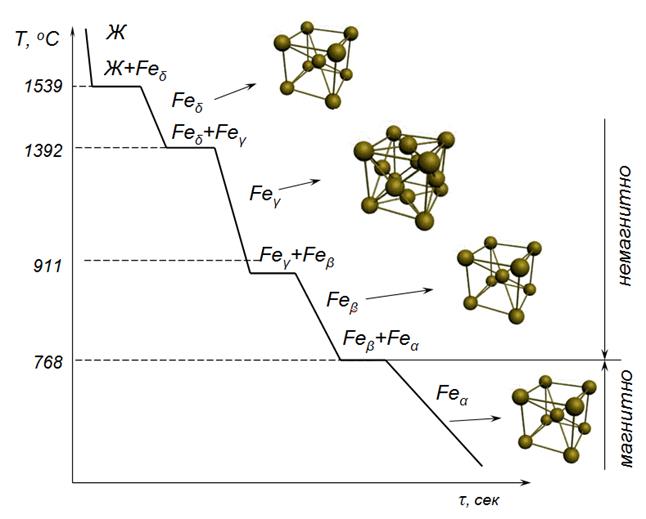
Рассмотрим явление полиморфизма на примере железа (рис. 2.7). Железо имеет две температуры полиморфного превращения – 1392 ºС и 911 ºС:
При температуре 768 ºС получается остановка на кривой охлаждения, связанная не с перестройкой решетки, а с изменением магнитных свойств. Железо отличается специфическими магнитными свойствами. Эти свойства называются ферромагнитными. При нагреве ферромагнитные свойства постепенно теряются. П. Кюри показал, что полная потеря ферромагнитных свойств получается при определенной температуре, названной впоследствии точкой Кюри. Выше 768 ºС Feα немагнитно (немагнитное Feα иногда называют Feβ), ниже 768 ºС железо ферромагнитно.
Рис. 2.7. Кривая охлаждения железа
Магнитное превращение имеет ряд особенностей, отличающих его от полиморфического превращения. Магнитные свойства железа постепенно падают по мере приближения к точке превращения, и эта точка не отвечает скачкообразному изменению свойств:
· магнитное превращение не имеет температурного гистерезиса, увеличение скорости охлаждения не снижает температуры превращения;
· механические и некоторые физические свойства при превращении не изменяются, изменяются многие электрические, магнитные и тепловые свойства;
· магнитное превращение не сопровождается перекристаллизацией.
При магнитных превращениях происходит изменение не в кристаллической структуре металла, а во взаимодействии внешних и внутренних электронных оболочек атомов.
Полиморфное превращение сопровождается скачкообразным изменением свойств металлов или сплавов – удельного объема, теплоемкости, теплопроводности, электропроводности и т. д. Эти превращения происходят не только в чистых металлах, но и в сплавах.
Презентация по материаловедению на тему "Полиморфизм металлов"

Сущность полиморфизма
Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах или, как их называют, в разных полиморфных модификациях.
В результате полиморфного превращения атомы кристаллического тела, имеющие решетку одного типа, перестраиваются таким образом, что образуется кристаллическая решетка другого типа.
Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать α, при более высокой – β, затем γ и т.д.

При полиморфном превращении кристаллы (зерна) новой полиморфной формы растут в результате неупорядоченных, взаимно связанных переходов атомов через границу фаз.
Отрываясь от решетки исходной фазы (например, β), атомы по одиночке или группами присоединяются к решетке новой фазы (α), и в результате этого граница зерна α-модификации передвигается в сторону зерна β-модификации, «поедая» исходную фазу.
Зародыши новой модификации наиболее часто возникают на границах зерен исходных кристаллитов.
Вновь образующиеся кристаллы закономерно ориентированы по отношению к кристаллам исходной модификации.

Полиморфизм железа
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
Особенностью железа является тот факт, что при разных температурах оно имеет различную форму кристаллической решетки (полиморфизм).
При температуре ниже 911 °С атомы располагаются в форме объемоцентрированной кубической решетки (ОЦК).

При нагревании выше 911 °С становится энергетически выгодной другая конфигурация кристаллической решетки — гранецентрированная кубическая (ГЦК).
Благодаря этому в ГЦК-форме железо обретает способность к повышенному растворению в себе других элементов, в том числе углерода, атом которого относительно невелик.

При дальнейшем увеличении температуры порядок атомов вновь изменяется.
Выше 1 392 °С и до точки плавления (1539 0С) железо опять представлено в качестве последовательности ОЦК - элементов.
Практическое применение:
- сталь при получении, охлаждаясь, проходит все эти полиморфические превращения, которые накладывают на ее конечные свойства отпечаток в зависимости от состава исходного расплава и от режима его затвердевания.

Виды сплавов
Общие физические свойства
По способу изготовления сплавов различают литые и порошковые сплавы.
Литые сплавы получают кристаллизацией расплава смешанных компонентов.
Порошковые — прессованием смеси порошков с последующим спеканием при высокой температуре.
Компонентами порошкового сплава могут быть не только порошки простых веществ, но и порошки химических соединений. Например, основными компонентами твёрдых сплавов являются карбиды вольфрама или титана.
По способу получения заготовки (изделия) различают литейные (например, чугуны, силумины), деформируемые (например, стали) и порошковые сплавы.

- В твердом агрегатном состоянии сплав может быть гомогенным (однородным, однофазным — состоит из кристаллитов одного типа) и гетерогенным (неоднородным, многофазным).
Твёрдый раствор является основой сплава.
Фазовый состав гетерогенного сплава зависит от его химического состава. В сплаве могут присутствовать: твердые растворы внедрения, твердые растворы замещения, химических соединений и кристаллиты простых веществ.
Основные классификационные сведения.
Стали. Все соединения железа, содержащие до 2% углерода, называются сталями. Если в составе имеется хром, ванадий или молибден, то их называют легированными.
Чугун. Если в сплаве железа содержится более 3-4% углерода, то он называется чугуном. Кроме того, его важным элементом является кремний.

Медные сплавы. Чаще всего под этим термином понимаются разные сорта латуни. Это такие сплавы меди, в которых содержится от 5 до 45% цинка. Если его содержание колеблется в пределах 5 - 20%, то это красная латунь (томпак). Если же в материале содержится уже 20 – 36% Zn, то это – желтая латунь.
Сплавы свинца. Наиболее известен в настоящее время обычный припой, который изготавливается из одной части свинца и двух частей олова.
Сплавы на основе алюминия. Сплавы алюминия делятся сразу на три большие группы:
- литейные (Al – Si);
- сплавы, предназначенные для литья под давлением (Al – Mg);
- соединения повышенной прочности, самозакаливающиеся (Al – Cu).

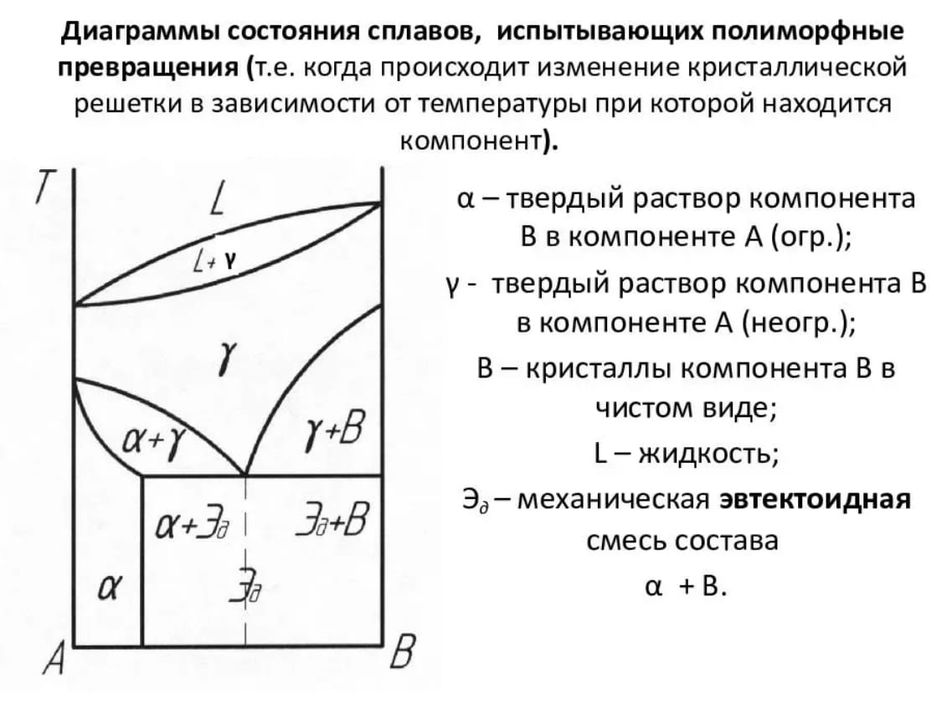
Правило фаз Гиббса
Фаза — это однородная часть системы или совокупность частей, имеющих одинаковый состав, строение и физико-химические свойства.
Разные фазы всегда отделены друг от друга поверхностями раздела (межфазными поверхностями). Химический состав каждой фазы в сплаве можно выразить через концентрации компонентов.
Состояние системы определяется температурой, давлением, концентрацией компонентов в разных фазах.
При изменении этих факторов система переходит из одного состояния в другое, при этом совершаются фазовые превращения, при которых появляются новые фазы или исчезают старые.
Возможность изменения равновесного состояния системы определяется вариантностью.

Число факторов, которые могут изменяться независимо друг от друга без нарушения равновесия системы, называется числом степеней свободы f.
Правило Гиббса - вариантность системы зависит от числа компонентов, числа равновесных фаз и количества внешних переменных.
f = К – Ф + 2 ,
где К - число компонентов в системе; Ф – число фаз в системе; 2 - число переменных, воздействующих на систему.
Если f = 0 (система называется нонвариантной), то все независимые переменные, определяющие состояние системы, имеют строго фиксированные (единственные) значения, которые нельзя изменить, не нарушив фазового равновесия системы.
Наличие одной, двух или большего числа степеней свободы позволяет независимо изменять одну, две или большее число переменных без изменения числа фаз, находящихся в равновесии.
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Читайте также:
