Взаимодействие соляной кислоты с нержавеющей сталью
Обновлено: 01.05.2024
Существуют определенные правила, выполнение которых обязательно для любого из представленных способов. Среди них приоритетные обработка поверхности металла перед травлением, удаление окисной пленки, обезжиривание. Процесс травления не менее важен.
Травление кислотами
Максимальный эффект травления нержавеющей стали кислотами достигается при последовательном взаимодействии поверхности нержавеющей стали в ваннах с двумя типами кислот – серной и азотной. Очередность стадий следующая
- Обезжиривание, удаление крупных зацепок, окалины
- Травление в сернокислотной ванне (концентрация 10-12%) или сернокислотной ванне (8% серной кислоты, 4% соляной). При этом происходит разъедание окалины и шероховатостей на поверхности. Идеальная температура протекания процесса находится между 60 и 80 градусов Цельсия. Контроль этого параметра важен для управления процессом. Продолжительность обработки зависит от марки стали, наличия контролируемого соотношения, концентрации кислот. В случае истощения ванны возможны проявления точечной коррозии. Для примера, сталь с 18% Cr, 8% Ni требует от 23 до 45 минут травления в сернокислой ванне. Сокращения времени обработки в два раза можно добиться, если проводить эту операцию в среде контролируемой атмосферы.
- Промывка в большом количестве проточной воды
- Погружение обрабатываемой детали в ванну, наполненную раствором азотной кислоты и плавиковой (10 – 20, 1-2 весовых процентов, соответственно). При температуре ванны 60 – 70 градусов время обработки 7 – 15 минут.
- Повторная промывка большим объемом водой
Представленный способ является базовым и имеет множество вариаций. Травление в одной азотнокислой ванне, с примесью кислоты плавиковой, увеличивает время травления до 30 минут. Заменителем плавиковой кислоты может выступать фтористый натрий. Увеличение концентрации плавиковой кислоты до 10% позволяет проводить процесс при низких температурных показателях, позволяя избежать предварительного опускания в серную кислоту.
Сокращение времени травления в серной кислоте можно добиться, добавив не более 5% хлористого натрия. Такой ход дает необходимый эффект за 15 минут, но при той же температуре, порядка 80 градусов Цельсия.

Для правильного выбора метода кислотного травления нужно знать, учитывать состояние окисной пленки на поверхности нержавеющей стали. Внешний вид может подсказать о составе пленки. Зеленый цвет окалины говорит о высоком содержании окислов хрома. Соответственно действие кислотных сред будет затруднено и потребует большего времени.
Рекомендуется промежуточная механическая очистка между двумя ваннами, если снятие окалины затруднено.
Травление металла в домашних условиях
Решил поделиться с вами довольно простым способом травления металла в домашних условиях на примере клинка.Итак, нам понадобится:
- собственно, сама железяка (в моем случае, откованный клинок для ножа).
- Маркер или карандаш.
- лак для ногтей (можно порыться в сумочке жены или купить в супермаркете самый дешевый).
- растворитель.
- медный купорос (100-200 грамм).
- наждачная бумага (80, 400, 1200 грид).
Для начала берем клинок, хорошенько проходимся по нему наждачной бумагой и растворителем.
После этого, набросаем на него эскиз предполагаемого рисунка маркером.

Лаком для ногтей аккуратно закрашиваем свой эскиз.Если лак выступает за пределы эскиза – ничего страшного, все это можно легко протравить в дальнейших операциях.

Прошу обратить внимание: Лак образует плёнку, которая защищает металл от травления. Поверхность под лаком травиться не будет
Поверхность под лаком травиться не будет.
Кроме самого рисунка, стоит защитить торцы изделия, а в моем случае еще и РК клинка.

Даем лаку подсохнуть некоторое время, затем начинаем корректировать рисунок и исправлять косяки.Для корректировки можно использовать шило или обычную иголку. Убираем лишние ляпы и правим линии, чтобы они выглядели более плавными.
Теперь начинается химия процесса:Для травления нам нужен раствор медного купороса и соли.
Я использовал на литр воды 100гр. соли и столько же купороса.
Воду для раствора лучше брать горячую(только что скипевшую), чтобы сократить время реакции.

Опускаем наше изделие в раствор, ждем.Предположительное время травления 25-40 минут.Все зависит от того, какая глубина травления вас устроит.Чтобы ускорить реакцию можно увеличить концентрацию купороса.
Во время процесса на клинке образуется рыжий налет, который мешает дальнейшему протеканию реакции травления,поэтому периодически необходимо доставать клинок и промывать его под теплой струй воды. Никаких щеток и металлических губок, в противном случае, вы сорвете лак с изделия. Проверить, достаточно ли глубоко мы протравили можно на ощупь. Раствор сам по себе безвреден, как и налет, так что проверяйте смело. (Единственная опасность – можете испачкать руки)
Здесь, стоит отметить еще один момент: следите, чтобы ваша железка не протравилась слишком глубоко, иначе, раствор начнет съедать не только незащищенную поверхность, но и вгрызаться сбоку под лак, если только вам не нужен эффект искусственного старения.

Как только мы решили, что металл достаточно глубоко протравлен, достаем поделку из раствора, хорошо промываем под напором воды, протираем растворителем, шкурим и полируем наждачкой по возрастающей, начиная с 80 грид, заканчивая 1200 грид. Если под рукой есть бор-машинка, неплохо бы шлифануть ею неровности рисунка.
В конце можно пройтись войлоком, если считаете нужным.
Осталось только сделать рукоять и отполировать клинок до зеркала.К сожалению, изображения готового клинка с ножнами у меня нет, т.к. эти фотографии делались давно и для других целей, а для мастер-класса я решил использовать только сейчас.
Спасибо за внимание. Надеюсь, кому-нибудь оказался полезным
Материалы для ванн
Правильный выбор материала для изготовления травильных ванн сложная задача для химиков и материаловедов.
- покрытые керамикой
- покрытого стеклом кирпича
- дерево, бетон с покрытием из свинца
- вещества, производные от резины
- определенные марки нержавеющей стали для кислотных ванн.
Содержание азотистой с примесями плавиковой или соляной кислоты позволяет применять такие же материалы. Исключение составляют лишь свинец, как покрытие, керамику с повышенным содержанием кремния, из-за их взаимодействия. Применение стали вполне возможно для использования в ваннах со щелочью, отслеживая протекание и интенсивность электролиза в непосредственной близости к материалу. При определенных условиях и содержании кислоты, ее температуры, характера есть возможность применять для травильных емкостей нержавеющие марки стали. Такие, например, как 8Х18Н8М или 10Х20Н25М4.

Из приведенной в этом обзоре информации можно сделать вывод, что режим обработки, химический состав ванны, необходимость дополнительной механической обработки, применение электролиза должны определяться исходя из конкретных начальных условий (марка стали, состояние оксидной пленки, технологические возможности) и регулироваться в контексте ожидаемого конечного результата.
Травление – нержавеющая сталь
Травление нержавеющих сталей и жаропрочных сплавов перед пайкой обычно не производят.
Травление нержавеющих сталей обычно производят в азотной кислоте с добавками HF, KF и других веществ.
| Глубина травления алюминия в зависимости от времени и концентрации щелочного раствора.| Глубина травления сплавов Д16 и В95 в 40 % – ном свежем растворе NaOH в зависимости от температуры раствора. |
Для травления нержавеющих сталей применяют раствор, представляющий собой смесь соляной, азотной и фосфорной кислот. Такой раствор является предварительным и для размерного глубокого травления нержавеющих сталей в окончательном виде непригоден ( 4 ] и поэтому дополнительно на каждые 3 8 л раствора растворяется около 450 г нержавеющей стали. Добавление в раствор такого количества нержавеющей стали приводило к понижению его кислотности, а введение в раствор дополнительно железа, хрома и никеля способствовало созданию-оптимальных условий для начала травления и устойчивого протекания всего последующего травильного процесса.
Для травления нержавеющей стали в последнее время применяется комбинированный щелочно-кислотный способ, заключающийся в предварительном травлении в расплавленной щелочи ( 8 ( Р / о едкого натра и 20 / 0 селитры) в течение 10 – 30 мин. Этот способ в несколько раз снижает потери металла, расход кислоты и увеличивает производительность.
Для травления нержавеющей стали в последнее время применяется комбинированный щелочно-кислотный способ, заключающийся в предварительном травлении в расплавленной щелочи ( 80 % едкого натра и 20 % селитры) в течение 10 – 30 мин с последующим травлением в 13-процентном растворе серной или соляной кислоты в течение 5 – 20 мин. Этот способ в несколько раз снижает потери металла, расход кислоты и увеличивает производительность.
| Анодные поляризационные кривые при электрополировании. |
Для травления нержавеющей стали рекомендуют применять ток с периодической или переменной полярностью.
Для травления окисленных нержавеющих сталей , содержащих шпинели, оксиды хрома, никеля, титана, молибдена, вольфрама и др. легирующих элементов, неприменимы растворы травления для углеродистых сталей. Обычно травильные растворы для нержавеющих сталей состоят из смеси нескольких кислот со специальными добавками, выполняющими функции окислителя, ингибитора или регулятора травления.
При травлении нержавеющих сталей , иикельхромовых сплавов в растворах на основе азотной кислоты ингибиторы почти не применяются, так как они тормозят растворение окалины и соответственно увеличивают время травления. Для предотвращения этих нежелательных явлений иногда могут быть использованы ингибиторы.
Существует много вариантов травления нержавеющих сталей . Например, травление при 20 – 30 С в течение 10 – 20 мин ( после обезжиривания) в растворе НС1 ( конц.
| Влияние способа обработки поверхности. |
Рекомендованы также различные способы травления нержавеющей стали , однако заготовки и детали из этого металла можно склеивать и без специальной обработки поверхности. Достаточно их обезжирить, протерев тампоном, смоченным ацетоном, или промыть в водном растворе ОП-7 концентрацией 1 5 – 2 0 г / л при 75 – 80 С в течение 3 – 5 мин.
По данным , при травлении нержавеющих сталей гладкая поверхность получается в растворе 100 г / л селенистой кислоты; 50 г / л сульфата меди и 75 см3 азотной кислоты.
Хьюсби приводит дополнительные данные по травлению нержавеющих сталей смесью из азотной и соляной кислот и хлорной меди.
1 Сатинирование нержавейки – популярный метод обработки
Нержавеющая сталь часто применяется для изготовления промышленных конструкторских изделий и всевозможных элементов декора. Такие детали в большинстве случаев подвергаются сатинированию (полированию, шлифованию). Этот вид обработки считается достаточно практичным и при этом гарантирующим высокий результат. Поверхность изделий из нержавейки после проведения операции приобретает “атласный” вид.
Сатинирование материала может выполняться пневматическими приспособлениями либо вручную. В первом случае используются следующие инструменты:
- шлифовальные ленты;
- ленточный пневмонапильник;
- барабанно-ленточная шлифмашинка.

Вручную полирование выполняется при помощи шлифовальных листов и специального шлифка.
На крупных производствах шлифование почти всегда производится посредством специальных агрегатов. А частные мастерские при изготовлении изделий и конструкций из нержавейки используют шлифок. Обработка стали с его помощью выглядит так:
С поверхности изделия удаляют прижоги и сварной шов.
Разметывают стыковочные риски на конструкции специальной защитной лентой, сделанной из алюминия. Ее необходимо наклеить на полируемую деталь в 2–3 слоя.
Затем осуществляется обработка части изделия ручным шлифком посредством движений возвратно-поступательного характера
Обратите внимание! Нельзя чересчур сильно давить на шлифок.
После того как обработка одной части детали завершается, на нее размещается алюминиевая лента. После этого шлифуется соседняя зона.
Шлифовальные листы используются в ситуациях, когда применение шлифка является нецелесообразным, а также при необходимости восстановления поврежденной при сатинировании поверхности. В этом случае следует правильно подобрать зернистость инструмента. Делается это, как правило, на черновой детали.
Популярные способы воронения
Технология воронения включает несколько способов, основными из которых являются следующие:
Щелочной способ. В данном случае придется работать с окислителями с соблюдением температурного режима 130-150 градусов. Благодаря щелочному оксидированию осуществляется окисление железа. Но с этим методом не стоит работать в доме или квартире, так как в процессе работы выделяется неприятный запах.
Кислотный способ. В данном случае работа выполняется в кислых растворах с использованием химического или электрохимического способа
Важно помещать предмет в раствор на установленное время и действовать в соответствии с инструкцией.
Термический способ. Такое воронение считается самым старым и простым из существующих
Эта технология заключается в необходимости нагревать сталь на открытом воздухе. Процедура продолжается, пока верхний слой металла не вступит в химическую реакцию с кислородом. Чем сильнее нагрев, тем более темной станет деталь.
Существуют и другие способы получения вороненого железа. Вы можете выбрать наиболее подходящий из них и сделать всю работу самостоятельно. Главное в точности соблюдать последовательность действий и использовать правильные составы для воронения.
Щелочной
Для воронения металла этим способом необходимо выполнить четкую последовательность действий. В первую очередь придется обезжирить поверхность при помощи растворителя. Затем сделайте следующее:
- Возьмите посуду и залейте в нее 100 мл воды.
- В ней необходимо растворить 120 грамм каустической соды и 30 грамм азотнокислого натрия, размешивая их до однородной массы.
- Нагрейте состав до температуры 130-150 градусов.
- В кипящую смесь поместите деталь таким образом, чтобы она не контактировала со стенками.
- Деталь почернеет через 20 минут, после чего ее промывают в дистиллированной воде.
Когда изделие полностью высохнет, его необходимо смазать машинным маслом и насухо протереть. В результате покрытие становится гладким и износостойким. Вам не придется дополнительно полировать изделие. Данные правила позволяют придать поверхности нужный эффект, не прибегая к сложной технологии. Не забудьте использовать защитную маску и плотные перчатки.
Кислотный
Данный вариант выполняется в кислых растворах. При этом используют электрохимическую или химическую технологию обработки
Важно очистить ржавчину. Для этого подойдет обычная наждачная бумага
Для увеличения скорости очистки в запущенных случаях можно использовать болгарку, оснащенную металлической щеткой.
Затем воспользуйтесь очищающим составом, в качестве которого используют трифосфат натрия, этиловый спирт с керосином или простой керосин. Деталь необходимо погрузить в раствор на 15 минут. В завершении изделие следует промыть в проточной воде, хорошо протереть и высушить.
Пока высыхает деталь, необходимо подготовить раствор для кислотного воронения. Смешайте следующие ингредиенты:
- 1 литр воды;
- 2 грамма дубильной кислоты;
- 2 грамма виннокаменной кислоты.
На следующем этапе осуществляется непосредственное воронение ножа. Нагрейте смесь до 150 градусов. Поместите предмет в емкость на 15 минут. Следите, чтобы металлическая поверхность находилась в растворе полностью. Затем промойте ее в проточной воде и окуните ее в кипящую воду. Это позволяет полностью очистить поверхность от раствора.
На завершающей стадии осуществляют процесс воронения стали в масле. При этом изделие погружают в машинное масло на 60 минут, после чего им можно пользоваться по назначению.
Термический
Здесь все очень просто. Такое воронение считается самым старым. Эта технология заключается в необходимости нагревать сталь на открытом воздухе. Процедура продолжается, пока верхний слой металла не вступит в химическую реакцию с кислородом. Чем сильнее нагрев, тем более темной станет деталь.
Травление готовыми пастами
Современная индустрия предлагает на рынке множество травильных паст для нержавеющей стали. Их основное назначение локальная обработка сварных швов, последствий изменения равномерности окраски поверхности под влиянием температурного воздействия. Принцип работы с такими пастами прост и может быть использован даже в мелких мастерских.
- Нанесение пасты толстым слоем до 2см., при помощи щетки
- Выдержка 60-90 минут
- Промывка струей воды
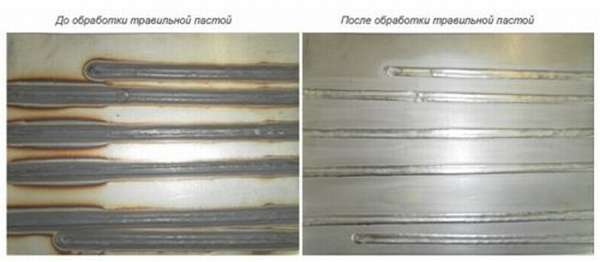
Применение паст целесообразно для обработки сварочных швов нержавеющих марок стали. Обработанный шов способен противостоять коррозии даже в условиях сырого помещения автомобильной мойки.
Коррозия металлов в кислотах
Коррозия металла в кислотах – это его разрушение при взаимодействии с концентрированными или разведенными кислотами. Часто такие разрушения встречаются на химических производствах и других сферах деятельности человека. Слабые кислотные растворы могут создавать даже некоторые продукты питания, и непокрытый металл, соприкасающийся с ними, будет коррозировать. То, как себя поведет металлический предмет при контакте с кислотой, зависит от его способности пассивироваться. Процесс коррозии металлов в кислотах проходит с выделением водорода.
Рассмотрим более подробно случаи коррозии металла в кислотах разного происхождения.
Коррозия металлов в соляной кислоте
Соляная кислота является очень агрессивной по отношению к металлам. В большей степени это обуславливается содержанием в ней ионов Cl - . Даже коррозионно-стойкие стали подвергаются разрушению, когда концентрация кислоты выше среднего. Если же раствор достаточно сильно разбавлен, такие стали коррозии не подвергаются.
Коррозия никеля в серной кислоте не протекает даже в случаях, когда достигается температура кипения. В присутствии трехвалентного железа, хлоридов, других окислителей никель и его сплавы начинают разрушаться.
Низколегированная аустенитная сталь при комнатной температуре и концентрации соляной кислоты в 0,2 – 1% подвергается коррозии со скоростью 24 г/(м 2 •сут).
Коррозия металлов в органических кислотах
Самой сильной среди органических кислот является уксусная. В яблочной, бензойной, пикриновой, олеиновой, винной, стеариновой кислотах даже при больших температурах (выше 100°С) коррозионно-стойкие стали отличаются высокой устойчивостью. При контакте металлов с муравьиной кислотой образуются питтинги (особенно при увеличении температуры). Глубина их даже больше, чем в уксусной кислоте.
В органических кислотах высокой устойчивостью обладает алюминий, т.к. на его поверхности присутствует защитная пленка труднорастворимых окислов.
Щавелевая, себациновая, лимонная и молочная кислоты вызывают коррозию сталей только при больших концентрациях. В них устойчивы хромистые стали с добавками молибдена.
Коррозия металлов в азотной кислоте
Азотная кислота обладает агрессивным воздействием по отношению ко многим металлам. Малоуглеродистые стали не обладают достаточной устойчивостью в растворах азотной кислоты. Кроме того, при повышении концентрации HNO3 до 35 – 40% (при данных концентрациях сталь переходит в пассивное состояние) коррозия малоуглеродистых сталей в азотной кислоте увеличивается. При концентрации азотной кислоты близкой к 100% пассивное состояние нарушается. Азотная кислота является окислителем. При коррозии железа катодными деполяризаторами являются молекулы азотной кислоты и нитрат-ионы. Устойчивость в азотной кислоте хромистых сталей повышается, если в их состав вводить никель и молибден. Коррозионное разрушение сталей в азотной кислоте происходит по границам зерен. На алюминий слабое влияние оказывают пары азотной кислоты или растворы с концентрацией более 80%. При нормальной температуре алюминий обладает высокой коррозионной стойкостью в азотной кислоте. Скорость коррозии алюминия в азотной кислоте возрастает при постоянном перемешивании и присутствии в растворе хлорид-ионов.
Коррозия металлов в серной кислоте
При концентрации серной кислоты около 50 – 55% поверхность железа переходит в пассивное состояние. Далее с повышением температуры и концентрации серной кислоты поверхность железа становится активной (наблюдается коррозия железа в серной кислоте).
В растворах серной кислоты, как и в других кислотах, на скорость коррозии железа большое влияние оказывает природа анионов. Это связано с торможением катодного и анодного процессов и их адсорбцией на поверхности металла.
Я.М. Колотыркин развил представления, что на анодное растворение железа оказывают влияние анионы. Это связано с образование комплекса:
Из вышеперечисленных уравнений понятно, что скорость анодного процесса возрастает с увеличением концентрации ионов HSO4 - и SO4 2- . С поверхности железа сульфат ионы вытесняются хлорид ионами, но до определенной концентрации ионов хлора, скорость протекания анодного процесса замедляется.
В 95 – 98% серной кислоте при нормальной температуре хорошей устойчивостью обладают хромистые стали (с содержанием хрома около 17%) с небольшой добавкой молибдена или без него. В таких условиях (при большой концентрации серной кислоты) стоек также алюминий и углеродистые стали. Чистый алюминий (99,5%) более устойчив в серной кислоте, чем его сплавы, в состав которых не входит медь. Скорость коррозии алюминия в серной кислоте (и его сплавов) при повышении температуры с 20°С до 98°С увеличивается с 8 до 24 г/(м 2 •сут). Коррозионно-стойкие стали в 5-ти или 20-% растворе при температуре кипения серной кислоты устойчивы только в присутствии ингибиторов коррозии.
При обычной температуре в серной кислоте коррозия меди практически не наблюдается. А при повышении температуры до 100°С процесс разрушения интенсифицируется. В 25% растворе серной кислоты, повышенном давлении и температуре близкой к 200°С медь быстро разрушается.
Латунь не обладает коррозионной стойкостью в растворах серной кислоты любых концентраций даже при комнатной температуре. Устойчивость латуней к разрушению в серной кислоте можно только повысить введением в раствор 30% соли CuSO4•5H2O.
Коррозия металлов в фосфорной кислоте
Наибольшей стойкостью к коррозии в фосфорной кислоте отличаются молибденовые стали. Алюминий и его сплавы (в состав которых не входит медь, магний) устойчивы в фосфорной кислоте. При обычной температуре не поддаются также разрушениям хромоникелевые аустенитные стали (в растворах фосфорной кислоты любой концентрации). В концентрированной технической фосфорной кислоте при температуре не выше 50°С стойки малоуглеродистые стали. Если сталь с 17% хрома поместить в раствор фосфорной кислоты, концентрацией от 1 до 10%, то она будет обладать высокой устойчивостью даже при температуре кипения.
Медь практически не подвергается коррозии в фосфорной кислоте при температуре от 20 до 95°С. Но если в систему вводить окислитель и повышать температуру – скорость коррозии меди в фосфорной кислоте значительно увеличивается. Бронзы и латуни в фосфорной кислоте ведут себя аналогично.
Коррозия металлов во фтористоводородной кислоте
Чугун, малоуглеродистая сталь и железо во фтористоводородной кислоте быстро разрушаются. В 10-% фтористоводородной кислоте при нормальной температуре обладают хорошей устойчивостью хромистые стали (с содержанием хрома 17%). В 20-% кислоте при температуре до 50°С устойчивы аустенитные высоколегированные стали. Латуни не разрушаются в 40-60-% фтористоводородной кислоте при 20°С. Магниевые сплавы устойчивы при температурах до 65°С в 45-% растворе.
Взаимодействие соляной кислоты с нержавеющей сталью
ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ
Чаще всего в химической практике используются такие сильные кислоты как серная H 2 SO 4 , соляная HCl и азотная HNO 3 . Далее рассмотрим отношение различных металлов к перечисленным кислотам.
Соляная кислота ( HCl )
Соляная кислота – это техническое название хлороводородной кислоты. Получают ее путем растворения в воде газообразного хлороводорода – HCl . Ввиду невысокой его растворимости в воде, концентрация соляной кислоты при обычных условиях не превышает 38%. Поэтому независимо от концентрации соляной кислоты процесс диссоциации ее молекул в водном растворе протекает активно:
Образующиеся в этом процессе ионы водорода H + выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl соль + H 2 ↑
При этом соль представляет собой хлорид металла ( NiCl 2 , CaCl 2 , AlCl 3 ), в котором число хлорид-ионов соответствует степени окисления металла.
Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления:
Fe 0 → Fe 2+
Co 0 → Co 2+
Ni 0 → Ni 2+
Cr 0 → Cr 2+
Mn 0 → Mn 2+ и др .
2 Al + 6 HCl → 2 AlCl 3 + 3 H 2 ↑
2│ Al 0 – 3 e - → Al 3+ - окисление
3│2 H + + 2 e - → H 2 – восстановление
Соляная кислота пассивирует свинец ( Pb ). Пассивация свинца обусловлена образованием на его поверхности трудно растворимого в воде хлорида свинца ( II ), который защищает металл от дальнейшего воздействия кислоты:
Pb + 2 HCl → PbCl 2 ↓ + H 2 ↑
Серная кислота ( H 2 SO 4 )
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам.
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
Образующиеся ионы Н + выполняют функцию окислителя.
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
1│2Al 0 – 6e - → 2Al 3+ - окисление
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления:
Mn 0 → Mn 2+ и др .
Свинец ( Pb ) не растворяется в серной кислоте (если ее концентрация ниже 80%) , так как образующаяся соль PbSO 4 нерастворима и создает на поверхности металла защитную пленку.
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера, находящаяся в высшей степени окисления ( S +6 ). Концентрированная H 2 SO 4 окисляет все металлы, стандартный электродный потенциал которых меньше потенциала окислителя – сульфат-иона SO 4 2- (0,36 В). В связи с этим, с концентрированной серной кислотой реагируют и некоторые малоактивные металлы.
Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:
Me + H 2 SO 4 (конц.) соль + вода + продукт восстановления H 2 SO 4
Продуктами восстановления серной кислоты могут быть следующие соединения серы:
Практика показала, что при взаимодействии металла с концентрированной серной кислотой выделяется смесь продуктов восстановления, состоящая из H 2 S , S и SO 2. Однако, один из этих продуктов образуется в преобладающем количестве. Природа основного продукта определяется активностью металла: чем выше активность, тем глубже процесс восстановления серы в серной кислоте.
Взаимодействие металлов различной активности с концентрированной серной кислотой можно представить схемой:

Алюминий ( Al ) и железо ( Fe ) не реагируют с холодной концентрированной H 2 SO 4 , покрываясь плотными оксидными пленками, однако при нагревании реакция протекает.
Ag , Au , Ru , Os , Rh , Ir , Pt не реагируют с серной кислотой.
Концентрированная серная кислота является сильным окислителем, поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты:
Fe 0 → Fe 3+ ,
Cr 0 → Cr 3+ ,
Mn 0 → Mn 4+ ,
Sn 0 → Sn 4+
Свинец ( Pb ) окисляется до двухвалентного состояния с образованием растворимого гидросульфата свинца Pb ( HSO 4 )2 .
Травление нержавеющей стали

Процедура травления нержавеющей стали
Химическая и электрохимическая обработка или травление считается одним из лучших способов очистки верхнего слоя нержавейки. Данная процедура отлично очищает поверхность стали от сварных швов, устраняет деформации различного типа, а также способствует укреплению структуры сплава после термической обработки. Кроме очистных свойств, процедура обеспечивает восстановление пассивного слоя стали, необходимого для защиты сплава от разрушения структуры при повышенных температурах.
Суть очистки стали 12х18н10т заключается в химическом взаимодействии верхнего слоя с концентрированным кислотным раствором. В основном используются соляная либо серная кислоты, после чего в ход вступает смесь расплавленной щелочи. Процесс очистки кислотой имеет две стадии: в первую очередь металл обрабатывается основным кислотным составом, а в заключении сплав выдерживается в ванне с раствором азотной кислоты.
Обрабатывая нержавейку, стоит строго соблюдать этапы технологического процесса. Емкость с раствором, в которую помещен сплав, должна обрабатывать лишь верхние слои металла, дополнительно устраняя имеющиеся повреждения. Не рекомендуется допускать изменение макроструктуры нержавеющей стали, так как железо может потерять свои первоначальные свойства.
Применение травления
Процесс травления широко применим на производстве во время очистки верхних слоев стали от сварных швов, окалин, окислов и ржавчин. Используется во время поиска внутренних дефектов путем снятия верхнего слоя заготовки либо для изучения структуры металла.
Эта процедура обеспечивает зачистку материала, благодаря чему увеличивается адгезия верхнего слоя. Это необходимо для успешного соединения металлической заготовки с другой поверхностью, после чего наносится покрасочный, эмалированный, гальванический слой или другое защитное покрытие.

Такой вид обработки обеспечивает не только быструю очистку заготовки, но и создаёт на верхнем слое металла заданный рисунок. С помощью травления можно вырезать канал любой толщины или оформить сложное изображение. Также возможна обработка крупных заготовок и проката. Можно легко регулировать глубину обработки до микронов, благодаря чему удастся обработать поверхность со сложными участками и мелкими пазами. Процедура применяется в проведении анализа, определяющего образование межкристаллической коррозии у нержавеющей стали.
Кроме этого данный процесс широко используется во время обработки углеродистых, низколегированных и высоколегированных сталей, цветных металлов и титана. Эта технология незаменима во время обработки мелких металлических деталей, шестеренок наручных часов. С помощью неё изготавливаются полупроводниковые микросхемы и печатные платы в электронике. Этот способ обработки обеспечивает образование токопроводящего канала на микросхемах. В авиастроении травление играет важную роль, так как с помощью этого процесса уменьшается толщина металлических листов, благодаря чему снижается вес самолёта. В нанесении рисунков и надписей данная операция также играет большую роль. Травление производит рельефное изображение, полученное путем разрушения металлической поверхности согласно определенным шаблонам. В быту операция способствует очистке трубопровода.
Методы травления
В домашних условиях и на производственных участках используется следующие виды обработки:
- Кислотная очистка;
- Электролитическая очистка;
- Очистка пастами.
Травление кислотами
Наилучший результат в ходе обработки нержавеющей стали получается путем длительного выдерживания верхнего слоя нержавейки в емкости кислот из серы и азота. Как происходит данный процесс:
- Первоначальным этапом считается обезжиривание верхнего слоя стали, с последующей зачисткой заусениц и ожогов;
- Далее происходит травление в сернокислотных ваннах. Во время процесса кислотный состав разъедает шероховатость на поверхности, окалины и заусенцы. Наилучшим показателем температуры во время разъедания является 60-80 градусов по Цельсию. В течение процесса важно контролировать данный параметр. Продолжительность травления зависит от концентрации кислоты (10-12%) и маркировки стали. Стоит быть внимательней, так как истощение кислотной ванны приводит образование точечной коррозии на поверхности металла. К примеру, сталь с содержанием хрома (18%) и никеля (8%) потребует 20-40 минут обработке сернокислотной ванне. Есть возможность сократить время данной процедуры в несколько раз. Для этого следует контролировать уровень атмосферы.
- Следующий шаг — промывка заготовки в большом количестве жидкости.
- Следом стоит погрузить обрабатываемую деталь в ванну, которая наполнена азотнокислым раствором. Время процедуры занимает от 5 до 15 минут с учётом температуры ванны 50-70 градусов по Цельсию.
- Заключительный этап – повторное ополаскивание проточной водой.
Описанный метод травления считается стандартным и включает в себя несколько вариантов обработки. К примеру, выдержка в емкости с азотным раствором, который обогащен элементами плавиковой кислоты, увеличивает процедуру до получаса. Если поднять уровень концентрации плавиковой примеси до 15%, то получится провести процесс обработки при низкой температуре, при этом избежав предварительное опускание заготовки в кислоту. Ещё один доступный вариант обработки – очистка стали с помощью ортофосфорной кислоты. Для выполнения процедуры стоит следовать следующим шагам:
- Обезжирить стальную заготовку любым доступным средством;
- Промыть деталь в проточной воде и высушить;
- Залить ванну для обработки ортофосфорной кислотой по пропорции 150 мг на литр воды;
- Поместить сплав в емкость и ожидать в течение часа;
- Достать и промыть в проточной воде очищенную деталь.
Сократить время обработки в сернокислой ванне можно с помощью добавления хлористого натрия в размере 5%. Благодаря этому процесс занимает 15 минут, но стоит придерживаться соответствующего температурного режима (80 градусов).
Важно помнить, что в помещении с плохой аспирацией следует заменить состав для второго этапа обработки. Проблема в выделении вредных паров из кислоты, поэтому лучше заменить раствор, используя 8% сернокислого железа и 3% плавикового раствора.
Оказать помощь в определении метода травления может окисная пленка, расположенная на верхнем слое нержавейки. Преимущество в том, что внешнее состояние подсказывает о составе плёночного слоя. Если цвет окалины зелёный, это свидетельствует о высоком уровне хрома в составе. В результате может затрудниться взаимодействие стали и кислотной ванны, следовательно, на обработку уйдет больше времени.
Электролитическое травление
Суть электролитической очистки заключается в неравномерной анодной обработке различных структурных элементов, а также в избирательной окраске металла из-за появления пленок. Отличительной чертой данной обработки считается имение внешних источников тока.
Максимально эффективна электролитическая обработка во время определения макроструктуры металлов, сплавов подвергшихся деформации, а также высоколегированных сталей, которые отличаются высокой химической устойчивостью. Электролитическая обработка имеет три вариации травления:
- Очистка посредством анодного растворения;
- Анодная пленочная очитка;
- Катодная пленочная очистка.
Самым распространённым методом электротравления считается анодное растворение, благодаря которому рельеф на поверхности образуется в результате отдельных границ или фаз зерен.
Травление готовыми пастами
На данный момент современный рынок обеспечен огромным ассортиментом различных паст для травления нержавеющей стали. Главная задача пасты – изменение неровностей окрашенной поверхности в результате высоких перепадов температуры, а также очистка сварных швов. Процесс использования травильной пасты достаточно прост и может быть применён даже в домашних условиях. Нержавейка после сварки хорошо очищается пастой густой концентрации, ведь её эффективность уже начинает проявляться при температуре 80 градусов. Перед травлением металлическую поверхность необходимо очистить от коррозии и прочих дефектов.

Процесс травления пастой состоит из следующих шагов:
- Обработка верхнего слоя заготовки пастой слоем до нескольких сантиметров;
- Выдержка в течение полутора часа;
- Промывка под проточной водой.
Травление пастой идеально подходит для обработки сварных швов на нержавеющих марках стали. После правильной обработки поверхность способна выдерживать коррозийные атаки в самых неблагоприятных условиях.
Читайте также:
