Ar металл или неметалл
Обновлено: 18.05.2024
Аргон – это химический элемент, занимающий в периодической таблице Д.И. Менделеева место под номером 18. Инертный, по-другому благородный, одноатомный газ аргон, который, при нормальных условиях не вступает в химические реакции и является чистым веществом, незаменим во многих сферах человеческой деятельности.
В данной статье рассказывается о его физических и химических свойствах, областях применения, технике безопасности при использовании.
Происхождение названия
Впервые с аргоном во второй половине XVIII века столкнулся английский ученый Кавендиш при изучении состава воздуха.
Во время проведения эксперимента после удаления с помощью химических реакций кислорода и азота в трубке оставался небольшой пузырек газа, который не реагировал на внешние воздействия. Его размер составлял около 1/120 первоначального объема. Понять причину этого Кавендишу не удалось.
И только более чем через столетие, на исходе XIX века, совместные усилия ученых Рэлея и Рамзая, также англичан, привели к ликвидации белого пятна в периодической таблице.
Они заинтересовались разницей в весе двух объемов азота, равных 1 л, один из которых был получен из воздуха, другой – в результате химической реакции. Эта разница составляла 1,6 мг и не могла быть отнесена на счет погрешности измерения.
Ученые предположили, что в первом случае, кроме азота, присутствует неизвестный газ, что и подтвердил последующий спектральный анализ. Поскольку этот газ оказался химически неактивным, то есть не вступал в какие-либо реакции, то и название он получил соответствующее.
В переводе с древнегреческого языка ἀργός (читается как «аргос») – медленный, ленивый.
Несколько позднее, также с помощью спектрального анализа, были открыты и другие инертные газы, присутствующие в составе атмосферы, хотя и в значительно меньших, чем аргон, количествах.
Распространенность
Температура кипения аргона при атмосферном давлении очень низка, поэтому на Земле его можно встретить лишь в виде газа.
По количеству в составе атмосферного воздуха, которое составляет около 1%, элемент уступает лишь азоту и кислороду, и это в несколько десятков раз больше, чем общее количество других инертных газов – ксенона, криптона, гелия, неона.
Поэтому он наиболее популярен. А такого содержания в воздухе вполне достаточно для промышленной добычи, тем более что после использования газ практически полностью возвращается в атмосферу, не вступая в какие-либо реакции по причине своей инертности.
Чтобы понять, как добывают аргон, необходимо учесть, что температуры кипения кислорода и азота различны и равны, соответственно, 90 °К (-183 °С) и 77 °К (-196 °С). В то же время аргон закипает при температуре, большей, чем азот, и меньшей, чем кислород.
Данную физическую особенность и используют инженеры, чтобы получить газ в чистом виде. Происходит это при низкотемпературной ректификации воздуха, то есть разделения его на азот и кислород путем многократного ожижения и испарения. Аргон в этом процессе появляется в качестве побочного продукта.
Во вселенной
В окружающей наш мир материи аргона немного – всего 0,02% от общей массы.
Ученые обнаружили его входящим вместе с еще одним инертным газом – неоном в состав некоторых звезд, а также планетарных туманностях – оболочках ионизированных газов, образующихся вокруг звезд на исходе их существования.

Распространение в природе
На нашей планете, кроме атмосферы, аргон содержится в земной коре и морской воде, но в значительно меньшей степени – его количество составляет лишь тысячные доли процента от общей массы.
Физические свойства
1 см3 аргона в газообразном состоянии при стандартных условиях весит 1,78×10-3г, что означает, что его плотность равна 1,78×10-3г/см3.
То есть аргон тяжелее, чем воздух, который имеет плотность 1,2×10-3г/см3. Поэтому при попадании в атмосферу из какой-либо емкости, например, газового баллона, аргон будет занимать объем в нижней части помещения, вытесняя оттуда воздух и постепенно с ним смешиваясь.
Температура конденсации аргона, то есть его кипения, в условиях атмосферного давления равна 87,3 °К (-185,9 °С). При температуре 83,8 °К (– 189,3 °С) жидкость отвердевает. Плотность аргона в жидком состоянии при давлении в одну атмосферу равна 1,39х103 кг/м3.
Химические свойства

Аргон является инертным газом, не имеющим ни запаха, ни вкуса, ни цвета и в периодической таблице занимает место среди других неметаллов в столбце с прочими благородными газами. Его химическая формула – Ar (первые две буквы латинского слова argon).
Атомная и молекулярная масса
Атомной массой называется средняя масса существующих в земных условиях изотопов с учетом их распространенности. Для аргона она составляет 39,948. Его молекулярная масса равна атомной.
Изотопы
Изотопы – это разновидности атомов с одинаковым зарядом ядра и различной массой. На Земле существуют следующие изотопы аргона:
- 40Ar с ядром, состоящим из 18 протонов и 22 нейтронов в земной атмосфере представлен наиболее всего – 99,6% от общего количества газа;
- 36Ar (18 нейтронов) – 0,337%;
- 38Ar (20 нейтронов) – 0,063%.
Источником изотопа 40Ar является изотоп калия 40К, являющийся радиоактивным и попадающий на поверхность земли вместе с продуктами извержения вулканов.
Также существуют изотопы, создаваемые искусственно. Их масса может иметь значение от 30 до 55 атомных единиц, но они нестабильны. Наиболее устойчивым является 39Ar с периодом полураспада, составляющим 269 лет, самые неустойчивые существуют в течение десятков наносекунд.
Для того чтобы оторвать от атома электрон, необходимо потратить энергию, которая называется энергией ионизации.
Для создания катиона (положительно заряженного иона) Ar+ потребуется 1520 кДж/моль. Это можно осуществить с помощью пропускания через газ электрических разрядов.
Молекула и атом
Атом имеет положительно заряженное ядро, в состав которого входит 18 протонов. Вокруг ядра по трем орбитам вращаются 18 электронов – 2 на первой, на второй и третьей – по 8.

Таким образом, внешняя орбита заполнена электронами полностью. Именно этим объясняется отсутствие каких-либо химических соединений с участием аргона – при нормальных условиях он существует только в свободном виде.
Такое свойство присуще всем остальным инертным газам – у каждого из них внешняя электронная орбита заполнена полностью.
Молекула по этой же причине состоит из одного атома и так же, как и атом, обозначается – Ar.
Молярная масса
Один моль – это 6,02х1023 молекул данного вещества. Величина 6,02х1023 называется числом Авогадро и обозначается как NA. Молярная масса, определяющая свойства аргона, как и любого газа – это масса одного моля. Для аргона она равна 39,948 г/моль.
Получение
Чаще всего аргон получают с помощью криогенной ректификации воздуха. Для этого воздух сначала тщательно очищают от частиц пыли, прогоняя через несколько фильтров, осушают, затем сжимают при помощи компрессоров до перехода в состояние жидкости.
Последнюю отправляют в ректификационную колонну – устройство, в котором при различных температурах происходит последовательное испарение азота, аргона и кислорода.
Аргонная фракция, содержащая 12%, аргона, подвергается еще одной ректификации, в результате чего доля газа в смеси доходит до 85%, остальное приходится на кислород с небольшим количеством азота.

Такой газ называют сырым аргоном и уже из него получают чистый аргон, который в зависимости от количества оставшихся примесей в соответствии с ГОСТ 10157-62 может быть трех марок:
- марка А – объемный процент содержания аргона, не менее 99,99%. Применяется при сварке титановых сплавов, нержавеющей стали, конструкционной стали – при повышенных требованиях к прочности;
- марка Б – не менее 99,96%. Используется во время сварки алюминия, менее активных, чем титан, цветных металлов;
- марка В – не менее 99,90%. Востребована при работе с жаростойкими сплавами, алюминиевыми материалами, конструкционными сталями. Часто используется совместно с углекислым газом и кислородом.
Еще один способ получения аргона – при синтезировании аммиака. Побочным продуктом реакции является продувочный газ, содержащий до 20% аргона, причем стоимость его получения заметно ниже.
Биологическая роль
Под биологической ролью элемента подразумевается его участие в жизнедеятельности каких-либо организмов. Аргон в таких процессах участия не принимает, следовательно, этой роли не выполняет.
Область применения
Аргон применяется в самых различных областях деятельности человека. В первую очередь востребовано отсутствие его химическая активности.
Наиболее широко газ используется при сварке – для создания вокруг дуги газового слоя, оттесняющего атмосферные кислород и азот. Поскольку этот газ тяжелее воздуха, то применять его лучше при использовании нижнего положения.
Аргон растекается над поверхностью материала, вытесняя вверх кислород с азотом, и прикрывает не только область расплава, но также и нагретую часть поверхности.
Это важно во время работы с металлами, отличающимися активностью при высокой температуре, например, такими как титан. Аргон также используют во время сварки высоколегированных и нержавеющих сталей. Неметаллы обычно соединяют с использованием газовой сварки.
Использование инертного газа дает возможность увеличить температуру дуги, а это сказывается на проплавлении шва, который приобретает форму кинжала и позволяет в один проход соединять куски металла большой толщины.
В связи с тем, что в отсутствие кислорода шов получается значительно более ровным и прочным, аргон востребован при изготовлении ответственных конструкций в строительстве: высоких зданий, железнодорожных и автомобильных мостов.
Швы высокого качества востребованы в химическом и пищевом машиностроении, атомной промышленности, аэрокосмической сфере. Нефте- и газопроводы также сооружаются с применением аргонной сварки.
В электронике инертность аргона также находит применение. Его закачивают в колбы осветительных и радиоламп – для защиты, соответственно, нити накаливания или электродов, используют при выращивании полупроводниковых кристаллов.
В сфере производства продуктов питания газ применяется в качестве вытеснителя (в первую очередь, присутствующего в воздухе кислорода). Его закачивают в герметичные упаковки с продуктами с целью увеличения срока хранения.
Низкое значение теплопроводности аргона дает возможность применять его в качестве теплоизолятора – в оконных рамах, гидрокостюмах.
Способность излучать фиолетовый свет при нагревании находит применение в рекламных афишах и надписях.

Другие области применения:
- пожаротушение;
- лазеры;
- хирургические операции
и многое другое.
Окраска баллона
При использовании баллонов для хранения газов за каждым из них закреплен цвет, в который окрашена сама емкость, а также цвет полосы, нанесенной по окружности на ее образующую вблизи горловины. Баллон, предназначенный для аргона, окрашен в серый цвет, при этом цвет полоса и надпись – зеленые.

Для транспортировки жидкого аргона применяются специальные емкости типа сосуда Дьюара и цистерны.
Зависимость давления аргона в баллоне от температуры
При заправке давление аргона в баллоне составляет порядка 150 атм. Однако в соответствии с законами физики все газы при нагревании расширяются. Если отсутствует возможность для расширения, что и наблюдается в замкнутом объеме, то при повышении температуры давление внутри него будет нарастать. В случае идеального газа соблюдается следующая зависимость:
где P – давление внутри замкнутого объема;
Т – абсолютная температура газа по шкале Кельвина, которая выше температуры по шкале Цельсия на 273°, то есть
где t – температура по шкале Цельсия.

Зависимость давления реального газа в баллоне от температуры приведена в таблице:
| Температура, °С | Давление, атм |
| -30 | 111,8 |
| -20 | 120,5 |
| -10 | 127,5 |
| 0 | 135,6 |
| +10 | 144,3 |
| +20 | 151,3 |
| +30 | 158,2 |
Таким образом, при увеличении температуры на 60 ° (от -30 °С до +30 °С) давление аргона в баллоне растет более чем на 40%.
ДЛЯ СПРАВКИ: аргон в 40-литровом баллоне при давлении 150 атм и комнатной температуре весит около 7,5 кг. При этом вес баллона, изготовленного из углеродистой стали, составляет 58,5 кг.
Техника безопасности при работе с аргоном
Газ не является ни токсичным, ни взрывоопасным, тем не менее, попадание излишнего количества аргона в воздух ведет к уменьшению в нем процентной доли кислорода, а это уже опасно для здоровья и жизни человека и может привести к кислородной недостаточности.
В обычном атмосферном воздухе содержится 20,9% кислорода, уменьшение его доли до 18% ведет к появлению головной боли и сонливости, при значении менее 15–16% человек теряет сознание.
В случае вдыхания аргона, так же как и других инертных газов, возникает мгновенное удушье и потеря сознания, чреватые летальным исходом.
Поэтому во время работы в замкнутом пространстве должны отсутствовать какие-либо утечки газа через уплотнения в соединениях трубопроводов или трещины в шлангах.
С особым вниманием за этим нужно следить при проведении сварки в слабопроветриваемых помещениях, а также приямках, где газ может скапливаться, поскольку тяжелее воздуха. Перед началом работы следует проверить содержание кислорода в окружающем пространстве – оно должно быть не менее 19%.
В противном случае необходимо надеть изолирующий противогаз, который предотвращает какой-либо контакт органов дыхания с окружающим воздухом. Работы в таких условиях проводят два человека.

Первая помощь в случае отравления газообразным аргоном заключается в эвакуации пострадавшего на свежий воздух, проведении искусственного дыхания, использовании кислородной подушки.
Жидкий аргон при попадании на тело человека может вызвать ожоги, поэтому, работая с ним, необходимо надевать защитные очки и спецодежду, способную предохранить поверхность тела от контакта с ним.
Все что нужно знать об аргоне простыми словами
Аргон, свойства атома, химические и физические свойства
Аргон, свойства атома, химические и физические свойства.
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Аргон |
| 102 | Прежнее название | |
| 103 | Латинское название | Argon |
| 104 | Английское название | Argon |
| 105 | Символ | Ar |
| 106 | Атомный номер (номер в таблице) | 18 |
| 107 | Тип | Неметалл |
| 108 | Группа | Инертный (благородный) газ |
| 109 | Открыт | Уильям Рамзай, Джон Уильям Стретт (лорд Рэлей), Великобритания, 1894 г. |
| 110 | Год открытия | 1894 г. |
| 111 | Внешний вид и пр. | Инертный газ без цвета, вкуса и запаха |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 1,292 % |
| 119 | Содержание в земной коре (по массе) | 0,00015 % |
| 120 | Содержание в морях и океанах (по массе) | 0,000045 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,02 % |
| 122 | Содержание в Солнце (по массе) | 0,007 % |
| 123 | Содержание в метеоритах (по массе) | |
| 124 | Содержание в организме человека (по массе) |
Свойства атома аргона :
Химические свойства аргона:
| 300 | Химические свойства | |
| 301 | Степени окисления | 0 |
| 302 | Валентность | 0 |
| 303 | Электроотрицательность | 4,3 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1520,57 кДж/моль (15,7596117(5) эВ) |
| 305 | Электродный потенциал | 0 |
| 306 | Энергия сродства атома к электрону | -96(20) кДж/моль (-1,0(2) эВ) – предположительно |
Физические свойства аргона:
1,3954 г/см 3 (при температуре кипения -185,848 °C и иных стандартных условиях, состояние вещества – жидкость),
Кристаллическая решётка аргона:
Дополнительные сведения:
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-37-1 |
Примечание:
* — доступно в платной версии.
Источники:
Вам также может понравиться
Кадмий, свойства атома, химические и физические свойства
Празеодим, свойства атома, химические и физические свойства
Серебро, свойства атома, химические и физические свойства
Выбрать язык
Разделы
ТОП 5 записей
Популярные записи
- Таблица молярных масс химических элементов
- Таблица оксидов
- Таблица электроотрицательности химических элементов
- Таблица кислот и кислотных остатков
- Таблица валентности химических элементов
- Таблица степеней окисления химических элементов
- Таблица и формулы оснований
- Таблица электронных формул атомов химических элементов
- Медь, свойства атома, химические и физические свойства
- Количество протонов, нейтронов и электронов химических элементов
Элементы, реакции, вещества
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Определения
На сайте показывается реклама.
Мы используем файлы cookie на нашем веб-сайте для улучшения функциональности. Нажимая “Разрешить все”, вы даете согласие на использование ВСЕХ файлов cookie. Однако вы можете посетить раздел "Настройки cookie", чтобы разрешить только определенные.
Обзор настроек конфиденциальности
Необходимые файлы cookie нужны для корректной работы веб-сайта. Эти файлы cookie могут также требоваться для обеспечения функций безопасности веб-сайта.| Cookie | Duration | Description |
|---|---|---|
| cookielawinfo-checkbox-advertisement | 1 year | Установленный плагином согласия на использование файлов cookie GDPR, этот файл cookie используется для записи согласия пользователя на использование файлов cookie в категории "Реклама". |
| cookielawinfo-checkbox-analytics | 11 months | Этот файл cookie устанавливается плагином Согласия на использование файлов cookie GDPR. Файл cookie используется для хранения согласия пользователя на использование файлов cookie в категории "Аналитика". |
| cookielawinfo-checkbox-functional | 11 months | Файл cookie устанавливается согласием GDPR на использование файлов cookie для записи согласия пользователя на использование файлов cookie в категории "Функциональные". |
| cookielawinfo-checkbox-necessary | 11 months | Этот файл cookie устанавливается плагином Согласия на использование файлов cookie GDPR. Файлы cookie используются для хранения согласия пользователя на использование файлов cookie в категории "Необходимые". |
| cookielawinfo-checkbox-others | 11 months | Этот файл cookie устанавливается плагином Согласия на использование файлов cookie GDPR. Файл cookie используется для хранения согласия пользователя на использование файлов cookie в категории "Другие. |
| cookielawinfo-checkbox-performance | 11 months | Этот файл cookie устанавливается плагином Согласия на использование файлов cookie GDPR. Файл cookie используется для хранения согласия пользователя на использование файлов cookie в категории "Производительность". |
| PHPSESSID | session | Этот файл cookie является родным для PHP-приложений. Файл cookie используется для хранения и идентификации уникального идентификатора сеанса пользователя с целью управления сеансом пользователя на веб-сайте. Файл cookie является сессионным файлом cookie и удаляется при закрытии всех окон браузера. |
| viewed_cookie_policy | 11 months | Файл cookie устанавливается плагином согласия на использование файлов cookie GDPR и используется для хранения того, дал ли пользователь согласие на использование файлов cookie. Он не хранит никаких персональных данных. |
Функциональные файлы cookie помогают выполнять определенные функции, такие как совместное использование содержимого веб-сайта на платформах социальных сетей, сбор отзывов и другие сторонние функции.
Файлы cookie производительности используются для понимания и анализа ключевых показателей производительности веб-сайта, что помогает улучшить пользовательский опыт для посетителей.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
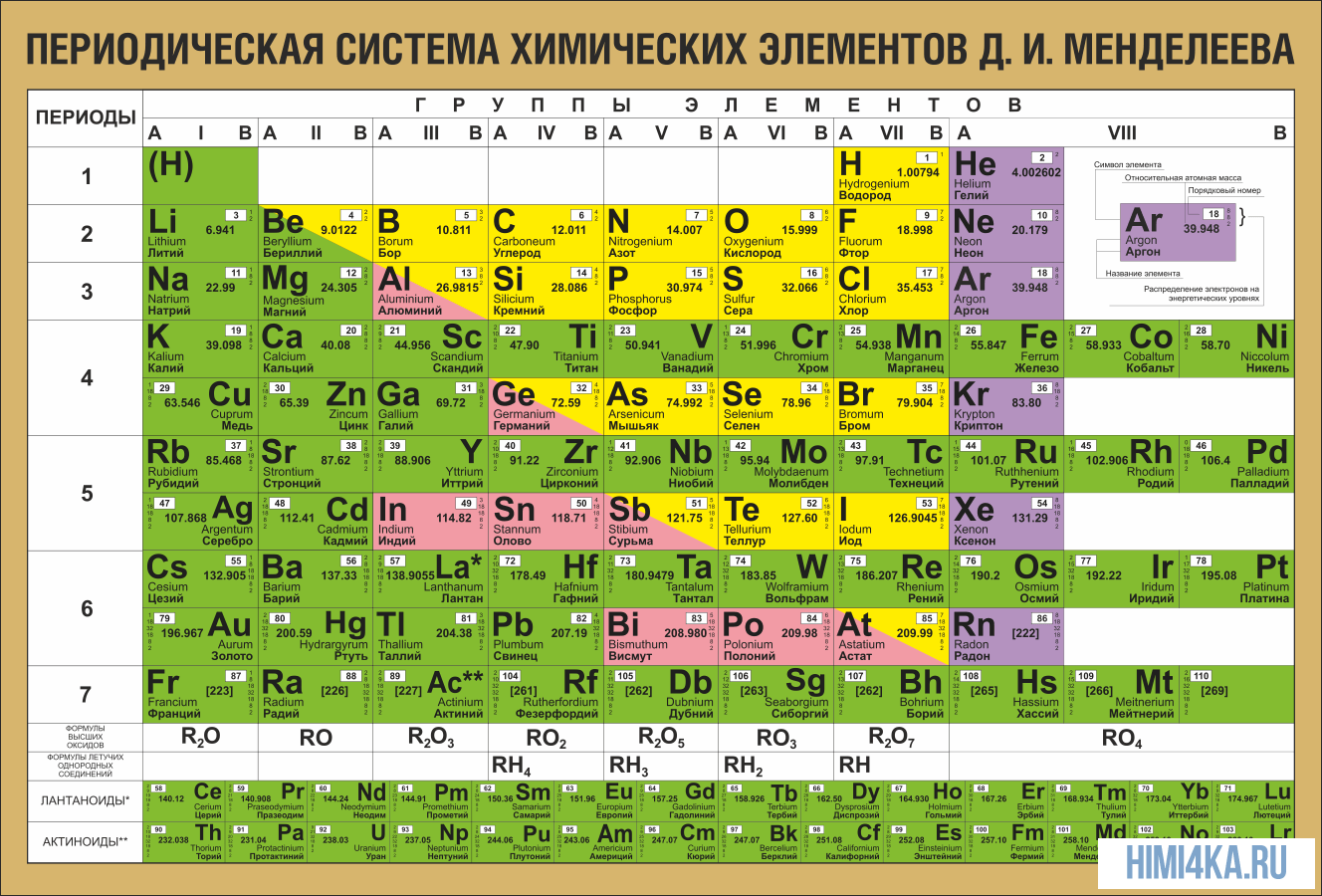
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.

Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Свойства таблицы Менделеева
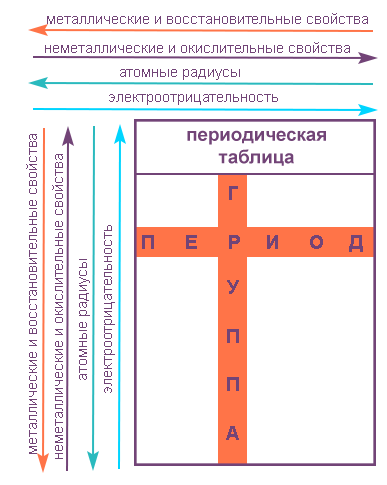
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Читайте также:
