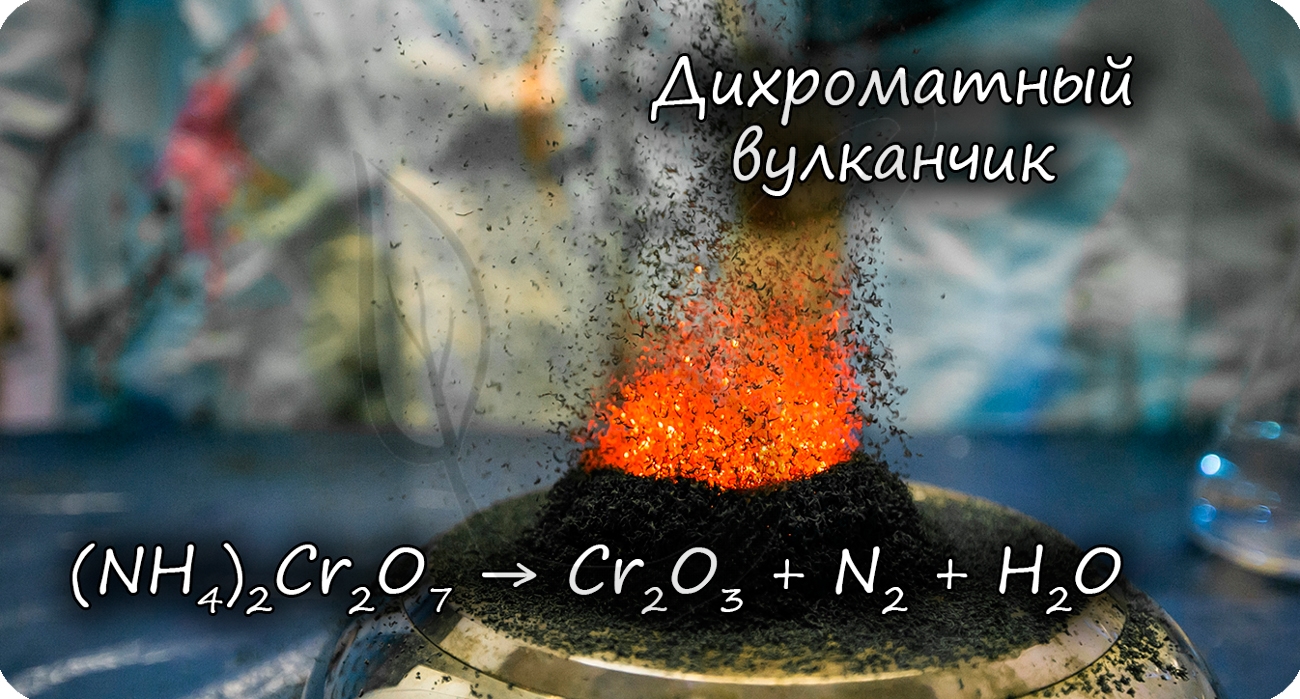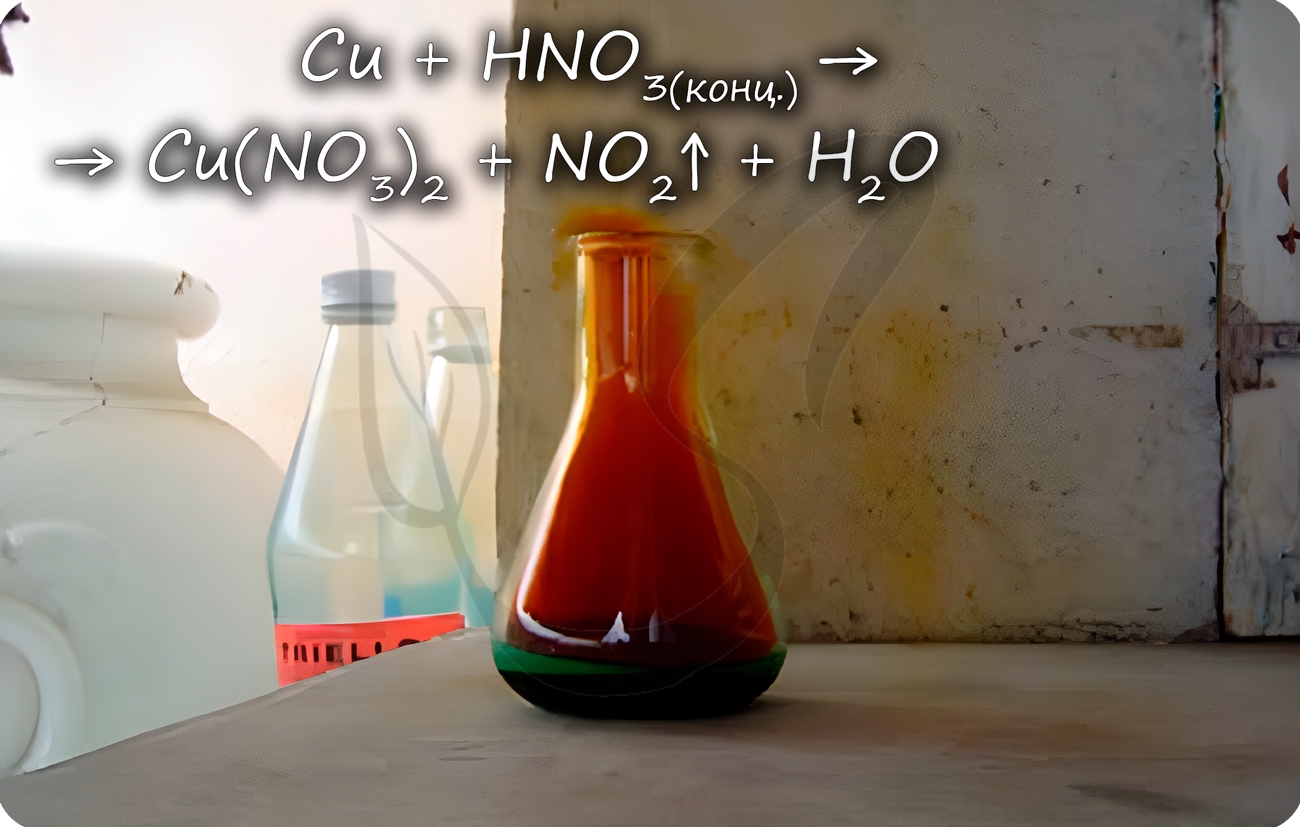Металлическая медь реагирует с
Обновлено: 17.05.2024
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Тренажер задания 31 по химии медиТренажер задания 31 из ЕГЭ по химии меди, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии меди с текстовыми решениями и ответами. 1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций. 2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций. 3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций. 4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций. 5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций. 6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций. 7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций. 8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций. 9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций. 10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций. 11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций. 12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций. 13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций. 14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций. 15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций. 16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций. 17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций. 18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций. 19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций. 20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций. 21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций. 22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций. 23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций. 24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций. CuO + CO → Cu + CO2 2CuCl2 + 2KI = 2CuCl↓ + I2 + 2KCl 25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций. 26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций. 27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций. Тест на химические свойства соединений меди, цинка и железа.Из приведенного списка простых веществ выберите два таких, которые взаимодействуют с железом. Ответ: 14 Из приведенного списка простых веществ выберите два таких, которые взаимодействуют с медью. Ответ: 34 Из приведенного списка простых веществ выберите два таких, которые взаимодействуют с цинком. Ответ: 25 Из приведенного списка простых веществ выберите два таких, которые не взаимодействуют с железом. Ответ: 35 Ответ: 5 Ответ: 13 Ответ: 145 Ответ: 134 Ответ: 1234 Ответ: 12 Ответ: 12345
Ответ: 1245 Ответ: 23 Ответ: 1235 Ответ: 135 Из приведенного списка веществ выберите два таких, которые взаимодействуют с нитратом железа (III). 2) нитрат серебра 3) нитрат меди(II) 5) хлорид хрома(III) Из приведенного списка веществ выберите два таких, которые взаимодействуют с нитратом железа(II). 1) азотная кислота 2) серная кислота(разб.) 3) серная кислота(конц.) 4) нитрат железа(III) Из приведенного списка веществ выберите два таких, которые взаимодействуют с нитратом меди. 3) нитрат свинца Из приведенного списка веществ выберите два таких, которые взаимодействуют с раствором нитрата цинка. 2) карбонат кальция 3) карбонат натрия 5) сульфид натрия Из приведенного списка веществ выберите два таких, которые взаимодействуют с бромидом железа(III). 4) нитрат серебра Ответ: 24 Из приведенного списка веществ выберите два таких, которые взаимодействуют с хлоридом железа(II). 5) сульфид меди (II) Из приведенного списка веществ выберите два таких, которые взаимодействуют с бромидом меди(II). 3) йодоводородная кислота 4) бромоводородная кислота 5) хлороводородная кислота Из приведенного списка веществ выберите два таких, которые взаимодействуют с йодидом цинка. 3) хлорид меди(II) 4) хлорид железа(III) Из приведенного списка веществ выберите два таких, которые не взаимодействуют с водным раствором нитрата железа (II). 3) сульфат натрия Из приведенного списка веществ выберите два таких, которые взаимодействуют с нитратом меди в водном растворе. 1) перекись водорода 2) серная кислота (разб.) 5) йодид аммония 1) карбонат свинца + нитрат железа(II) 2) карбонат калия + нитрат железа(III) 3) карбонат аммония + едкий натр 4) едкий натр + цинк 5) едкий натр + медь Ответ: 234 1) нитрат железа(II) + йодид натрия 2) нитрат железа(III) + йодид калия 3) сульфат меди + бромид аммония 4) сульфат меди + бромид бария 5) сульфат меди + иодид натрия Ответ: 245 1) гидроксид меди + гидроксид натрия 2) гидроксид железа (II) + гидроксид цезия 3) гидроксид хрома (III) + поташ 4) гидроксид железа (II) + едкое кали 5) гидроксид цинка + гидроксид стронция 1) нитрат алюминия + сульфид натрия 2) нитрат меди + сульфид натрия 3) нитрат железа(III) + сульфид натрия 4) гидроксид цинка + нитрат аммони 5) хлорид железа(III) + карбонат калия Из предложенного перечня выберите те пары реагентов, при смешении которых в водном растворе не наблюдается образование осадка. 1) нитрат меди + сероводород 2) нитрат железа(III) + сероводород 3) нитрат цинка + сероводород 4) хлорид меди(II) + едкий натр(избыток) 5) едкий натр(избыток) + бромид цинка Из приведённого перечня выберите те реагенты, между которыми невозможна реакция в водном растворе. 1) сульфат цинка + сернистый газ 2) сульфат железа (III) + сернистый газ 3) сульфат железа (II) + сернистый газ 4) сульфат железа (III) + сероводород 5) сульфат цинка + сероводород Из предложенного перечня выберите те реагенты, при смешении которых не наблюдается растворение осадка. 1) сульфид меди (II) + соляная кислота 2) сульфид цинка + соляная кислота 3) сульфид железа (II) + соляная кислота 4) сульфид меди (I) + азотная кислота(конц.) 5) сульфид меди (II) + азотная кислота(конц.) Ответ: 1 Из приведённого перечня выберите те реагенты, при смешении которых в водном растворе наблюдается выделение газа. 1) сульфат железа (III) + карбонат калия 2) сульфат меди (II) + карбонат кальция 3) сульфид цинка + бромоводородная кислота 4) сульфид меди + фосфорная кислота 5) карбонат цинка + азотная кислота Из приведённого перечня выберите такое вещество, с которым способно реагировать железо. Запишите уравнение этой реакции Ответ: 2Fe + 3Br2 = 2FeBr3 В какой из приведенных пар веществ возможна окислительно-восстановительная реакция? 1) гидроксид железа (III) + соляная кислота 2) гидроксид железа (II) + соляная кислота 3) гидроксид железа (III) + бромоводородная кислота 4) гидроксид железа (II) + плавиковая кислота 5) гидроксид железа (III) + йодоводородная кислота 1) хлорид железа(III) + нитрат серебра 2) бромид железа(II) + нитрат свинца 3) хлорид железа(III) + сульфид натрия 4) бромид железа(II) + сульфид калия 5) хлорид железа(III) + нитрат меди Ответ: 2FeCl3 + 3Na2S = 2FeS + S + 6NaCl 1) сульфат железа(III) + карбонат калия 2) сульфат железа(II) сульфат аммония 3) сульфат железа(III) + сульфит натрия 4) сульфат железа(II) + карбонат цинка 5) сульфат железа(III) + нитрат меди Из приведенного перечня веществ выберите такое, с которым способна взаимодействовать металлическая медь. 1) хлорид хрома (II) 2) бромид марганца (II) 4) бромид железа (II) 5) хлорид железа (III) Ответ: Cu + 2FeCl3 = CuCl2 + 2FeCl2 Из приведенного перечня выберите такую пару реагентов, между которыми возможна окислительно-восстановительная реакция. 1) хлорид меди(II) + нитрат серебра 2) бромид меди(II) + фторид аммония 3) сульфат меди(II) + иодид калия 4) нитрат меди(II) + сульфат бария 5) хлорид меди(II) + бромид железа (III) Из приведенного перечня веществ выберите такое, которое способно вступать в реакцию с металлической медью. Ответ: 2Cu + I2 = 2CuI Из приведенного перечня веществ выберите такое, которое способно вступать в реакцию с металлическим цинком. 1) гидроксид алюминия 2) гидроксид бериллия 3) гидроксид железа(II) 4) гидроксид калия(раствор) 5) гидроксид меди(II) Железо растворили в горячей концентрированной серной кислоте. Железо растворили в горячей концентрированной азотной кислоте. Запишите уравнение реакции, протекающей при обжиге сульфида железа(II). Запишите уравнение реакции, протекающей при обжиге пирита. Запишите уравнение реакции, протекающей при образовании железной окалины из простых веществ. Запишите уравнение реакции, протекающей между железной окалиной и избытком соляной кислоты. Запишите уравнение реакции, протекающей между железной окалиной и концентрированной азотной кислотой. Запишите уравнение реакции, протекающей между железной окалиной и йодоводородной кислотой. Запишите уравнение реакции, протекающей между оксидом железа(II) и концентрированной азотной кислотой. Запишите уравнение реакции, протекающей при сплавлении порошков железа и оксида железа(III) Ответ: Fe2O3 + Fe = 3FeO Запишите уравнение реакции, протекающей при сплавлении едкого натра и оксида железа(III). Запишите уравнение реакции, протекающей между медным порошком и концентрированной азотной кислотой. Запишите уравнение реакции, протекающей между медным порошком и разбавленной азотной кислотой. Запишите уравнение реакции, протекающей между оксидом меди(I) и концентрированной азотной кислотой. Запишите уравнение реакции, протекающей между оксидом меди(I) и концентрированной серной кислотой. Запишите уравнение реакции, протекающей между концентрированной азотной кислотой и сульфидом меди(II). Запишите уравнение реакции, протекающей при обжиге сульфида меди(II) в токе кислорода. Ответ: 2CuS + 3O2 = 2CuO + 2SO2 Запишите уравнение реакции, протекающей между металлическим цинком и раствором гидроксида натрия. Запишите уравнение реакции, протекающей при сплавлении оксида цинка с гидроксидом калия. Ответ: 2KOH + ZnO = K2ZnO2 + H2O Запишите уравнение реакции, протекающей при обжиге сульфида цинка в токе кислорода. Ответ: 2ZnS + 3O2 = 2ZnO + 2SO2 Установите соответствие между формулой вещества и набором реагентов, с каждым из которых оно может взаимодействовать. Запишите в таблицу выбранные цифры под соответствующими буквами. Ответ: 413 Ответ: 342 Ответ: 411 Ответ: 214 Установите соответствие между формулой/названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать. Ответ: 241 Ответ: 124 Ответ: 412 Ответ: 423 Навеску сплава меди и цинка массой 10 г растворили в необходимом количестве концентрированной азотной кислоты. Определите массовую долю цинка в сплаве, если при пропускании через полученный раствор сероводорода выпало 9,6 г черного осадка. Ответ округлите до целых. Ответ: 36 Навеску смеси железного и цинкового порошков массой 2,33 г обработали избытком разбавленной соляной кислоты. При этом выделилось 896 мл газа. При обработке такой же навески избытком раствора едкого кали выделилось 224 мл газа. Определите массовую долю железа в сплаве. Ответ укажите в процентах и округлите до десятых. Ответ: 72,1 При полном окислении навески порошков меди и железа было израсходовано 4,48 л хлора. При внесении такой же навески в избыток бромоводородной кислоты выделилось 2,24 л газа. Определите массовую долю меди в сплаве. Ответ округлите до десятых. Ответ: 36,4 Смесь железных и цинковых опилок массой 1,815 г растворили в 200 г 18,25% соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе, если известно, что массовая доля железа в исходной смеси 46,28%. Ответ округлите до целых. Ответ: 17 Рассчитайте массу угарного газа, необходимого для полного восстановления твердого остатка, полученного при прокаливании смеси 9 г нитрата железа(II) и 9,4 г нитрата меди. Ответ округлите до десятых. Ответ: 3,5 Рассчитайте объем 30%-ного раствора серной кислоты, необходимой для растворения твердого остатка, полученного при разложении смеси 2,1 г карбоната магния и 18,9 г нитрата цинка. Плотность раствора серной кислоты 1,3 г/см 3 . Ответ округлите до десятых. Ответ: 31,4 Вычислите массу осадка, который выпадет при пропускании 11,2 л сероводорода через раствор, полученный при взаимодействии 3,2 г меди и 10,87 мл 80%-ного раствора азотной кислоты (плотность 1,45 г/см 3 ). Ответ округлите до десятых. Ответ: 4,8 Навеску меди массой 12,8 г внесли в 300 мл 70% раствора азотной кислоты (плотность 1,35 г/мл). После окончания реакции к раствору добавили 100 мл 10% поташа (плотность 1,1 г/см 3 ). Определите массовую долю кислоты в полученном растворе. Ответ округлите до десятых. Ответ: 44,1 Навеску оксида меди(I) массой 3,6 г полностью растворили в избытке концентрированной серной кислоты. Полученный раствор имел массу 50 г. Далее в раствор погрузили графитовые электроды и проводили процесс электролиза до выделения на аноде 112 мл газа. Определите массовую долю соли в полученном растворе. Ответ округлите до сотых. Ответ: 13,01 При электролизе раствора хлорида меди(II) на аноде выделилось 6,72 л газа. Полученный на катоде металл растворили в необходимом количестве концентрированной азотной кислоты. Рассчитайте объем сероводорода, необходимый для полного осаждения меди из полученного раствора. Ответ округлите до сотых. Ответ: 6,72 Навеску нитрата серебра массой 17 г растворили в воде и проводили электролиз полученного раствора до выделения на аноде 224 мл газа. Определите массу хлороводорода, необходимого для полного осаждения оставшегося серебра из раствора. Ответ округлите до сотых. Ответ: 2,19 Навеску нитрата меди массой 9,4 г растворили в воде и проводили электролиз полученного раствора до выделения на аноде 448 мл газа. Определите массу 20% раствора гидроксида натрия, необходимую для полного осаждения оставшегося металла из раствора. Ответ округлите до целых. Ответ: 20 При электролизе 100 г раствора сульфата меди масса на электродах выделилось 1,6 г веществ. Определите массу 10 %-ного раствора нитрата бария, необходимую для полного осаждения сульфат-ионов из исходного раствора. Ответ округлите до десятых. Ответ: 52,2 Навеску бромида меди(II) растворили в 50 мл воды и проводили электролиз полученного раствора до полного расходования соли. Определите массовую долю соли в исходном растворе, если полученное на аноде вещество может прореагировать с 30 мл 10% раствора гидроксида калия (плотность 1,12 г/см 3 ). Ответ округлите до сотых. Ответ: 11,85 Навеску нитрата железа (III) массой 12,1 г подвергли термическому разложению. Определите объем газа, который выделится при сплавлении полученного твердого остатка с поташом. Ответ укажите в литрах и округлите до сотых. Ответ: 0,56 Навеску смеси нитрата меди и нитрата цинка с массовой долей нитрата цинка 50% полностью разложили при нагревании. Определите суммарный объем выделившихся газов, если известно, что полученный твердый остаток может прореагировать с 100 г 10%-ного раствора гидроксида натрия. Ответ округлите до целых. Навеску смеси карбоната и нитрата цинка обработали избытком соляной кислоты. При этом выделилось 6,72 л газа. При прокаливании такой же навески выделилось 17,92 л газов. Определите массовую долю карбоната цинка в исходной смеси. Ответ округлите до десятых. Ответ: 49,8 Навеску нитрата меди массой 47 г подвергли частичному разложению при нагревании. Полученный твердый остаток внесли в 200 мл 20% раствора гидроксида натрия (плотность 1,1 г/см 3 ). Определите массовую долю щелочи в полученном растворе, если известно, что при прокаливании навески выделилось 11,2 л газов. Ответ округлите до десятых. Хром, железо и медьТвердый металл голубовато-белого цвета. Этимология слова "хром" берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.
Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 - амфотерные, +6 - кислотные.
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) - Cr2O3 - происходит пассивирование. Реагирует с неметаллами при нагревании.
Протекает в раскаленном состоянии.
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании. Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него. Соединения хрома (II) Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы - оксида хрома (III), реагирует с кислотами, кислотными оксидами.
Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.
Соединения хрома (III) Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).
Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании - смешанные оксиды. С кислотами оксид хрома (III) образует различные соли. H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия) Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия) Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr +3 )
Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии). При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде). Соединения хрома (VI) В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) - CrO3, и две кислоты, находящиеся в растворе в состоянии равновесия: хромовая - H2CrO4 и дихромовая кислоты - H2Cr2O7. Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы - в оранжевый цвет.
Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый. Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый - образуется хромат. Разложение дихромата аммония выглядит очень эффектно и носит название "вулканчик" :)
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства. ЖелезоЯвляется одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.
Для железа характерны две основные степени окисления +2, +3, +6.
Получают железо восстановлением из его оксида - руды. Восстанавливают с помощью угарного газа, водорода. Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.
Fe + S = FeS (t > 700°C) Fe + S = FeS2 (t 2+ в растворе является реакция с красной кровяной солью - K3[Fe(CN)6] - гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий). Качественной реакцией на ионы Fe 2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета. Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами. Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия) При сплавлении комплексные соли не образуются из-за испарения воды. Гидроксид железа (III) - ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании легко распадается на воду и соответствующий оксид.
Качественной реакцией на ионы Fe 3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий). Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.
И еще одна качественная реакция на ионы Fe 3+ - взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок бурого цвета. Соединения железа (VI) - ферраты - соли несуществующей в свободном виде железной кислоты. Обладают выраженными окислительными свойствами. Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.
Основные степени окисления меди +1, +2.
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов. Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди более активными металлами, например - железом.
Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде. CuSO4 + H2O = Cu + O2 + H2SO4 (медь - на катоде, кислород - на аноде) Во влажном воздухе окисляется с образованием основного карбоната меди. При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом. 4Cu + O2 = (t) 2Cu2O (при недостатке кислорода) 2Cu + O2 = (t) 2CuO (в избытке кислорода)
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной - реакция идет.
Реагирует с царской водкой - смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl. Медь способна восстанавливать неметаллы из их оксидов. Cu + SO2 = (t) CuO + S Cu + NO = (t) CuO + N2↑ Соединения меди IВ степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II). Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом. Оксид меди (I) окисляется кислородом до оксида меди (II). Оксид меди (I) вступает в реакции с кислотами. Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду. Соединения меди (II)Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства. Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
CuO + CO = Cu + CO2 Гидроксид меди (II) - Cu(OH)2 - получают в реакциях обмена между растворимыми солями меди и щелочью.
При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду. Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс. Обратите особое внимание на реакцию взаимодействия соли меди (II) - сульфата меди (II), карбоната натрия и воды. Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. Читайте также:
|