Растворимость углерода в металлах
Обновлено: 27.09.2024
Наличие двух высокоуглеродистых фаз (графита и цементита) приводит к появлению двух диаграмм состояний: метастабильной – железо-цементит и стабильной – железо-графит. Свободная энергия цементита всегда больше, чем свободная энергия графита.
Кристаллические структуры цементита и аустенита близки, тогда как кристаллические структуры аустенита и графита существенно различны. По составу аустенит и цементит ближе друг к другу и составу жидкой фазы, чем аустенит и графит (аустенит содержит до 2,14 %С, цементит – 6,67 %С, графит – 100 %C. Поэтому образование цементита из жидкости или из аустенита происходит легче, работа образования зародыша, как и необходимые диффузионные изменения, меньше в случае кристаллизации цементита, чем при кристаллизации графита, несмотря на меньший выигрыш свободной энергии.
Диаграмма состояний железо-цементит приведена на рис.3.1.
Линии диаграммы: АВСВD (линия ликвидус – соответствует температурам начала кристаллизации) и AHJECF (линия солидус – соответствует температурам конца кристаллизации) характеризуют начало и конец первичной кристаллизации, происходящей при затвердевании жидкой фазы. Линии ES и PQ показывают предельную растворимость углерода соответственно в аустените и феррите. При понижении температуры растворимость уменьшается и избыток углерода выделяется в виде цементита.
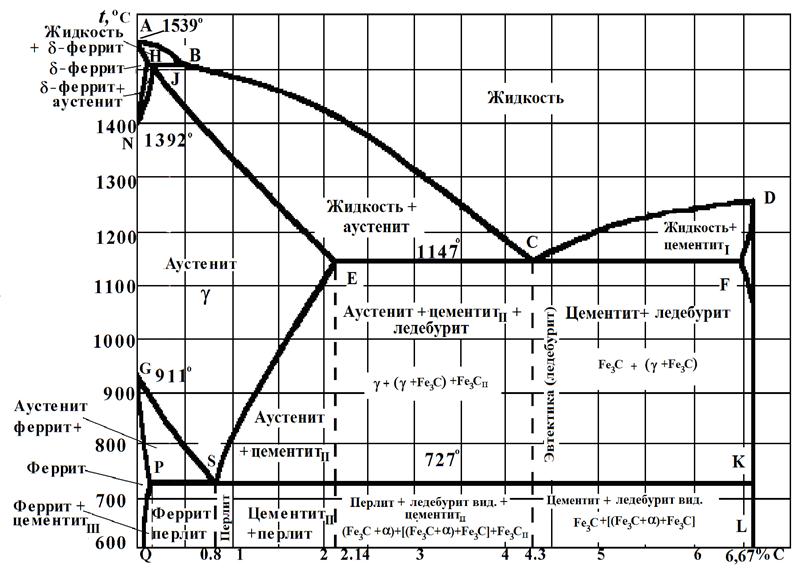
Рис, 3.1. Диаграмма состояний железо-цементит (Fe – Fe3C)
Цементит, выделяющийся из жидкого сплава, принято называть первичным, из аустенита – вторичным, из феррита – третичным.
Три горизонтальные линии HJВ, ЕСF и PSK указывают на протекание трех превращений при постоянной температуре. При 1499 о С (горизонталь HJВ) происходит перитектическая реакция LB + ФН®АJ, в результате которой образуется аустенит.
При 1147 о С (горизонталь ЕСF)протекает эвтектическая реакция LС ®АС + Ц (жидкость, состав которой соответствует точке С превращается в эвтектическую смесь аустенита, состав которого соответствует точке Е, и цементита. Эта эвтектическая смесь аустенита и цементита называется ледебурит.
При 727 о С (горизонталь PSK) протекает эвтектоидная реакция A → ФР +Ц(в отличие от эвтектики, образующейся из жидкости, эвтектоидная смесь получается в результате распада твердого раствора). Продукт превращения – эвтектоидная смесь феррита и цементита, называемая перлитом. Перлит чаще имеет пластинчатое строение, то есть состоит из чередующихся пластинок феррита и цементита. После специальной термической обработки перлит может иметь зернистое строение.
Однофазные области диаграммы Fe - Fe3C: жидкий расплав (L) – выше линии АВСD, феррит (Ф) – области ANH и GPQ, аустенит (А) – область JESGN и цементит (Ц) – при содержании 6,67 % С.
Двухфазные области диаграммы: AHB – в равновесии находится жидкий расплав и кристаллы δ -феррита, NHJ –в равновесии кристаллы δ -феррита и аустенита, JECB – в равновесии жидкий расплав и кристаллы аустенита, CDF – в равновесии жидкий расплав и кристаллы цементита, SECFK – в равновесии кристаллы аустенита и цементита, GSP –вравновесии кристаллы аустенита и α -феррита, QPSKL – в равновесии кристаллы α - феррита и цементита.
Сплавы железа с углеродом, содержащие до 0,02% С, называют техническим железом.
Сплавы железа с углеродом при содержании углерода от 0,02 до 2,14% носят название сталей (от 0,02 до 0,8% – доэвтектоидные стали, от 0,8 до 2,14 % – заэвтектоидные стали).
Сплавы железа с углеродом , содержащие от 2,14 до 6,67 % С называются чугунами (от 2,14 до 4,3 % С – доэвтектические, от 4,3 до 6,67 % С – заэвтектические чугуны).
В двухфазных областях в любой точке можно определить количество фаз и их концентрацию, используя правило отрезков. Например, определим химический состав и количество фаз для сплава системы железо-цементит в точке а, находящейся в области GSP (рис.3.2).
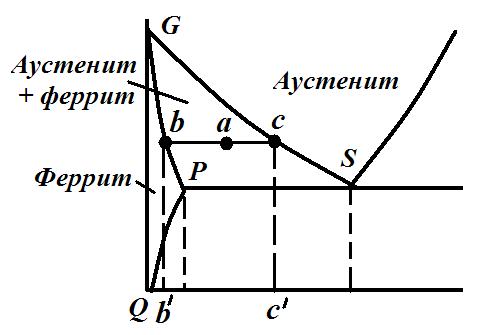
Рис.3.2. Использование правила отрезков для анализа диаграммы
В этой области структурные составляющие – феррит и аустенит. Проведем горизонтальную линию через точку а до пересечения с линиями GP (точка b) и GS (точка с). Проекция точки b (b / ) указывает химический состав феррита, а проекция точки с (с / ) – состав аустенита. Весовое содержание аустенита а феррита
Рассмотрим кристаллизацию некоторых сплавов, содержащих различное количество углерода. При анализе кристаллизации доэвтектоидной стали проведем для примера расчет числа степеней свободы по формуле с = k – f +1, где с – число степеней свободы, k – количество компонентов, f – число фаз.
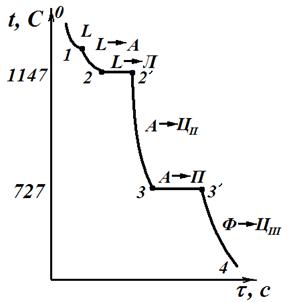
Кристаллизация доэвтектоидной стали, содержащей более 0,51 % С (рис. 3.3), начинается в точке 1, где в жидкой фазе зарождаются первые зерна аустенита, и заканчивается в точке 2. В процессе кристаллизации состав жидкой фазы изменяется по линии ликвидус BС, а аустенита по линии солидус JE. Между точками 1 и 2 число степеней свободы с = 2 – 2 + 1 = 1 (два компонента – железо и углерод, две фазы – жидкость и аустенит), следовательно, процесс может идти со снижением температуры. После затвердевания сплав имеет однофазную структуру аустенита. Между точками 2 и 3 идет охлаждение аустенита. Между точками 2 и 3 число степеней свободы с = 2 – 1 + 1 = 2 (два компонента – железо и углерод, одна фаза – аустенит), следовательно, процесс может идти со снижением температуры. В интервале от точки 3 до точки 4 происходит превращение: аустенит ® низкоуглеродистый феррит. При этом аустенит обогащается углеродом в соответствии с линией GS и в точке 4 концентрация углерода в нем достигает эвтектоидной – 0,8% С. Между точками 3 и 4 число степеней свободы с = 2 – 2 + 1 = 1 (два компонента – железо и углерод, две фазы – аустенит и цементит), следовательно, процесс может идти со снижением температуры. При постоянной температуре 727 °С (площадка 4-4') происходит эвтектоидное превращение A → ФР +Ц – аустенита в мелкодисперсную смесь феррита и цементита, называемую перлитом. В точке 4 число степеней свободы с = 2 – 3 + 1 = 0 (два компонента – железо и углерод, три фазы – аустенит, феррит и цементит), что подтверждает выделение перлита при постоянной температуре. При дальнейшем охлаждении до точки 5 происходит выделение из феррита избыточного углерода (в связи с понижением растворимости по линии диаграммы PQ) в виде третичного цементита. Между точками 4 и 5 число степеней свободы с = 2 – 2 + 1 = 1 (два компонента – железо и углерод, две фазы – феррит и цементит), следовательно, процесс может идти со снижением температуры. Конечная структура Ф + П +ЦIII (феррито-перлитная).
Количественное соотношение между ферритом и перлитом в доэвтектоидных сталях определяется содержанием углерода (чем выше содержание углерода, тем больше перлита).
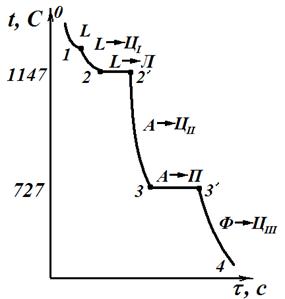
Кристаллизация зазвтектоидных сталей (рис.3.4) начинается в точке 1 выделением из жидкого расплава аустенита и заканчивается в точке 2. Состав жидкого расплава изменяется по линии BС, а аустенита – по линии JE. После затвердевания сплав имеет однофазную структуру аустенита. При дальнейшем охлаждении от точки 2 до точки 3 структурных превращений сталь не претерпевает, идет простое охлаждение. В интервале точек 3-4 происходит выделение вторичного цементита в связи с уменьшением растворимости углерода в аустените согласно линии ES диаграммы. При медленном охлаждении цементит выделяется по границе аустенитных зерен. Составаустенита изменяется согласно линии ES и в точке 4 при температуре 727 °С аустенит содержит 0,8% С. На линии SK (на кривой – площадка 4-4') происходит эвтектоидное превращение аустенита в перлит. При дальнейшем охлаждении ниже точки 4 из феррита, входящего в перлит, выделяется третичный цементит. Третичный цементит, наслаиваясь на кристаллы вторичного цементита и цементита перлита, не оказывает заметное влияние на свойства. Поэтому при рассмотрении структур заэвтектоидных сталей о третичном цементите обычно не упоминают. Конечная структура П +ЦII +ЦIII – перлито-цементитная.
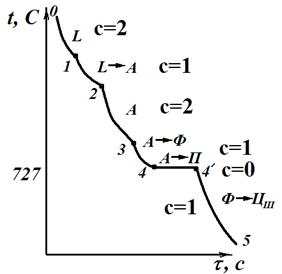 | 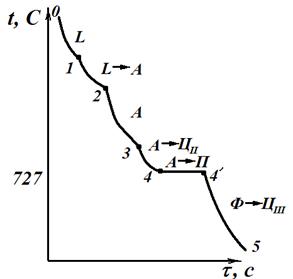 |
| Рис.3.3. Сплав 1 (доэвтектоидная сталь) | Рис.3.4. Сплав 2 (заэвтектоидная сталь) |
 |  |
| Рис.3.6. Сплав 3 (доэвтектический чугун) | Рис.3.7 Сплав 4 (заэвтектический чугун) |
Доэвтектические чугуны (рис.3.5) начинают кристаллизацию в точке 1, где при последующем охлаждении происходит выделение из жидкой фазы кристаллов аустенита переменного состава, концентрация которого определяется линией JE , а жидкого расплава – линией ликвидус BС. В точке 2 содержание углерода в расплаве достигает 4,3% и при постоянной температуре 1147 °С оставшийся расплав кристаллизуется в эвтектику (дисперсную смесь аустенита, содержащего 2,14%С, и цементита), называемой ледебуритом LC →АE+Ц. Ледебурит имеет сотовое или пластинчатое строение. При дальнейшем охлаждении (участок 2 - 3) аналогично заэвтектоидной стали из аустенита (структурно свободного и входящего в состав ледебурита) выделяется избыточный углерод в виде вторичного цементита. Аустенит при этом обедняется углеродом и при температуре 727 °С приобретает состав, соответствующий эвтектоидному. В точке 3 начинается эвтектоидное превращение аустенита в перлит при постоянной температуре 727 °С (площадка 3-3 / ). Перлит образуется из структурно свободного аустенита и из аустенита, входящего в состав ледебурита. Ледебурит, состоящий из смеси цементита и перлита, носит название видоизмененного ледебурита Лвид (П+Ц) в отличие от ледебурита состава Л (А+Ц). При дальнейшем охлаждении от точки 3 / до точки 4 происходит выделение избыточного углерода из феррита, входящего в перлит и видоизмененный ледебурит, в виде третичного цементита, наслаивающегося на цементит перлита и ледебурита. Третичный цементит не влияет на свойства чугунов из-за незначительного количества, по сравнению с общим количеством цементита в чугунах. Конечный состав доэвтектического чугуна П+Лвид+ЦII, поэтому такой чугун называют перлито-ледебурито-цементитным чугуном.
Кристаллизация заэвтектических чугунов (рис.3.6) начинается в точке 1 выделением из жидкого расплава первичного цементита. При этом состав расплава изменяется по линии DC. Выделяя высокоуглеродистую фазу – цементит, расплав обедняется углеродом и при температуре 1147 °С содержит 4,3% С. При постоянной температуре расплав кристаллизуется с образованием ледебурита. При дальнейшем охлаждении из аустенита, входящего в ледебурит, выделяется избыточный углерод в виде вторичного цементита, и состав аустенита изменяется по линии ES . При достижении температуры 727 °С аустенит, содержащий 0,8% С, превращается в перлит A → ФР +Ци образуется видоизмененный ледебурит. При дальнейшем охлаждении от точки 3 / до точки 4 из феррита, входящего в состав перлита видоизмененного ледебурита, выделяется избыточный углерод согласно кривой РQ в виде третичного цементита, наслаивающегося на цементит перлита. Конечная структура заэвтектического чугуна Лвид +ЦI +ЦII носит название ледебуритно-цементитного чугуна.
Таким образом, у всех сталей, содержащих менее 2,14% С, в результате первичной кристаллизации получается структура аустенита, а после затвердевания не содержится хрупкой структурной составляющей - ледебурита; у всех чугунов, содержащих более 2,14% С, структура первичной кристаллизации состоит из ледебурита с первичным аустенитом или це-ментитом, а при комнатной температуре структура состоит из видоизме-ненного ледебурита, цементита и, у доэвтектического чугуна, перлита.
Стали при высоком нагреве имеют аустенитную структуру, обладающую высокой пластичностью, поэтому они легко деформируются при нормальных и повышенных температурах.
Чугуны обладают лучшими литейными свойствами, в том числе более низкой температурой плавления и имеют меньшую усадку.
Большая Энциклопедия Нефти и Газа
Растворимость углерода в жидком металле существенно изменяется при введении добавки другого элемента, причем эти изменения могут быть как в сторону уменьшения, так и в сторону увеличения растворимости. С этой точки зрения исследовались в основном металлы, используемые при производстве стали: железо, никель, кобальт и марганец. [1]
Растворимость углерода и других примесей в жидкой стали значительно выше, чем в твердой. Когда расплавляется металл и образуется ванна, в нее устремляются углерод, фосфор и сера. Тонкий слой основного металла, примыкающий к жидкой ванне, обедняется примесями. Жидкий металл по границе с твердым насыщается ими. Когда начинается кристаллизация, тонкий слой кристаллов, образовавшихся из жидкости с повышенной концентрацией примесей, захватывает эти примеси. За этим слоем расположен слой, содержание примесей в котором приблизительно равно среднему содержанию их в жидком металле сварочной ванны. Третий слой примыкает к временной границе раздела между жидким и твердым металлом, образующейся при перерыве кристаллизации. Из него примеси успевают продиффундиро-вать в жидкий металл. В слое, примыкающем к временной границе раздела, содержание примесей снижается, а в жидком металле повышается. Таким образом, каждая чешуйка металла сварного шва состоит из трех слоев: нижнего с повышенным содержанием примесей, среднего с нормальным средним содержанием примесей и верхнего, обедненного примесями. [2]
Растворимость углерода в Fea невелика и составляет от 0 01 % при температуре О С до 0 02 % при температуре 727 С. [3]
Растворимость углерода в Незначительно больше, чем в Fea, и достигает 2 14 % при температуре 1 147 С. Аустенит в железоуглеродистых сплавах существует только при высоких температурах. [4]
Растворимость углерода , азота, кислорода - элементов, ответственных за дисперсионное твердение, в высоколегированных сталях невелика и тем меньше, чем больше степень легирования. [6]
Растворимость углерода и других примесей в жидком металле значительно выше, чем в твердом; это создает неоднородность по углероду и примесям различных слоев наплавленного металла. Поэтому и структура наплавленного металла представляет собой смесь зерен феррита и перлита со значительной химической неоднородностью. [7]
Растворимость углерода в платине в твердом состоянии нсчезающе мала. Форма выделяющегося графита зависит от условий кристаллизации и тигля, в котором проводится плавка. При использовании графитового тигля и плавке в высокочастотной электрической печи графит выделяется в виде игл, а при дуговой плавке он принимает шаровидную форму. [8]
Растворимость углерода в ниобии при эвтектической температуре имеет высокое значение, однако величина ее до сих пор дискутируется. Так, по данным [7], она составляет 0 8 мае. С уменьшением температуры растворимость быстро падает и при низких - и комнатной температурах становится незначительной. [10]
Растворимость углерода в молибдене, по различным данным, имеет значительные расхождения: от 0 02 до 0 14 мае. Образующиеся в системе Мо-С карбиды Мо2С и два нестехиометри-ческих МоСц - х по своим термодинамическим характеристикам могут рассматриваться не как эффективные с точки зрения жаропрочности, а только как способствующие возникновению хрупкости металла. [11]
Растворимость углерода в железе зависит от того, в какой кристаллической форме оно существует; а-железо почти не растворяет Углерода ( 0 0025 % при 20 С), в у-железе при 1 130 С растворяется около 2 % углерода. [12]
Растворимость углерода в а-фазе составляет 0 48 % С при температуре перитектоидной реакции и резко уменьшается с температурой ( рис. IV. По этой причине при содержании углерода более 0 1 % в структуре появляются выделения карбидов. Углерод оказывает на свойства титана меньшее влияние, чем кислород и азот. Прочностные свойства титана повышаются до содержания 0 3 % вес. [14]
Растворимость углерода в обеих модификациях титана невелика: в a - Ti до 2, в p - Ti до 4 ат. Карбид титана достаточно жаропрочен до температуры 1000 - 1200, на его поверхности образуется пленка из оксикарбидов, предохраняющая его от окисления. Кислоты и щелочи действуют на TiC слабо; разложить его можно, действуя царской водкой или сплавляя с щелочами. [15]
В горне вагранки продолжается процесс растворения углерода в жидком металле, если это растворение не достигло предела насыщения в III и IV зонах. Первые порции чугуна растворяют в себе серу из поверхности кусков кокса, находящихся в горне. Поэтому первые порции металла значительно более насыщены серой. [2]
В нижней части домны при высокой температуре происходит процесс растворения углерода в железе. Образующийся жидкий чугун стекает вниз, а более легкие шлаки всплывают кверху. [3]
Краевой угол смачивания и вязкость припоя в существенной мере определяются процессами растворения углерода в жидком расплаве при пропитке. При пайке графита с графитом припоями из переходных металлов IV группы ( титан, цирконий, гафний) температурная зависимость глубины пропитки носит экстремальный - характер. [4]
Исследование растворимости в переходных металлах проводили авторы работ [58, 59], которые на основании проведенных экспериментов пришли к выводу, что природа процесса растворения углерода в этих металлах радикально отличается от процесса растворения других твердых веществ. [5]
Нет данных о коэффициенте диффузии углерода в титан, однако практика термической обработки титана и опыт производства твердых сплавов показывают, что процесс растворения углерода в титане протекает весьма медленно. [6]
Таким образом, на основе ускоренного метода расчета равновесия и современных экспериментальных данньгх выведены простые и удобные для практических целей уравнения равновесия процесса растворения углерода в жидком железе. Рассчитаны вспомогательные функции М и N для различных концентраций графита, растворенного в жидком железе, что позволяет применить ускоренные методы расчета равновесия для любых реакций с участием растворенного в жидкой стали ( или в жидком чугуне) углерода при различных его концентрациях. [7]
Если вагранка имеет копильник, то угар металла при прохождении его через горн будет минимальным. В горне продолжается процесс растворения углерода в жидком металле, если это растворение не достигло предела насыщения в расположенных выше зонах / / / и IV. Пределом насыщения можно считать содержание углерода, соответствующее эвтектическому составу. [8]
На рис. 5 представлено изменение энтропии растворения углерода на всем исследованном интервале концентраций. Увеличение содержания углерода в сплавах сопровождается постепенным уменьшением степени этого превышения. Несмотря на то, что при значениях NC 0 05 коэффициент активности углерода в сплавах становится больше единицы, изменения энтропии при растворении углерода продолжают и в этих интервалах концентраций превышать значения, отвечающие идеальным растворам. По-видимому, это связано с тем, что процесс растворения углерода в жидком железе характеризуется наличием теплового эффекта, который хотя и невелик, однако не может игнорироваться при оценке термодинамических свойств раствора. При повышении концентрации углерода фактические значения & SC убывают быстрее значений, отвечающих идеальным растворам. [10]
Изучение влияния нагрева углеродного волокна в никелевой матрице при температуре 1100 в течение суток на структуру волокна показало [145, 146], что в этих условиях происходит дальнейшая графитация волокна. В работе [145] высказано предположение о возможном влиянии на свойства волокна процессов растворения углерода в никеле и последующего его осаждения. Сравнительное исследование никелевых композитов показывает, что композиты с углеродным волокном более устойчивы, чем с борным или карбиднокремниевым; в свою очередь, углеродные волокна на основе гидратцеллюлоз-ных волокон более устойчивы, чем волокна, полученные пиролизом ПАН-волокон. [12]
С уменьшением действующего напряжения ( например, сга 24 кгс / мм2) длительность испытания увеличивается и размер карбидов достигает максимального значения. Дальнейшее снижение напряжения до 21 8 кгс / мма сопровождается уменьшением количества частиц. При максимальной нагрузке ( о а 28 3 кгс / мм2) размер и количество частиц оказываются минимальными, даже меньшими, чем в исходном состоянии. Это обстоятельство свидетельствует о том, что наряду с выделением частиц во времени при больших уровнях деформаций протекает такж процесс растворения углерода и карбидообразующих элементов. [13]
Отжиг при температурах выше At ( Л3) применяется для деталей малого и среднего веса, имеющих ответственное назначение. При нагреве до Ас, снимаются внутренние напряжения, тонкие структуры переходят в перлит. При температуре A ct происходит превращение перлита в аустенит. В чугунах феррито-перлитных от Асг до АСз феррит растворяется в аустените. В чугунах перлитных процесс фазового изменения заканчивается в точке Асг. В чугунах пер-лнто-цементитных от Ле1до А ест происходит процесс растворения цементита в аустените. При температурах выше ACI, Ас Асст и во время выдержки идет процесс растворения углерода в аустените, который поступает из графитовых включений чугуна. [14]
Растворимость углерода в а-фазе составляет 0 48 % С при температуре перитектоидной реакции и резко уменьшается с температурой ( рис. IV. По этой причине при содержании углерода более 0 1 % в структуре появляются выделения карбидов. Углерод оказывает на свойства титана меньшее влияние, чем кислород и азот. Прочностные свойства титана повышаются до содержания 0 3 % вес. [17]
Растворимость углерода и других примесей в жидкой стали значительно выше, чем в твердой. Когда металл расплавляется и образуется ванна, в нее устремляются углерод, фосфор и сера. Тонкий слой основного металла, примыкающий к жидкой ванне, обедняется примесями. Жидкий металл по границе с твердым насыщается ими. Когда начинается кристаллизация, тонкий слой кристаллов, образовавшихся из жидкости с повышенной концентрацией примесей, захватывает эти примеси. За этим слоем расположен слой, содержание примесей в котором приблизительно равно среднему содержанию их в жидком металле сварочной ванны. Третий слой примыкает к временной границе раздела между жидким и твердым металлом, образующейся при перерыве кристаллизации. Из него примеси успевают продиффундировать в жидкий металл. В слое, примыкающем к временной границе раздела, содержание их снижается, а в жидком металле повышается. Таким образом, каждая чешуйка металла сварного шва состоит из трех слоев: нижнего - с повышенным содержанием примесей, среднего - с нормальным средним содержанием примесей и верхнего, обедненного примесями. [18]
Растворимость углерода и других примесей в жидкой стали значительно выше, чем в твердой. Когда металл расплавляется и образуется жидкая ванна, в нее устремляются углерод, фосфор и сера. Тонкий слой основного металла, примыкающий к жидкой ванне, обедняется примесями. Жидкий металл по границе с твердым насыщается ими. Когда начинается кристаллизация, тонкий слой кристаллов, образовавшихся из жидкости с повышенной концентрацией примесей, захватывает эти примеси. За этим слоем расположен слой, содержание примесей в котором приблизительно равно среднему содержанию их в жидком металле сварочной ванны. Третий слой примыкает к временной границе раздела между жидким и твердым металлом, образующейся при перерыве кристаллизации. Из него примеси успевают продиффундировать в жидкий металл. В слое, примыкающем к временной границе раздела, содержание примесей снижается, а в жидком металле - повышается. Таким образом, каждая чешуйка металла сварного шва состоит из трех слоев: нижнего - с повышенным содержанием примесей, среднего - с нормальным средним содержанием примесей и верхнего, обедненного примесями. [19]
Растворимость углерода в у-твсрдом растворе с увеличением содержания хрома уменьшается, а в а-твердом растворе увеличивается. [20]
Растворимость углерода в ниобии и тантале оценивается не более, чем в 0 02 % атомн. Эти карбиды сгорают на воздухе и склонны - превращаться в нитриды под действием азота. [21]
Растворимость углерода в альфа-железе крайне невелика. [22]
Растворимость углерода в ( х-фазс сравнительно невелика, она составляет 0 48 % при температуре перитектонднои реакции и резко уменьшается с понижением температуры. [24]
Растворимость углерода в у-твердом растворе, который обладает гранецентрированной кубической структурой, больше, чем в а - и б-твердых растворах с объемноцентрированной кубической структурой. [26]
Растворимость углерода в аустените хромоникелевой стали весьма ограничена, поэтому при длительном пребывании стали в интервале температур 500 - 800 из пересыщенного твердого раствора аустенита выделяются карбиды, главным образом хрома, которые располагаются по границам зерен. Это нарушение, однородности структуры стали связано с рядом явлений, отрицательно влияющих на физико-химические свойства стали. [27]
Растворимость углерода даже в мышьяке, нагретом до температуры кипения, крайне незначительна. [28]
Растворимость углерода в расплавленном висмуте при 1385, 1408 и 1490 составляет соответственно 0 012Г 0 0168 и 0 023 %, а при охлаждении висмута углерод выкристаллизовывается в виде графита. [29]
Науглероживание металлов
Растворимость углерода в железе, марганце, хроме достаточно велика, особенно в жидком состоянии, и может достигать 5 - 7 %. При получении металлов углетермическим восстановлением в металлах растворяется значительное количество углерода - они науглероживаются. Это объясняется не только благоприятными термодинамическими возможностями, но и созданием кинетических условий, способствующих растворению углерода в металле при его получении. В шахтных и ферросплавных печах струи жидкого металла стекая на подину печи, контактируют с кусками кокса и поглощают углерод, кроме того, идет насыщение металла углеродом при распаде оксида углерода, при контакте с углеродистой футеровкой печи. В ферромарганце концентрация углерода может достигать 7 %, в феррохроме - 8 %, в железе - 6,67 %.
Процессы науглероживания или обезуглероживания протекают и при нагреве металла в нагревательных термических печах при нагреве перед горячей деформацией металла.
Науглероживание газами
При нагреве стали в атмосфере, содержащей СО, происходит науглероживание поверхностного слоя металла. Процесс этот, иногда называемый цементацией, имеет большое значение для термообработки. Насыщение поверхностного слоя углеродом значительно повышает прочностные, режущие и другие механические свойства стали.
Реакция науглероживания может протекать по схеме I:
по схеме II с образованием устойчивого карбида:
По принципу Ле-Шателье повышение давления газовой фазы и понижение температуры будут способствовать науглероживанию, так как реакции (145) и (146) идут с выделением тепла ΔΗ< 0.
Для определения равновесного состояния в системе СО2 - Fe - С рассмотрим диаграмму состояния системы железо - углерод в той ее части, которая относится к процессам цементации: до 2 % углерода и при 500 - 1200 о С (рис. 50). При t > 720 °С на диаграмме имеются две двухфазные области: в одной из них (левой) в равновесии находятся аустенит А и феррит Ф (растворы углерода в α-Fe и γ-Fe), в другой области (правой) находятся в равновесии аустенит и цементит Fe3C. При , более низких температурах имеется двухфазная область: феррит + цементит. В соответствии с диаграммой в табл. 12 приведены возможные реакции цементации железа.
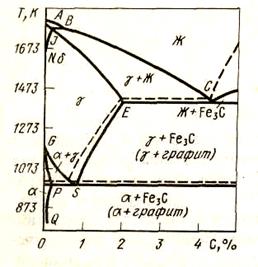 |
Рисунок 50 - Диаграмма состояния системы железо — углерод
Таблица 12 - Процессы цементации железа
| Тип взаимодействия | Число | |
| Компонентов (К) | Фаз (Ф) | Степеней свободы (С) |
| 1.СО +СО2↔А* | ||
| 2.СО +СО2↔А+Ф | ||
| 3.СО +СО2↔Ф**+Fe3C | ||
| 4.СО +СО2↔A+Fe3C | ||
| * А — аустенит, ** Ф — феррит. |
Все системы трехкомпонентны и состоят из углерода, железа и СO2. По правилу фаз С = К - Ф + 2 система 1 имеет 3 степени свободы: давление, температуру, концентрацию углерода в аустените. Системы 2, 3, 4 имеют по две степени свободы - температуру и давление.
Для всех указанных в табл. 12 взаимодействий значения константы равновесия должны быть одними и теми же:
(реакции газификации углерода),
Известно, что активность углерода в Fe3C выше, чем в графите, т.е. > 1
По данным М.И.Темкина и Л.А.Шварцмана, активность углерода в железе зависит от его концентрации: если за стандартное состояние принять графит, для которого аC = 1
где NC и NFe - атомные доли С и Fe.
Разность NFe - NC связана с тем, что около атомов углерода в железе повышается электронная плотность и атомы углерода заполняют только 1/4 вакантных мест. За стандартное состояние принят разбавленный раствор углерода в γ-Fe.
Рассмотрим условия существования различных фаз в системе Fe - С и соотношение PCO/PCO2 , которое принимаем за меру активности углерода при P = const (см. рис. 51) при различных температурах.
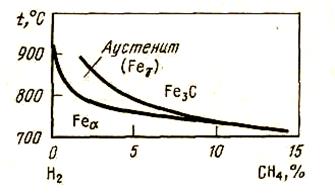 |
Рисунок 51 - Условия существования фаз в системе железо — углерод
1.Температура T1. В широком интервале концентраций углерода существуют две фазы: феррит и цементит. Для этой системы по правилу фаз: РCO/РCO2 = f(T) и при T = const РCO/РCO2 = const> что свидетельствует о постоянстве активности углерода независимо от соотношения количества фаз.
2.Температура T2. От 0 до концентрации C1 и от концентрации C2 и далее сохраняется постоянство активности углерода, различной в этих двухфазных областях. Поэтому в одной и в другой активности углерода не зависят от соотношения фаз. В интервале от ci до с2 в однофазной области РСО/РСО2 = f(T,NC) и при постоянной температуре РСО/РСО2 является функцией Nc, активность углерода возрастает с повышением концентрации углерода в аустените.
Следствием этого анализа является то, что для двухфазной области равновесный состав газовой фазы и активность углерода однозначно задаются температурой. В однофазной области активность углерода в железе определяется как температурой, так и соотношением Рсо/Рсо2*. Это верно при постоянном общем давлении.
Для давления 101,3 кПа диаграмма цементации железа оксидом углерода представлена на рис. 52. На этой диаграмме область существования двух твердых фаз превратилась в кривую, положение которой определяется изменением содержания углерода в насыщенном растворе под влиянием температуры. Так, кривая GS' соответствует равновесию: Ф + А ↔ СО - СО2,
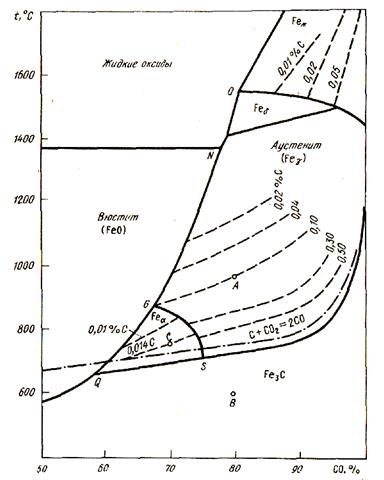
Рисунок 52 - Диаграмма равновесий науглероживания железа оксидом углерода (П)
кривая SE - равновесию Fe3C + А ↔СО - СО2 и кривая SQ - равновесию Ф + Fe3C ↔ СО - СO2. Каждая кривая отражает изменение состава газовой фазы под влиянием температуры для данной двухфазной твердой системы.
Между кривыми QN и QE находятся области однофазных систем. Между QG и QS - область феррита, между GN и SE - аустенит, выше линии ОР - углеродистый жидкий расплав. В каждой области имеется система линий для определения концентраций углерода, показывающих зависимость состава газовой фазы от температуры. Эти линии нанесены на диаграмме пунктирными линиями. Направление линий отражает вид зависимости РCO/РCO2 от T.
С ростом содержания углерода в растворе увеличивается и его активность а[С]. Кривые смещаются в сторону большего содержания СО в газовой фазе, вплоть до линии SE, соответствующей активности метастабильного Fe3C. Активность углерода в Fe3C (линия SE) будет больше активности графита в соответствии со штрихпунктирной линией.
С помощью данной диаграммы можно выбирать условия для науглероживания или обезуглероживания железа и состава конечного продукта при восстановительных процессах. Для науглероживания отношение РCO/РCO2 должно превышать равновесное для данной твердофазной системы (РCO/РCO2 )равн. Для обезуглероживания значение РCO/РCO2 должно быть меньше. Любая точка на данной диаграмме задает условия процесса: температуру и РCO/РCO2 , а также состав конденсированных фаз для этих условий.
Если, например, возьмем точку А, то, тем самым, определим состав газовой фазы и температуру для получения из вюстита аустенита данного состава (0,10 % С) или определим условия для обезуглероживания стали и чугуна, содержащих цементит, до такого же состава (0,10 % С). При понижении температуры данная точка может сместиться в положение В (температура 600 °С) - в область цементита, т.е. будет происходить предельное науглероживание. Если взять точку С, то она определит условия для обезуглероживания α-Fe, т.е. для получения железа с содержанием 0,014 % С. Для этого необходим нагрев до 750 °С при соотношениях РCO/РCO2 , равных 2,3. Линия GN, разделяющая области вюстита и аустенита, показывает условия предельно низкого науглероживания железа и появления вюстита: Она соответствует двум одновременно протекающим реакциям:
3(FeO) + 3CO = 3Fe + 3CO2;
суммарной реакцией будет реакция восстановления вюстита:
При наличии в системе твердого углерода будет происходить регенерация образующейся С02 по реакции газификации углерода:
Суммарная реакция будет следующей:
Пределы науглероживания железа задаются штрихпунктирной кривой равновесия реакции газификации углерода.
Представляется удобным, как это было сделано С.И.Филипповым, для оценки взаимодействия углеродсодержащей атмосферы с металлом ввести понятие углеродного потенциала πC. Величина углеродного потенциала характеризует науглероживающую способность газовой фазы относительно металла. Углеродный потенциал есть химический потенциал углерода, сравниваемый со стандартным состоянием, для которого aC = 1.
где aC - активность углерода в металле, которую определяет газовая фаза; aC= PC/PC O где PC O - давление пара насыщенного атомного углерода над графитом, принимаемое за стандартное; PC - давление пара атомарного углерода над металлом, в котором' растворен углерод.
Углеродный потенциал газовой фазы связан с общим давлением. Чем выше давление, тем выше потенциал при неизменном соотношении PCO/PCO2. Как следствие возрастания углеродного потенциала является и увеличение науглероживания железа с ростом давления. Для достижения той же степени науглероживания, что и при более низком общем давлении, при повышении давления можно уменьшать отношение СО к СO2. Для интенсификации получения низкоуглеродистого металла применение вакуума может оказаться полезным. На диаграмме цементации при повышении» давления линия SE смещается влево к области вюстита, при этом область аустенита сужается, и при повышенных давлениях вюстит может непосредственно восстанавливаться до Fe3C с помощью газовой фазы.
В шахтных восстановительных печах (например, в доменной печи) обеспечиваются благоприятные условия для науглероживания железа.
По мере опускания твердые материалы попадают в газовую среду с более высокой температурой и одновременно с более высоким содержанием СО. Рост температуры повышает также и скорость процесса. Создаются благоприятные как термодинамические, так и кинетические условия науглероживания восстанавливаемого металла в твердом состоянии. Окончательное содержание углерода в продуктах плавки определяется условиями взаимодействия с жидкими фазами. Работа доменных печей на повышенном давлении газа под колошником способствует науглероживанию железа.
Потенциал углерода в карбидах меньше нуля πС < 0. В ряду Мо2С - Fe3C - Со3С - Ni3С углеродный потенциал возрастает при повышении активности углерода в этих карбидах. При увеличении сродства металла к углероду, т.е. уменьшении активности углерода в карбидах, должно понижаться содержание СО в газе для полнoго науглероживания металла.
Рассмотрим науглероживание железа углеводородсодержащим газом - метаном.
При распаде метана образуется углерод:
Распаду метана способствует повышение температуры и понижение давления. Зависимость изменения свободной энергии и константы равновесия от температуры выражается уравнениями:
ΔG° = 46240 - 29,96·T Дж; lgK = = -2418/T+1,41.
При распаде метана происходит науглероживание железа с образованием раствора: СН4 ↔ [C]Fe + 2Н2, ΔΗ > 0 и с образованием цементита: СН4 + 3Fe↔ Fe3C + 2Н2, ΔΗ
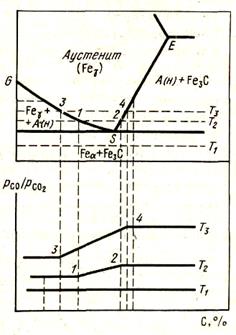 |
Рисунок 53 - Диаграмма науглероживания железа метаном
С.И.Филипповым построена равновесная диаграмма науглероживания железа метаном (рис. 53). С повышением температуры расширяется область науглероживания железа с образованием Fe3C так же, как с понижением давления. При понижении давления равновесные кривые будут смещаться влево, в сторону меньших концентраций СН4 в газовой фазе. По сравнению с диаграммой цементации железа СО здесь поля устойчивости аустенита сужаются. Метан является более активным науглероживателем, чем СО. При обогащении газа водородом будет происходить достаточно глубокое обезуглероживание железа без его окисления.
Читайте также:
