Составление уравнений реакций металлов
Обновлено: 19.05.2024
Все металлы, в зависимости от их окислительно-восстановительной активности объединяют в ряд, который называется электрохимическим рядом напряжения металлов (так как металлы в нем расположены в порядке увеличения стандартных электрохимических потенциалов) или рядом активности металлов:
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au
Наиболее химически активные металлы стоят в ряду активности до водорода, причем, чем левее расположен металл, тем он активнее. Металлы, занимающие в ряду активности, место после водорода считаются неактивными.
Взаимодействие с простыми веществами
Металлы способны реагировать с простыми веществами, такими как кислород (реакция горения), галогены, азот, сера, водород, фосфором и углеродом. В реакцию взаимодействия с кислородом вступают все металлы (исключение составляют Au, Pt), в результате чего возможно образование трех различных продуктов — пероксидов, оксидов и надпероксидов:
K + O2 = KO2 (надпероксид калия)
Металлы средней активности (начиная с Al) и неактивные металлы реагируют с кислородом только при нагревании:
В реакцию взаимодействия с азотом способны вступать только активные металлы, в результате чего образуются азиды, причем при н.у. с азотом реагирует только литий, остальные активные металлы – только при нагревании:
Только активные металлы способны взаимодействовать с углеродом и водородом, причем в случае реакции с водородом – это только щелочные и щелочноземельные металлы:
2Na + H2 = NaH (гидрид натрия)
С серой реагируют все металлы кроме Au и Pt:
2K +S = K2S (сульфид калия)
Также металлы способны взаимодействовать с галогенами и фосфором:
2Na + Cl2 = 2NaCl (хлорид натрия)
3Ca + 2P = Ca3P2 (фосфид кальция)
Все реакции взаимодействия с простыми веществами носят окислительно-восстановительный характер, металлы в них окисляются, проявляя свойства восстановителей, т.е. демонстрируют способность отдавать электроны:
Fe -2e = Fe 2+ процесс окисления, железо — восстановитель
S +2e = S 2- процесс восстановления, сера – окислитель
Взаимодействие металлов друг с другом
Металлы взаимодействуют друг с другом, образуя интерметаллические соединения:
Взаимодействие металлов с водой
Активные металлы (щелочные и некоторые щелочноземельные металлы — Ca, Sr, Ba) способны взаимодействовать с водой с образованием гидроксидов:
Металлы, характеризующиеся средней активностью (начиная с Al) вступают в реакцию с водой в более жестких условиях (наличие щелочной или кислотной среды и др. условия); при этом образуется соответствующий оксид и выделяется водород:
Неактивные металлы с водой не реагируют.
Реакции взаимодействия металлов с водой также относятся к ОВР и металлы в них являются восстановителями.
Взаимодействие металлов с кислотами
Металлы, стоящие в ряду активности до водорода способны реагировать с кислотами:
Неактивные металлы взаимодействуют с кислотами при особых условиях. Так, концентрированная серная кислота способна растворять медь (1), а при взаимодействии меди с концентрированной азотной кислотой в зависимости от её концентрации (60% или 30%) образуются различные продукты реакции (2, 3):
Взаимодействие металлов с солями
Более активные металлы способны взаимодействовать с солями, образованными менее активными металлами, и вытеснять их (металлы) из солей:
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
20 декабря 2021
· Обновлено 20 декабря 2021
Ждём вас 8 октября в 13:00. Вместе с педагогами, психологами и другими экспертами в образовании и воспитании ответим на главные вопросы мам и пап.
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков

Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Презентация "Составление уравнений реакций, решение задач по теме "Химические свойства металлов"


Цели работы по данной обучающей программе
Необходимо знать:
классы неорганических соединений, с которыми металлы вступают в химические реакции;
продукты, которые получаются при протекании химической реакции;
вклад каких процессов, протекающих с выделением или поглощением энергии, определяет положение каждого элемента в электрохимическом ряду напряжений металлов
Необходимо уметь:
составлять молекулярные формы уравнений химических реакций, полную и краткую ионные формы уравнений реакций, протекающих в растворах;
определять окислитель, восстановитель в окислительно-восстановительных уравнениях реакций;
подбирать коэффициенты в уравнениях реакций методом электронного баланса;
выполнять расчеты по уравнениям химических реакций.

Классификация химических реакций
Химическая форма движения материи сложна, поэтому не существует единой классификации химических реакций. Реакции подразделяют на группы по различным признакам. В данном случае мы остановимся на классификации химических реакций, когда основанием классификации будут являться следующие признаки:
количество исходных веществ и продуктов реакции, состав веществ;
изменяются или остаются постоянными степени окисления элементов.

Классификация химических реакций
Если основание классификации «количество исходных веществ и продуктов реакции, состав веществ», то выделяют следующие типы химических реакций:
реакции соединения – это такие реакции, в результате которых из одного или нескольких исходных веществ образутся одно сложное вещество
2Fe + 3Cl2 = 2FeCl3
реакции разложения – это такие реакции, в результате которых из одного сложного вещества образуется два и более новых веществ
2Fe(ОН)3 = Fe2О3 + 3Н2О

Классификация химических реакций
реакции замещения – это такие реакции, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе
Zn + Н2О = ZnО + Н2 ↑
реакции обмена – это реакции, в результате которых два сложных вещества обмениваются своими составными частями
FeCl2 + 2AgNO3 = Fe(NO3)2 + 2AgCl↓

Классификация химических реакций
Если основание классификации «значение степени окисления элементов», то реакции бывают
окислительно-восстановительные – реакции в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества
Zn + 2HCl = ZnCl2 +H2↑
0 0
Zn + 2H+ = Zn2+ + H2 ↑
не окислительно-восстановительные (например, реакции ионного обмена)

Алгоритм подбора коэффициентов в окислительно-восстановительных уравнениях реакций
Под восстановлением понимают процесс присоединения электронов атомами, или молекулами. Степень окисления при этом понижается.
+2 0 +2
Сu + 2e → Сu Сu - окислитель
Атомы, ионы или молекулы, принимающие электроны, называют окислителями.
Под окислением понимают процесс отдачи электронов атомами, ионами или молекулами.
0 +2 0
Сu - 2e → Сu Сu - восстановитель
Атомы, ионы или молекулы, отдающие электроны, называют восстановителями.

Алгоритм подбора коэффициентов в окислительно-восстановительных уравнениях реакций
В окислительно-восстановительных реакциях число электронов, отдаваемых восстановителем, равно числу электронов, принимаемых окислителем, т.е. соблюдается электронный баланс. Метод электронного баланса применяют для записей электронных уравнений процессов окисления и восстановления.
Например, реакцию алюминия с хлоридом меди (II) описывают схемой:
+2 -1 0 +3 -1 0
Cu Cl2 + Al → AlCl3 + Cu
а электронные уравнения будут иметь вид:
+2 восстановление 0
Cu + 2e → Cu 3
окислитель
0 окисление +3
Al -3e → Al 2
восстановитель
Молекулярное уравнение этой реакции написать уже несложно, так как коэффициенты для него будут взяты из электронных уравнений:
3Cu Cl2 + 2Al → 2AlCl3 + 3Cu

Алгоритм решения задач
При решении задач следует соблюдать следующий порядок действий:
прочитать условие задачи;
записать данные задачи в тетрадь;
составить уравнение реакции, по которому необходимо провести расчет;
если в условии задачи дана масса вещества, или объем, то необходимо найти соответствующие значения количества вещества;
над уравнением реакции над соответствующим веществом поставить значение количества вещества и x (неизвестное) над веществом, для которого необходимо определить неизвестную величину;
под уравнением реакции под соответствующим веществом поставить значение количества вещества в соответствии с коэффициентом реакции и под веществом, для которого необходимо определить неизвестную величину, также поставить количество вещества в соответствии с коэффициентом реакции;
составить пропорцию;
определить неизвестное количество вещества x ;
найти необходимую величину.

Основные формулы для определения количества вещества
n – количество вещества (моль);
m – масса (г);
M – молярная масса (г/моль);
N – число молекул;
NA= 6*10231/моль – постоянная Авогадро
V – объем (л)
VM= 22,4 л/моль (при нормальных условиях) –молярный объем газа

Пример решения задачи
Задача. Определите объем водорода, который выделится при взаимодействии 0,23 г натрия с водой.
Дано: Решение:
m(Na)=0,23 г
0,01 моль х
V(Н2) = ? 2Na + 2Н2О = 2NaОН + Н2
2 моль 1 моль
n= m / M; М (Na) = 23 г/моль;
n(Na) = 0,23г / 23 г/моль = 0,01 моль;
V = VM * n; V (Н2) = 22,4 л/моль * 0,01 моль = 0,224 л
Ответ: V (Н2) = 0,224 л

Строение атомов металлов.
Металлическая связь.
Металлическая кристаллическая решетка
Если в периодической системе мысленно провести диагональ от водорода к астату, то левее и ниже окажутся элементы главных подгрупп, у которых преобладают металлические свойства. Металлические свойства характерны также для всех элементов побочных подгрупп.
К металлам принадлежат почти все s- элементы, многие p-элементы, все d- и f-элементы. Общим для строения атомов металлов является наличие на наружном энергетическом уровне электронной оболочки небольшого числа электронов (1-3), слабо связанных с ядром.
Металлическая химическая связь осуществляется за счет взаимного притяжения положительно заряженных атом-ионов и отрицательно заряженных свободно движущихся электронов.
Упаковка атом-ионов в кристалле может быть разной: плотнейшую гексогональную кристаллическую решетку имеют бериллий, магний, цинк; плотную кубическую гранецентрированную имеют алюминий, медь, серебро, свинец, золото; кубическую объемноцентрированную имеют натрий, железо, ванадий.
Общность в физических свойствах связана с наличием в кристаллах свободно движущихся электронов.

Общие химические свойства металлов
На внешнем энергетическом уровне атомов металлов находится от одного до трех электронов, которые атомы металлов отдают в ходе протекания химических реакций и превращаться в положительно заряженные ионы, т.е. металлы в реакциях являются восстановителями.

Схема генетической связи между классами неорганических соединений
МЕТАЛЛЫ
Химические уравнения

Из этой статьи вы узнаете, что такое химические уравнения, зачем они нужны и как их составлять, а также вспомните классификацию химических реакций — все это, конечно, с примерами уравнений.
· Обновлено 12 июля 2022
Химическое уравнение — это условная запись химического превращения с помощью химических формул и математических знаков
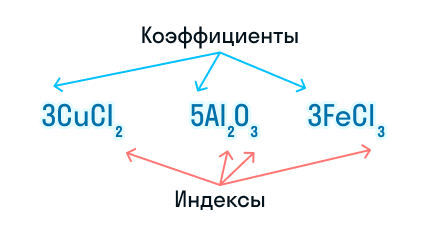
При составлении химических уравнений используют математические знаки «+», «−», «=», а также числа — они выступают в качестве коэффициентов и индексов.
Коэффициенты показывают число частиц (атомов или молекул), а индексы — число атомов, которые входят в состав молекулы.
Химическую реакцию можно изобразить в виде схемы:
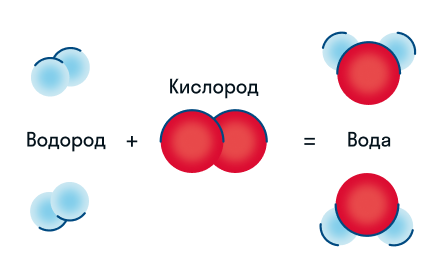
На схеме протекание реакции представлено нагляднее, но сложные химические процессы изобразить таким способом сложно. Поэтому их записывают в виде химического уравнения.
Вещества, которые вступают в реакцию, называют исходными веществами, или реагентами. Вещества, которые образуются в результате, называют продуктами реакции.

Давайте разберем этот пример химического уравнения. Здесь видно, что из двух молекул водорода и одной молекулы кислорода образуются две молекулы воды. Реагенты в данном случае — водород и кислород, продукт реакции — вода.
Новые вещества образуются вследствие перегруппировки исходных атомов. В результате химической реакции атомы химических элементов никуда не исчезают и не возникают новые, их число остается неизменным — это следует из закона сохранения массы веществ.
Закон сохранения массы веществ лежит в основе химии и используется при составлении уравнений химических реакций.
Алгоритм составления уравнения химической реакции
Рассмотрим, как составлять уравнения химических реакций, на примере взаимодействия магния и кислорода с образованием оксида магния.
Записываем химические формулы исходных веществ в левой части уравнения. Напоминаем: молекулы H2, N2, O2, F2, Cl2, Br2, I2 двухатомны. Между исходными веществами ставим «+», а затем знак «=».
После знака равенства записываем химическую формулу продукта. Химическую формулу необходимо составить с учетом валентностей химических элементов.
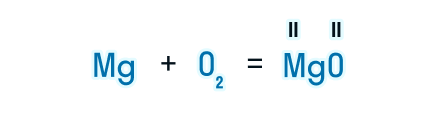
Согласно закону сохранения массы веществ, число атомов каждого химического элемента до и после реакции должно быть одинаковым. Давайте посмотрим, как расставлять коэффициенты в химических уравнениях, чтобы закон выполнялся.
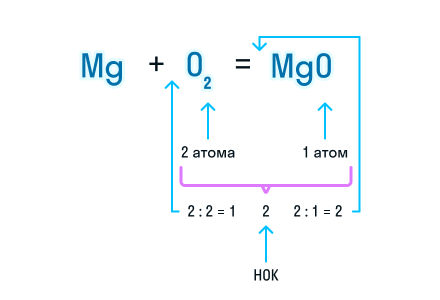
Из составленной химической реакции видно, что количество атомов магния слева и справа от знака равенства одинаково, но атомов кислорода слева два, а справа один.
Чтобы уравнять число атомов в химическом уравнении, находим наименьшее общее кратное (НОК), в нашем случае — 2. А затем делим НОК на количество атомов кислорода в реагентах и полученное число записываем в виде коэффициента.
Коэффициент 1 в уравнении химической реакции не указывается, но при подсчете суммы коэффициентов в уравнении его необходимо учитывать.
Проверим количество атомов магния до и после знака «=». Если перед химической формулой уже стоит коэффициент, то для подсчета количества атомов необходимо умножить коэффициент на индекс, который относится к этому химическому элементу.
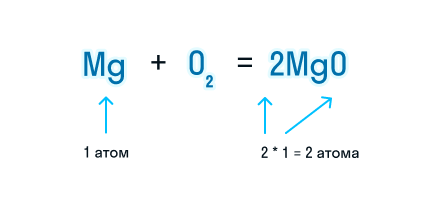
Чтобы уравнять количество атомов магния в химической реакции, посчитаем НОК и разделим его на количество атомов с каждой стороны от знака «=». Результат деления и будет являться коэффициентом (повторяем расстановку коэффициентов в химическом уравнении из 3-го пункта).
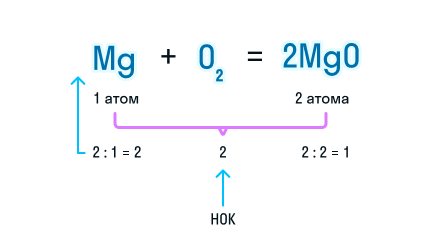
Получаем уравнение химической реакции, в котором в исходных веществах и продуктах реакции по 2 атома магния и кислорода.
Сумма коэффициентов в этом химическом уравнении равна 5 (2 + 1 + 2 = 5).
Коэффициенты, которые стоят в химическом уравнении перед веществами, указывают на мольное соотношение исходных веществ и продуктов реакции, по которому и производятся расчеты.
Типы химических реакций
Химические реакции можно классифицировать по различным признакам:
По числу и составу исходных веществ и продуктов реакции.
По изменению степени окисления.
По тепловому эффекту.
По агрегатному состоянию.
По наличию или отсутствию катализатора.
По числу и составу исходных веществ и продуктов реакции
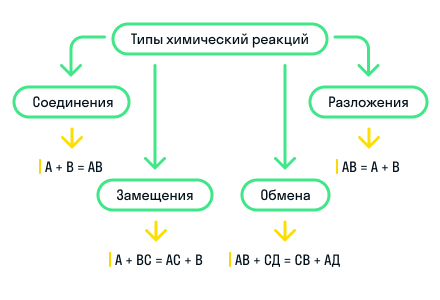
По этому признаку выделяют 4 типа реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Реакции соединения — это реакции, в результате которых из нескольких более простых веществ образуется одно более сложное.
Например, простые вещества барий и кислород взаимодействуют с образованием сложного вещества оксида бария:
Также к реакциям соединения относится взаимодействие оксида натрия с водой с образованием более сложного вещества гидроксида натрия. Оно более сложное, так как состоит уже из трех атомов химических элементов, в отличие от веществ-реагентов, которые состоят из двух атомов:
Реакции разложения — это реакции, в результате которых из одного более сложного вещества образуется несколько более простых веществ. Является процессом, обратным реакции соединения.
Пример такой реакции — разложение нитрата серебра на несколько более простых веществ: серебро, оксид азота (IV) и кислород.
Стрелка вверх означает, что получившееся вещество является газом, который покидает место проведения реакции и больше не участвует в ней.
Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы одного химического элемента в сложном веществе. Также возможно замещение функциональных групп в сложном веществе.
Например, замещение атомов водорода в молекуле соляной кислоты на атомы цинка:
Реакции обмена — это реакции между двумя сложными веществами, в результате которых вещества обмениваются своими составными частями.
Реакция щелочи с кислотой называется реакцией нейтрализации и является частным случаем реакции обмена.
Для наглядности показали все типы химических реакций по этому признаку на схеме:
По изменению степени окисления
По этому признаку выделяют два вида реакций:
реакции, протекающие без изменения степени окисления;
окислительно-восстановительные реакции (ОВР) — реакции, протекающие с изменением степени окисления нескольких элементов.
В ОВР всегда участвуют вещество-окислитель и вещество-восстановитель. Другие исходные вещества, принимающие участие в реакции, выступают в качестве среды, в которой протекает эта реакция.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции принимает электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции отдает электроны, тем самым повышая свою степень окисления.
Из определений можно сделать вывод, что в ходе реакции протекает два процесса: принятие электронов (восстановление) и отдача электронов (окисление). Протекают они одновременно.
По тепловому эффекту
По тепловому эффекту реакции делятся на эндотермические и экзотермические.
Эндотермические реакции протекают с поглощением теплоты (−Q). Буквой Q обозначается количество теплоты.
К таким реакциям относятся практически все реакции разложения. Пример:
Экзотермические реакции протекают с выделением теплоты (+Q).
К таким реакциям относятся практически все реакции соединения. Пример:
По агрегатному состоянию исходных веществ
По этому признаку все реакции разделяют на гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе.
К гомогенным реакциям относятся те, исходные вещества которых находятся либо в жидком агрегатном состоянии, либо в газообразном. Например, взаимодействие двух газообразных веществ — водорода и хлора:
Агрегатное состояние указывается в правом нижнем углу: «г» — газообразное, «ж» — жидкое, «тв» — твердое.
Гетерогенные реакции протекают на границе раздела фаз.
Как правило, такие реакции протекают между веществами, которые находятся в разных агрегатных состояниях:
Также к гетерогенным относятся реакции между двумя несмешивающимися жидкостями. Собрали несколько примеров гетерогенных реакций:
Между какими веществами протекает
Между жидкостью и твердым веществом
Сода и уксусная кислота
Между твердым веществом и газом
Между жидким веществом и газом
Между двумя несмешивающимися жидкостями
По наличию или отсутствию катализатора
По этому признаку выделяют реакции каталитические и некаталитические.
Каталитические реакции — реакции, протекающие с участием катализатора
Катализатор — вещество, которое ускоряет реакцию, участвует в ней, но остается неизменным после окончания этой реакции.
Наличие катализатора указывается над знаком равенства как kat или формула конкретного вещества, выступающего в роли катализатора.
Некаталитические реакции — реакции, протекающие без участия катализатора.
По обратимости
Различают обратимые и необратимые реакции.
Обратимые реакции — реакции, протекающие в двух противоположных направлениях.
При составлении уравнений обратимых реакций вместо знака равенства используют знак «⇄».
К обратимым реакциям относят реакции ионного обмена, диссоциации электролитов и многие другие:
Необратимые реакции — реакции, которые протекают только в одном направлении.
Чтобы научиться составлять уравнения химических реакций, нужно только одно — практика. Много практики школьники получают на онлайн-курсах по химии в Skysmart. Интересные задания на интерактивной платформе, примеры из жизни и опытные преподаватели обязательно приведут к желаемому результату — и просто помогут полюбить химию.
Урок 12. Составление уравнений химических реакций
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.

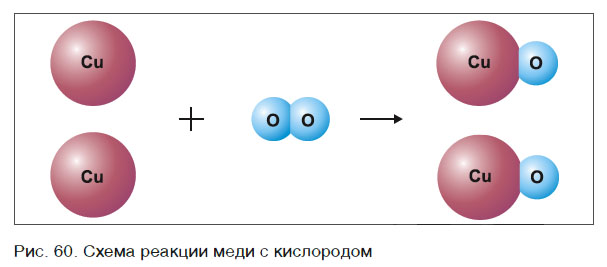
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
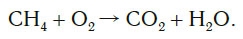
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
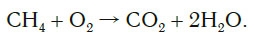
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
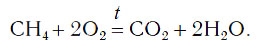
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
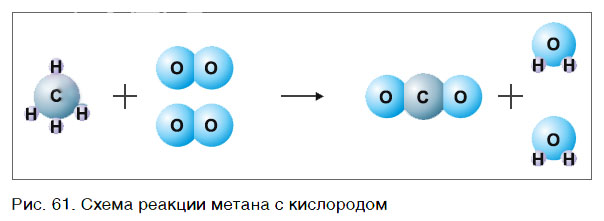
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Читайте также:
