Взаимодействие уксусной кислоты с металлами вывод
Обновлено: 25.04.2024
Олеиновая кислота относится к непредельным карбоновым кислотам. Непредельность соединений можно обнаружить с помощью качественных реакций с бромной водой или раствором перманганата калия. В данном случае воспользуемся бромной водой. К олеиновой кислоте прибавим бромную воду и энергично перемешаем содержимое пробирки. Происходит обесцвечивание бромной воды. Мы доказали, что олеиновая кислота непредельная карбоновая кислота.
СН3 – (СН2)7 – СН=СН – (СН2)7 – СООН + Вr2 = СН3 – (СН2)7 – СНBr – СНBr – (СН2)7 – СООН
Оборудование: пробирка, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с бромом (бромной водой).
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие уксусной кислоты с карбонатом натрия
Уксусная кислота – слабая кислота. Но она способна вытеснять более слабые кислоты из их солей. Убедимся в этом. К раствору карбоната натрия прильем раствор уксусной кислоты. Наблюдается обильное выделение углекислого газа.
Уксусная кислота вытеснила угольную кислоту из раствора ее соли. Угольная кислота – непрочное соединение, она распадается на углекислый газ и воду.
2СН3СООН + Na2CO3 = H2O + CO2 + 2CH3COONa
Оборудование: химические стаканы.
Техника безопасности. Соблюдать правила работы с горючими газами.
Взаимодействие уксусной кислоты с металлами
Уксусной кислоте, как и неорганическим кислотам, присущи общие свойства кислот. Убедимся в том, что эта кислота способна реагировать с металлами. В две пробирки поместим кусочки магния и цинка. Прильем к ним раствор уксусной кислоты. В пробирке с магнием идет энергичная реакция – выделяется водород. В пробирке с цинком, менее активным металлом, выделение водорода едва заметно.
2СН3СООН + Мg = H2 + ( CH3COO)2 Mg
2СН3СООН + Zn = H2 + ( CH3COO)2 Zn
При взаимодействии металлов с раствором уксусной кислоты образуется водород и соли уксусной кислоты. Соли уксусной кислоты называются ацетатами.
Оборудование: штатив для пробирок, пробирка, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с кислотами.
Взаимодействие уксусной кислоты с оксидом меди (II)
Как и неорганические кислоты, уксусная кислота реагирует с оксидами металлов. Проведем реакцию между оксидом меди (II) и уксусной кислотой. При обычных условиях реакция идет очень медленно. Нагреем смесь на пламени горелки. Наблюдается растворение оксида меди и появление голубой окраски раствора. В пробирке образовался ацетат меди (II).
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
Взаимодействие уксусной кислоты с раствором щелочи
Реакция нейтрализации характерна для всех кислот. Нальем в бюретку раствор уксусной кислоты. В колбу для титрования – раствор гидроксида натрия. Прибавим к щелочи немного фенолфталеина. Раствор окрашивается в малиновый цвет. Прибавляем из бюретки раствор кислоты к раствору щелочи. Происходит нейтрализация щелочи. Когда вся щелочь переходит в соль – малиновая окраска исчезает. В растворе образовалась соль – ацетат натрия.
СН3СООН + NaOH = CH3COONa + H2O
Оборудование: штатив, бюретка, стакан химический, коническая колба.
Техника безопасности. Соблюдать правила работы с растворами кислот и щелочей.
Возгонка бензойной кислоты
Бензойная кислота – ароматическая карбоновая кислота. Ее особенность – способность к возгонке. Возгонка — переход из твердого состояния в пароообразное, минуя жидкое. В стакан с бензойной кислотой положим еловую ветку и закроем колбой. В колбе – холодная вода. Колба будет служить и крышкой, и холодильником. Бензойная кислота при легком нагреве переходит из твердого состояния – в парообразное. Соприкасаясь с холодным дном колбы, пары бензойной кислоты охлаждаются – и конденсируются в виде кристалликов бензойной кислоты.
Оборудование: химический стакан, штатив, огнезащитная прокладка, колба круглодонная, горелка.
Техника безопасности. Соблюдать правила работы с нагревательными приборами. Бензойная кислота вызывает раздражение дыхательных путей. После проведения опыта дать прибору остыть и лишь после этого его можно разбирать.
Гидролиз ацетата натрия
Уксусная кислота – слабый электролит. Ацетат натрия – соль образованная сильным основанием и слабой кислотой. При растворении этой соли в воде создается щелочная среда. Особенностью кристаллогидрата ацетата натрия является то, что он при нагревании легко плавится и ацетат натрия растворяется в своей кристаллизационной воде. Смешает ацетат натрия с сухим индикатором фенолфталеином. Полученную смесь нагреем. Появляется малиновая окраска. Соль частично расплавилась, в расплаве появились гидроксид- ионы.
CH3COONa + HOН = СН3СООН + NaОН
CH3COO — + HOН = СН3СООН + ОН —
При охлаждении соль кристаллизуется, равновесие смещается в сторону образования ацетата натрия, гидроксид-илны исчезают, и окраска пропадает. Опыт доказывает, что уксусная кислота является слабой кислотой.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с нагревательными приборами.
Горение уксусной кислоты на воздухе
Безводная уксусная кислота – огнеопасное вещество, ее пары легко загораются. Убедимся в этом. Нагреем уксусную кислоту до кипения. При поднесении горящей лучины пары кислоты загораются. При горении уксусной кислоты образуются углекислый газ и вода.
СН3СООН + 2О2 = 2H2О + 2СО2
Склянки с уксусной кислотой хранят в металлических контейнерах.
Оборудование: штатив для пробирок, пробирка, горелка, лучина.
Замораживание уксусной кислоты
Безводная уксусная кислота при ее охлаждении примерно до 15 0 С переходит в кристаллическое состояние. В этом состоянии она очень похожа по внешнему виду на лед. Поэтому безводную уксусную кислоту называют ледяной. Приготовим охлаждающую смесь из воды и льда. Опустим в нее пробирку с уксусной кислотой. Через некоторое время уксусная кислота кристаллизуется.
Оборудование: химический стакан, пробирка, термометр, штатив.
Карбоновые кислоты – слабые электролиты
Слабые электролиты — это вещества, которые частично распадаются на ионы при растворении в воде. Обнаружить ионы в растворе можно с помощью прибора для изучения электропроводности. Если вещество или его раствор распадается на ионы, то лампочка прибора загорается. Проверим электропроводность уксусной кислоты. Опускаем электроды в концентрированную уксусную кислоту. Лампочка не загорается.
Разбавим уксусную кислоту водой и вновь проверим электропроводность. Лампочка не горит. Прибавим к раствору уксусной кислоты большой объем воды. Лампочка загорается. Мы убедились в том, что уксусная кислота — слабый электролит.
Уксусная кислота в значительной степени распадается на ионы лишь при большом разбавлении водой.
Оборудование: стакан химический, пипетка, набор для опытов с электрическим током.
Техника безопасности. Соблюдать правила работы с кислотами и правила работы с электроприборами.
Образование нерастворимых кальциевых солей жирных кислот
Кальциевые соли жирных кислот нерастворимы в воде. Это можно наблюдать в следующем опыте. К раствору мыла прильем немного раствора хлорида кальция. Выпадает обильный осадок нерастворимого стеарата кальция.
2С17Н35СООNa + СаСI2 =(C17 H35COO)2Ca + 2NaCI
Такой процесс происходит при мытье в жесткой воде. Поэтому мыло в жесткой воде плохо мылится.
Оборудование: штатив для пробирок, пробирки.
Техника безопасности. Опыт безопасен.
Окисление муравьиной кислоты раствором перманганата калия
Муравьиная кислота отличается по строению от всех остальных карбоновых кислот. Поэтому она совмещает свойства и кислоты и альдегида. Альдегиды, как известно, легко окисляются. Прильем к раствору муравьиной кислоты раствор перманганата калия. Нагреем смесь. Происходит обесцвечивание раствора. Муравьиная кислота окислилась до углекислого газа и воды.
НСООН + [О]= H2О + CO2
Техника безопасности. Соблюдать правила работы с кислотами и нагревательными приборами.
Разложение муравьиной кислоты
Под действием водоотнимающих средств муравьиная кислота разлагается с выделением монооксида углерода. В быту он носит название угарный газ. В качестве водоотнимающего средства используем серную кислоту. В пробирку с муравьиной кислотой прибавим концентрированную серную кислоту. Сразу же начинается бурная реакция. Подожжем выделяющийся угарный газ. Он горит голубым пламенем.
НСООН = H2О + CO
Эту реакцию используют в лаборатории для получения угарного газа.
Оборудование: пробирка, зажим для пробирок, газоотводная трубка.
Техника безопасности. Соблюдать правила работы с кислотами. Опыт проводить под тягой.
Растворимость в воде различных карбоновых кислот
Уксусная и масляная кислота при нормальной температуре – жидкости, стеариновая кислота — твердое вещество. Посмотрим, как эти карбоновые кислоты растворяются в воде. В три пробирки с водой добавим разные карбоновые кислоты. Уксусная и масляная кислоты хорошо растворяются в воде, а стеариновая кислота в воде не растворяется. Фиолетовый раствор лакмуса изменяет цвет лишь в растворах уксусной и масляной кислот. В пробирке со стеариновой кислотой лакмус остается фиолетовым.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила безопасности при работе с кислотами.
Исследовательская работа на тему: "Влияние уксусной кислоты на металл"
Меня зовут Ермолаева Виктория. Я учусь в третьем классе, и у меня ещё нет такого предмета, как химия. А в моей комнате есть научная лаборатория с оборудованием и настоящими реактивами. Мне очень нравится проводить опыты, смешивать разные составы, изучать различные вещества и жидкости, узнавать новое и делать открытия.

Я - исследователь от природы и очень люблю задавать вопросы. В процессе любого исследования, как и любого познания, вопрос играет ключевую роль. Можно без преувеличения сказать, что познание начинается с вопроса. Да, это верно, и моя работа началась с вопроса: «Как уксусная кислота влияет на металлы?»
Объекты исследования : железный гвоздь и скрепка в пробирках с уксусной кислотой
Цель исследования.
Выяснить, что произойдет с металлическими предметами под воздействием уксусной кислоты.
Задачи исследования.
Для достижения поставленной цели необходимо решить ряд задач:
1. Изучить объекты исследования.
2. Провести опыт.
3. Сделать вывод.
Моя гипотеза: в уксусной кислоте железо разрушается, то есть ржавеет.
Чтобы провести данное исследование, мы с учителем Еленой Владимировной, изучили специальную литературу (авторы указаны в списке литературы). При участии моей семьи я ставила опыты, наблюдала, анализировала и делала выводы.
Теоретическая часть
В процессе исследования мне понадобились железный (металлический) предмет и уксусная кислота. Изучив каждый компонент исследования, я узнала:
Железо - это элемент 8 группы четвертого периода Периодической системы химических элементов Д. И. Менделеева, с атомным номером 26. Обозначается символом Fe . Это один из самых распространенных металлов в земной коре. Оно имеет серебристо – белый цвет и высокую химическую реакционную способность.

Уксусная кислота одна из первых кислот, которая стала известна людям еще в древности. Обнаружено это было случайно – вследствие появления уксуса при скисании вина. В природе она встречается в растениях или в чистом виде, или в виде эфиров. Уксусная кислота принадлежит к так называемым жирным кислотам. В химическом чистом состоянии она представляет собой бесцветную жидкость с резким запахом. Уксусная кислота находит громадное и разнообразное применение в жизни людей, а так же в промышленности.

Практическая часть
Я подготовила для опыта необходимые инструменты: пробирки, чашку Петри, мерный стаканчик. А так же защитные элементы: перчатки, очки, маску.

Приготовила химические элементы: уксусную кислоту, железо (стальной гвоздь и скрепку, покрытую хромовым напылением).

Я налила в мерный стаканчик 50мл уксусной кислоты.

Взяла из чашки Петри гвоздь, скрепку и поместила их в две разные пробирки.

С помощью мерного стаканчика налила в пробирки уксусную кислоту в равных пропорциях.

Все готово для исследования! Я начала свои наблюдения.

1-й день . Я увидела, что в процессе взаимодействия уксусной кислоты с железом начал выделятся водород. Это проявлялось появлением пузырьков, которые шли от металла к поверхности.
2-й день. Реакция выделения водорода продолжается, а гвоздь и скрепка остаются в первоначальном виде.
3-й день. В третий день наблюдения я вижу, что в первой пробирке водород еще выделяется, а уксусная кислота приобрела розоватый оттенок. Во второй пробирке водород выделяется в малых количестве.
Я пришла к выводу: так как гвоздь покрыт защитным слоем, то и реакция у него с уксусной кислотой небольшая. Поэтому я взяла третью пробирку, поместила в нее стальной винт и налила уксусную кислоту. Сразу же увидела бурную реакцию выделения водорода.

4 день. В нижней части пробирки со скрепкой, уксусная кислота осталась прозрачной, а в верхней части она приобрела оранжевый оттенок.

Во второй пробирке все осталось по-прежнему.

В третьей пробирке все еще наблюдается интенсивное выделение водорода. Уксусная кислота приобрела оранжевый оттенок, появился небольшой осадок, в виде мелких частиц.

5 день. В первой пробирке и во второй все без изменений. В третьей пробирке водород все еще активно выделяется, осадок увеличивается, а уксусная кислота приобретает насыщенно оранжевый оттенок.
6 день. В первой пробирке без изменений. Во второй пробирке уксусная кислота темнеет и приобретает красный оттенок. В третьей пробирке все реакции продолжаются.

7 день. В первой пробирке водород выделяется в малом количестве. Уксусная кислота поменяла цвет и стала бледно-оранжевого оттенка. Во второй пробирке водород выделяется в малом количестве. Уксусная кислота приобрела 3 оттенка. Внизу пробирки она осталась прозрачной, в середине светло-оранжевого оттенка, а вверху пробирки темно оранжевого цвета. В третьей пробирке водород все еще выделяется. Уксусная кислота приобрела темно оранжевый оттенок. А на стенках пробирки появился темный налет.
8 день. В первой пробирке все реакции продолжаются. Вторая пробирка без изменений. В третьей пробирке появляется осадок в большом количестве.
9-10 день. Во всех трех пробирках продолжаются реакции.
11 день. В первой и во второй пробирках без изменений. В третьей пробирке осадок поднялся на поверхность уксусной кислоты. А уксусная кислота начала светлеть.
12 день. В первых двух пробирках те же реакции. А в третьей пробирке уксусная кислота стала светлее, осадок остается на поверхности.
13 день. Во всех трех пробирках продолжаются реакции.
14 день. В первой пробирке уксусная кислота сохраняет два оттенка. Во второй пробирке все еще в небольшом количестве выделяется водород, уксусная кислота имеет темно оранжевый оттенок. В третьей пробирке так же выделяется водород, осадок усел на стенки пробирки, уксусная кислота стала светлой.

2 недели я наблюдала за реакцией уксусной кислоты и железа. Все реакции в пробирках завершились. Теперь посмотрю, что же произошло с металлическими изделиями, помещенными в пробирки.
Я взяла первую пробирку, вылила из нее уксусную кислоту и извлекла скрепку.

Поместив ее в чашку Петри, увидела, что скрепка не поменяла свой первоначальный вид.

Взяла вторую пробирку с гвоздем.

Слила с нее уксусную кислоту и так же увидела, что гвоздь не подвергся коррозии и остался таким, каким и был.

Я выполнила те же действия и с третьей пробиркой.

Винт подвергся коррозии, он почернел, его шляпка деформировалась, покрылась шершавым темным налетом.

Результаты опыта.
В первой пробирке со скрепкой покрытой хромовым напылением реакция была, но небольшая. Уксусная кислота не смогла повредить железо, благодаря защитному слою, которым была покрыта скрепка.
Во второй пробирке гвоздь был покрыт защитным слоем цинка. И, так же как и скрепка не подвергся коррозии под действием уксусной кислоты.
В третьей пробирке винт без защитного слоя, взаимодействуя с уксусной кислотой, показал бурную реакцию, в результате которой он подвергся коррозии и деформировался. Я наблюдала выпадения осадка темно красно-коричневого цвета. Этот осадок называется уксусной солью или по-другому ацетат железа.
Ацетат железа это красно-коричневые кристаллы, которые не растворяются в воде. Из энциклопедии я узнала, что эта соль употребляется в крашении, в ситценабивном деле, для окрашивания в черный цвет. А чистая соль находит применение в медицине.

Уксусная кислота не может повредить железо, если оно покрыто защитным слоем. Если же на железо не нанесен защитный слой, то в процессе реакции уксусной кислоты и железа происходит коррозия металла, а так же в процессе этой реакции получается уксусная соль, которую используют в ситценабивной промышленности и в медицине.
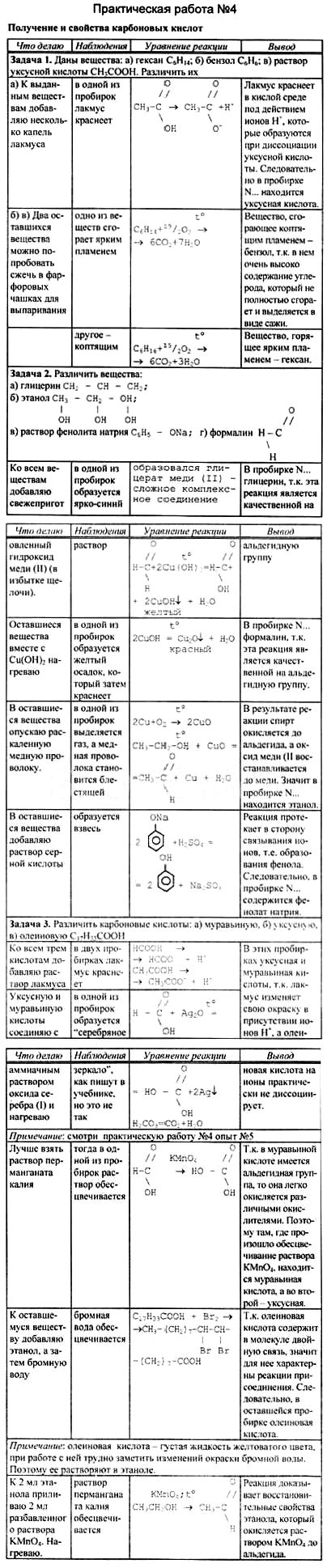
Практическая работа по теме "Карбоновые кислоты"
Цель работы: Получить уксусную кислоту и изучить её свойства.
Реактивы и оборудование: ацетат натрия, серная кислота (конц.), уксусная кислота, магний (порошок), цинк, гидроксид натрия, карбонат натрия, фенолфталеин, универсальная индикаторная бумага, прибор для получения и собирания кислоты, спиртовка, пробирку, вата, спички.
Ход работы: Внимание. Работа с кислотами!! Соблюдайте ТБ!
Опыт 1. Получение уксусной кислоты.
В пробирку с ацетатом натрия прибавить 1- 2 мл концентрированной серной кислоты. Закрыть пробирку пробкой с газоотводной трубкой, конец которой опустите в другую пробирку вход в пробирку прикрыть ваткой, смотрите рисунок:

Смесь в пробирке осторожно нагревайте до тех пор, пока в приёмнике – пробирке не собёрётся 1 -2 мл жидкости. Прекратите нагревание, закройте спиртовку.
Опустите в пробирку с образовавшейся жидкости универсальную индикаторную бумагу. Как изменился цвет индикатора? Почему? Запишите уравнение диссоциации уксусной кислоты.
Опишите запах, образовавшейся жидкости? Соблюдайте осторожность при определении запаха! Составьте уравнение данной химической реакции.
Опыт 2. Взаимодействие уксусной кислоты с металлами.
В одну пробирку положите гранулу цинка, в другую порошок магния. В обе пробирки прилейте 1 мл уксусной кислоты. Что наблюдаете? Сравните скорость этих реакций? Запишите соответствующие уравнения химических реакций, назовите продукты, укажите тип реакции.
Опыт 3. Взаимодействие уксусной кислоты с основаниями.
В пробирку налейте 1 мл гидроксида натрия и добавьте 1 каплю фенолфталеина. Что наблюдаете? Почему?
Затем добавьте к содержимому пробирки уксусную кислоту. Почему происходит обесцвечивание? Запишите УХР, назовите продукты.
Опыт 4. Взаимодействие уксусной кислоты с солями слабых неорганических кислот.
В пробирку налейте 1 мл карбоната натрия и по каплям добавьте уксусную кислоту. Что наблюдаете? Почему?
Запишите УХР, назовите продукты.
Опыт 5 Моющая способность мыла
5.1) Налейте в пробирку 2—3 мл раствора мыла и прибавьте к нему соляной кислоты до образования хлопьев. Что собой представляет этот осадок? Составьте уравнение реакции. Проверьте, растворяется ли осадок в растворе щелочи. Объясните это явление.
5.2) К 2—3 мл раствора мыла в пробирке прилейте раствор хлорида кальция. Что наблюдаете? Напишите уравнение реакции. Какое свойство мыла иллюстрируется данным опытом?
Оформите работу в виде таблицы
Название опыта. Что делали.
УХР. Наблюдения. Выводы
Сделайте общий вывод о проделанной работе.
Опыт 1 . Получение уксусной кислоты.
В пробирку поместили немного ацетата натрия и добавили раствор H2SO4 (1:1). Пробирку закрыли пробкой с газоотводной трубкой, конец которой поместили в другую, чистую пробирку.

Исходную пробирку нагрели. Наблюдаем конденсацию уксусной кислоты в приемнике, чувствуется резкий характерный запах уксусной кислоты.
Опыт 2 . Растворимость карбоновых кислот в воде
В одну пробирку налили 2 мл воды и добавили 3 капли уксусной кислоты, полученный раствор перемешали. В другую пробирку налили 2 мл воды и добавили чуть-чуть бензойной кислоты, содержимое перемешали, бензойная кислота в воде не растворилась. Тогда эту пробирку нагрели. Наблюдаем растворение бензойной кислоты. После охлаждения пробирки осадок вновь выпадает. Прибавили к осадку немного раствора гидроксида натрия. Наблюдаем вновь растворение осадка.

Различие растворимостей кислот объясняется природой вещества.
Опыт 3 . Взаимодействие уксусной кислоты с металлами
В пробирку налили немного уксусной кислоты и добавили 1 гранулу цинка. Пробирку нагрели. Наблюдаем выделение пузырьков газа водорода и растворение гранулы цинка.



Полученную кислоту разделили на 2 части. В первую пробирку поместили лакмусовую бумажку, наблюдаем ее покраснение. Затем прильем немного раствора гидроксида натрия. Помещенная в полученный раствор лакмусовая бумажка синеет. Во вторую пробирку добавили немного порошка магния, наблюдаем выделение газа.
Все кислоты, как органические, так и неорганические реагируют с металлами, стоящими в ряду напряжений до водорода. С металлами, стоящими после водорода, кислоты не будут реагировать, в том числе и уксусная кислота.
Опыт 4 . Получение сложного эфира
В пробирку налили 2 мл изоамилового спирта, 2 мл уксусной кислоты и чуть-чуть концентрированной серной кислоты. Пробирку закрыли пробкой с газоотводной трубкой и нагрели на водяной бане. После охлаждения в пробирку добавили немного воды. При этом выделяется слой изоамилового эфира уксусной кислоты с характерным запахом грушевой эссенции, произошла реакция этерификации.

В реакционную смесь добавляют концентрированную серную кислоту, как водоотнимающее средство, чтобы сместить равновесие вправо.
Опыт 5. Взаимодействие уксусной кислоты с оксидами металлов.

В пробирку с уксусной кислотой добавили немного оксида кальция, наблюдаем его растворение.
Опыт 6. Взаимодействие муравьиной кислоты с с аммиачным раствором оксида серебра.
4. При прилипании в пробирку с аммиачным раствором муравьиной кислоты, смесь нагрели.

Наблюдаем образование налета серебра на стенках пробирки и выделение газа. Муравьиная кислота окисляется оксидом серебра.
Опыт 7. Моющая способность мыла
В пробирку с водой добавили стружек хозяйственного мыла и нагрели. К полученному мыльному раствору добавили раствор НСl. Наблюдаем образование хлопьев:
7. При добавлении к мыльному раствору раствора СаСl наблюдаем образование хлопьев:
Эта реакция иллюстрирует, что моющая способность мыла уменьшается в жесткой воде.
8. При приливании в пробирку с олеиновой кислотой (растительным маслом) бромной воды наблюдаем ее обесцвечивание – признак не предельности.
Лабораторный опыт 3 ГДЗ Рудзитис Фельдман 10 класс (Химия)
1. Получение уксусной кислоты. Поместите в пробирку 2—Зг ацетата натрия и прибавьте 1,5—2 мл концентрированной серной кислоты. Пробирку закройте пробкой с газоотводной трубкой, конец которой опустите в другую пробирку (рис. 31). Смесь нагревайте на пламени до тех пор, пока в пробирке-приемнике не будет 1,0—1,5мл жидкости.
1. Какое вещество образовалось в пробирке-приемнике? Какие свойства уксусной кислоты это подтверждают? 2. Составьте уравнение соответствующей реакции.
2. Взаимодействие уксусной кислоты с некоторыми металлами. B две пробирки налейте по 1 мл раствора уксусной кислоты.
B первой пробирке происходит бурная реакция, а во второй реакция протекает спокойно (иногда она начинается только при нагревании).
Задание для самостоятельного вывода. Как уксусная кислота реагирует с магнием и цинком? Сравните скорость этих реакций и напишите уравнения в молекулярном, ионном и сокращенном ионном виде.
3. Взаимодействие уксусной кислоты с основаниями. Налейте в пробирку 1 — 1,5 мл раствора гидроксида натрия и добавьте несколько капель раствора фенолфталеина. При добавлении уксусной кислоты малиновая окраска фенолфталеина исчезает.
4. Взаимодействие уксусной кислоты со спиртами. B пробирку налейте 2 мл раствора уксусной кислоты. Прилейте 2 мл изоамилового спирта. Затем осторожно добавьте 1 мл концентрированной серной кислоты. Пробирку закройте пробкой с длинной стеклянной трубкой-холодильником. Смесь осторожно подогрейте на водяной бане.
После охлаждения добавьте к содержимому пробирки несколько миллилитров воды. При этом образуются маслянистые капли нерастворимого в воде изоамилового эфира уксусной кислоты с характерным запахом грушевой эссенции.
Задания для самостоятельных выводов. 1. Какие свойства уксусной кислоты сходны со свойствами минеральных кислот? 2. Какие вещества образуются при взаимодействии уксусной кислоты с основаниями? При помощи каких опытов это можно доказать? 3. Какие вещества образуются при взаимодействии уксусной кислоты со спиртами? Напишите уравнение соответствующей реакции.
5. Окисление муравьиной кислоты оксидом cepe6pa(l). B чистую пробирку налейте 2 мл свежеприготовленного раствора с массовой долей нитрата cepe6pa(l) 0,02. Добавьте немного разбавленного раствора аммиака до растворения появившегося осадка. Затем добавьте несколько капель муравьиной кислоты и пробирку со смесью нагрейте в колбе с горячей водой.
Задание для самостоятельного вывода. Почему из всех карбоновых кислот только для муравьиной кислоты характерна реакция «серебряного зеркала»? Напишите уравнение соответствующей реакции.
*Цитирирование задания со ссылкой на учебник производится исключительно в учебных целях для лучшего понимания разбора решения задания.
Читайте также:
